Содержание
- 2. 1. Гетерогенные процессы и равновесия (определение, пример). 2. Растворимость, единица количественного выражения растворимости (массовая растворимость вещества
- 3. Раздел 2. Основные учебно-целевые вопросы: Лигандообменные равновесия и процессы Комплексные соединения - КС (определение, примеры). Структура
- 4. Гетерогенные равновесия в системе осадок- насыщенный раствор малорастворимого электролита Системы Основные понятия Гомогенная- это система, состоящая
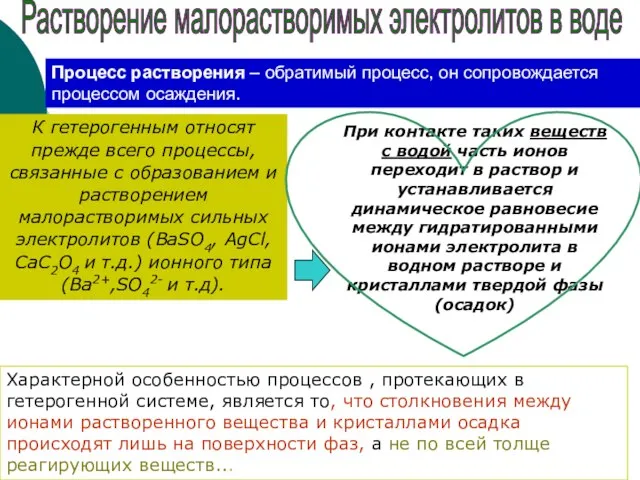
- 5. К гетерогенным относят прежде всего процессы, связанные с образованием и растворением малорастворимых сильных электролитов (ВaSO4, AgCl,
- 6. Т.о., насыщенные растворы относятся к сложным гетерогенным системам, т.к. состоят из нескольких фаз раствор осадок Растворение
- 7. Молярная растворимость - S (т.е. концентрация ионов в насыщенном растворе) Под растворимостью обычно подразумевают концентрацию насыщенного
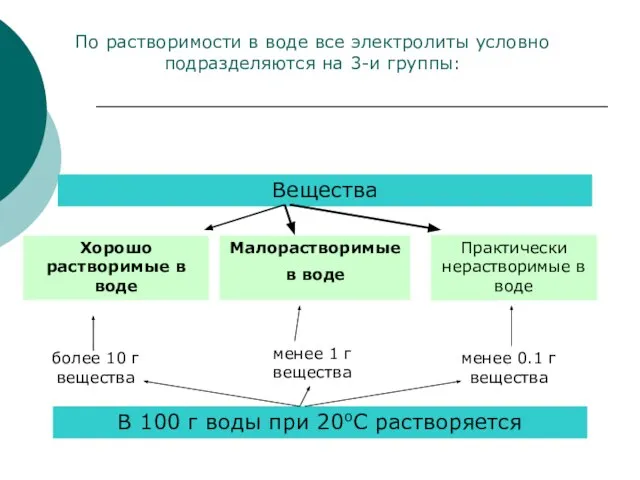
- 8. Вещества Хорошо растворимые в воде Малорастворимые в воде Практически нерастворимые в воде В 100 г воды
- 9. КS малорастворимого сильного электролита — это величина, равная произведению равновесных активностей (или равновесных концентраций) ионов данного
- 10. Константа растворимости КS В общем случае для малорастворимого электролита константа растворимости Ks определяется стехиометрическим произведением концентраций
- 11. КS Безразмерная величина. Применимо к сильным электролитам, у которых молярная растворимость S Значения констант растворимости малорастворимых
- 12. Взаимосвязь Кs и растворимости S: Растворимость малорастворимого электролита KtnAnm (S, моль/л), т.е. молярность его насыщенного раствора,
- 13. Справочная величина Взаимосвязь Кs и растворимости S: Задача 1.
- 14. Условия смещения гетерогенного равновесия В соответствии с уравнением изотермы Вант-Гоффа: возможность смещения равновесия, т.е. образование или
- 15. Пс > Ks – соответствует образованию осадка (перенасыщенный раствор); Пс Пс = Ks система находится в
- 16. Растворимость малорастворимых электролитов: а) понижается при введении в их раствор каких-либо сильных электролитов с одноименным ионом,
- 17. Влияние различных факторов на полноту осааждения осадков и их растворение Различные электролиты, прилитые в одинаковых количествах,
- 18. 1. Осаждение будет тем полнее, чем менее растворимо соединение, в виде которого осаждается данный ион. 2.
- 19. Правило константы растворимости применяется при решении противоположной задачи, т. е. при переведении малорастворимых осадков в раствор
- 20. Химизм образования костной, зубной ткани Костная ткань –особый вид соединительной ткани и она является главной составной
- 21. Химизм образования костной, зубной ткани. Процесс минерализации можно выразить упрощенно суммарными уравнениями: Или пентакальцийтрифосфатгидроксид. Образованию гидроксиапатита
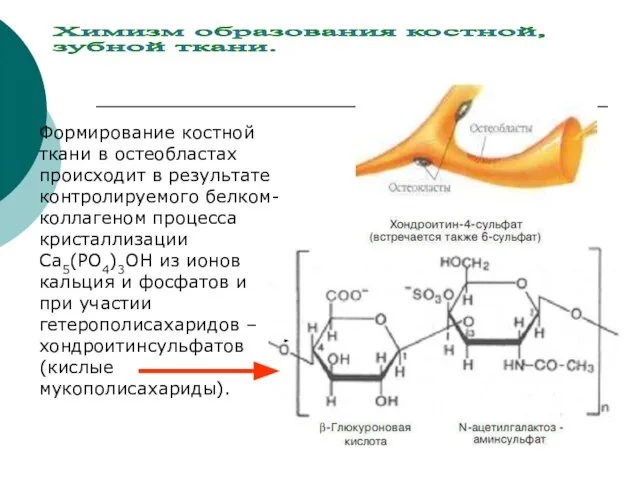
- 22. Формирование костной ткани в остеобластах происходит в результате контролируемого белком- коллагеном процесса кристаллизации Са5(РО4)3ОН из ионов
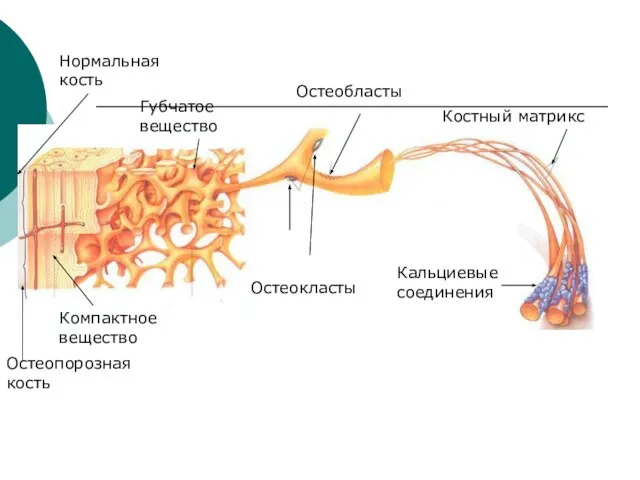
- 23. Кальциевые соединения Костный матрикс Остеокласты Остеобласты Нормальная кость Остеопорозная кость Компактное вещество Губчатое вещество
- 24. Химизм растворения костной и зубной ткани. При небольшом повышении содержания протонов кость начинает растворяться, отдавая вначале
- 25. Минерализация и деминерализации малорастворимых фосфатов кальция согласно принципу Ле Шателье
- 26. Изоморфизм Изоморфизмом (И) - замещение ионов в узлах кристаллической решетки другими ионами, имеющими сходные кристаллохимические характеристики.
- 27. Изоморфизм Отрицательный изоморфизм – замещение ионов кальция в гидроксиапатите на ионы Sr2+(стронциевый рахит- ломкость костей) и
- 28. Механизм кальцификации и функционирования кальциевого буфера Ежедневно из костей скелета уходит и возвращается в него 700-800
- 29. Основными регуляторами кальций-фосфорного обмена в организме человека являются витамин D и гормоны паратирин и кальцитонин. Витамин
- 30. Гетерогенные процессы в организме.
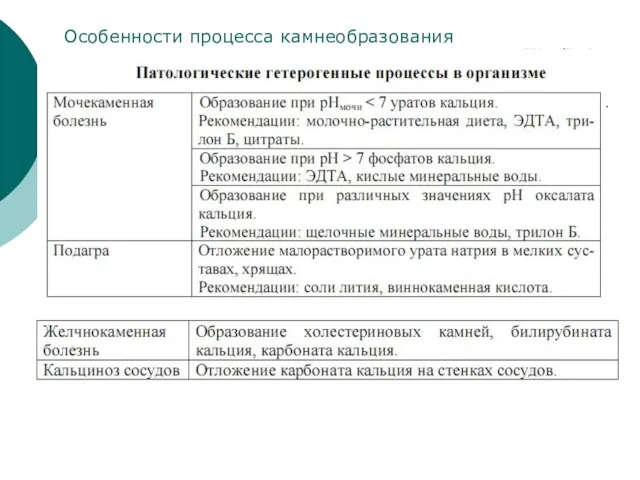
- 31. Особенности процесса камнеобразования
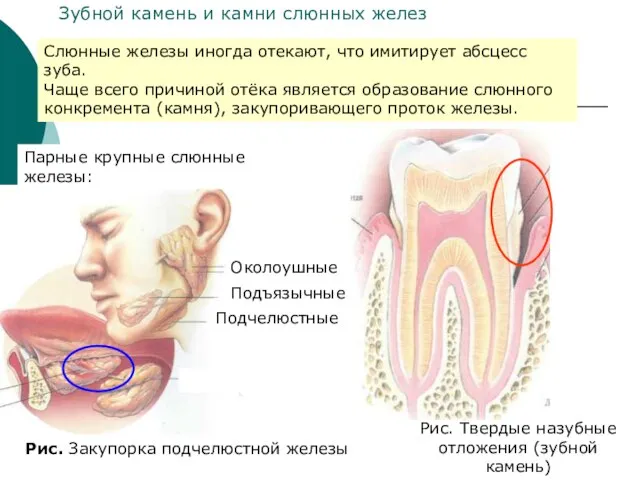
- 32. Парные крупные слюнные железы: Околоушные Подъязычные Подчелюстные Рис. Закупорка подчелюстной железы Слюнные железы иногда отекают, что
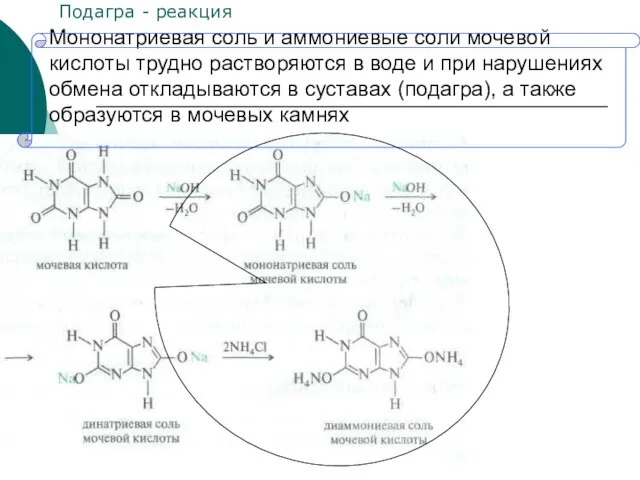
- 33. Мононатриевая соль и аммониевые соли мочевой кислоты трудно растворяются в воде и при нарушениях обмена откладываются
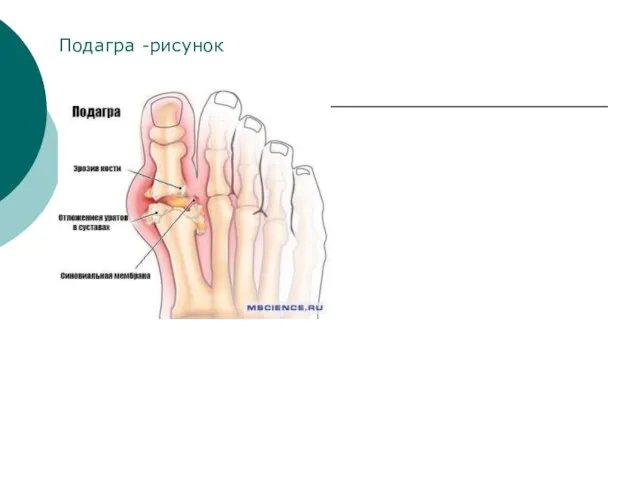
- 34. Подагра -рисунок
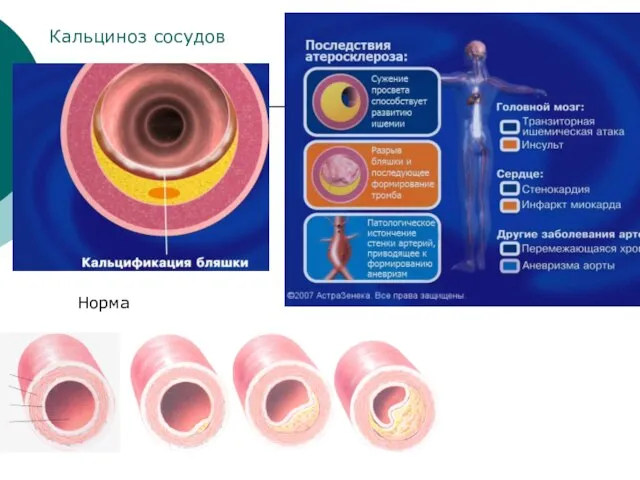
- 35. Норма Кальциноз сосудов
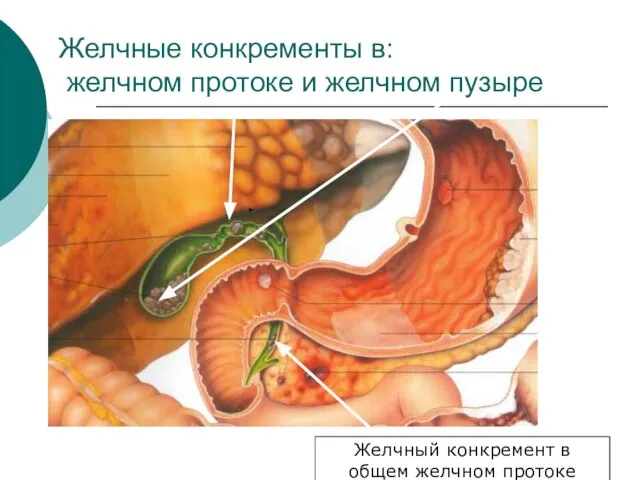
- 36. Желчные конкременты в: желчном протоке и желчном пузыре Желчный конкремент в общем желчном протоке
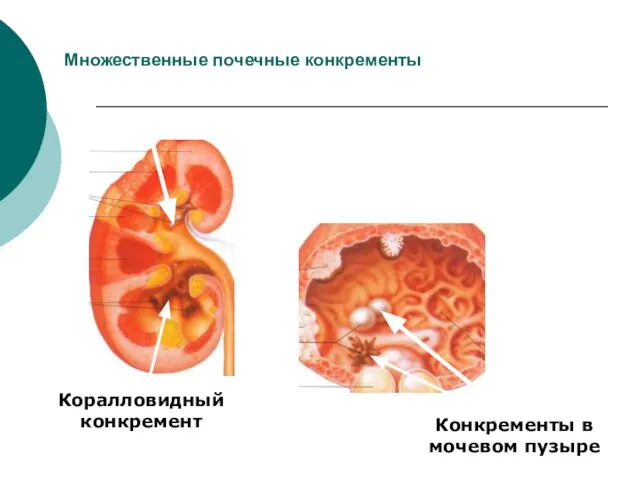
- 37. Множественные почечные конкременты Коралловидный конкремент Конкременты в мочевом пузыре
- 38. Комплексные соединения составляют наиболее обширный и разнообразный класс химических соединений. В живых организмах присутствуют комплексные соединения
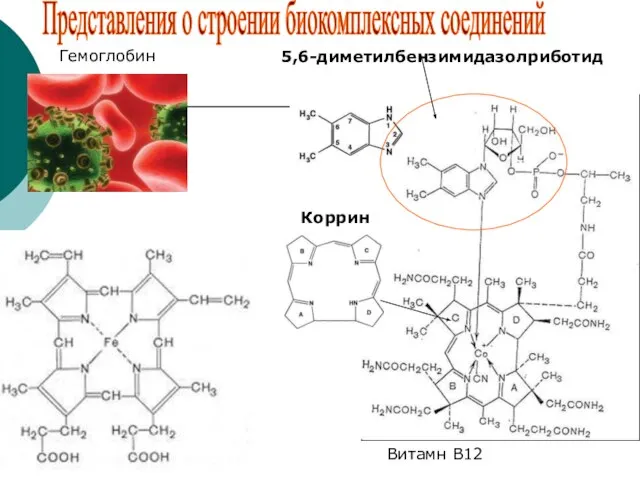
- 39. 5,6-диметилбензимидазолриботид Коррин Витамн В12 Гемоглобин Представления о строении биокомплексных соединений
- 40. Все цитохромы представляют собой гемопротеины.
- 41. Координационная теория Вернера. Строение комплексных соединений: центральный атом, лиганды, координационное число Впервые свойства и строение комплексных
- 42. Комплексными соединениями называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является
- 43. Координационную теорию Вернера рассмотрим на примере: K3 [Fe(CN)6] внешняя и внутренняя сфера Согласно данной теории, центральный
- 44. Число лигандов, окружающих центральный ион, называется координационным числом (КЧ). Центральный атом вместе с координированными лигандами образуют
- 45. Координационное число может иметь значения 2; 3; 4; 5; 6 и т. д. вплоть до 12
- 46. Во внутренней сфере связь комплексообразователя с лигандами имеет донорно – акцепторное происхождение и является ковалентной. Роль
- 47. Определение заряда (z) основных частиц комплексного соединения на примере: K[AI(OH)4]. Заряд внутренней сферы комплексного соединения равен
- 48. В качестве лигандов выступают молекулы или ионы, содержащие донорные атомы (наиболее распространенные N, Р, О, галогены),
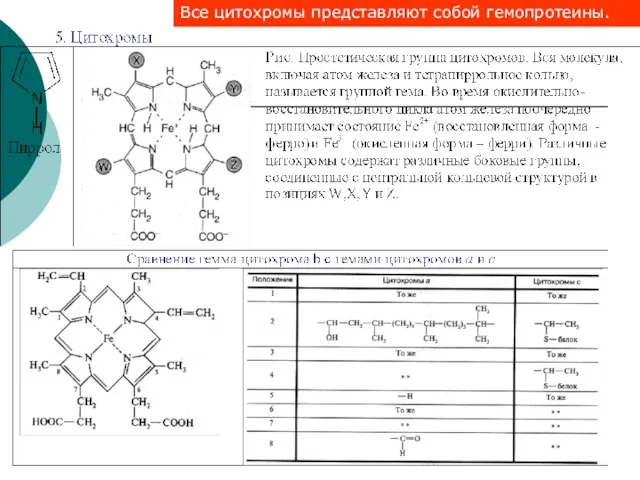
- 49. 1) К монодентатным относятся анионы F-, СI-, Вг-, I-, H-, CN-, NO-, SCN- и т.д., нейтральные
- 51. Номенклатура комплексных соединений сначала называют анион, а затем – катион в родительном падеже. Названия комплексных соединений
- 52. Число лигандов каждого рода указывают греческими числительными: ди-, три-, тетра- и т.д. Если комплексная частица является
- 54. Комплексное соединение [Pt(NH3)2CI2] внешней сферы не имеет и заряд комплекса равен 0.
- 59. Устойчивость комплексных соединений в растворах Внутренняя и внешняя сферы комплексного соединения сильно различаются по устойчивости; частицы,
- 65. Если ионизация комплексных ионов происходит по ступеням, то константы равновесия этих промежуточных реакций называются промежуточными или
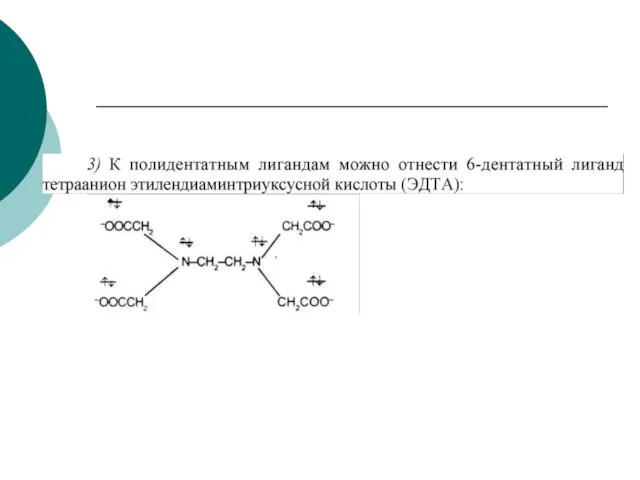
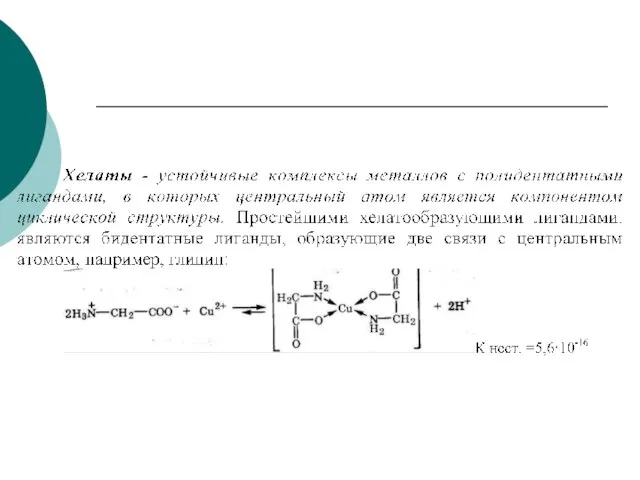
- 67. Особенно эффективное связывание ионов комплексообразователя происходит при реакции с полидентатными ( многозубыми) лигандами. Эти лиганды благодаря
- 69. Конкуренция за лиганд или за ион-комплексообразователь Процессы образования комплексного соединения иона металла с каждым из лигандов
- 72. Скачать презентацию




























![Координационную теорию Вернера рассмотрим на примере: K3 [Fe(CN)6] внешняя и внутренняя сфера](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/384373/slide-42.jpg)



![Определение заряда (z) основных частиц комплексного соединения на примере: K[AI(OH)4]. Заряд внутренней](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/384373/slide-46.jpg)





![Комплексное соединение [Pt(NH3)2CI2] внешней сферы не имеет и заряд комплекса равен 0.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/384373/slide-53.jpg)















 Естественный ядерный реактор Окло
Естественный ядерный реактор Окло Какие типы домов существуют в Великобритании?
Какие типы домов существуют в Великобритании? История возникновения и развитие романса как жанра в музыке
История возникновения и развитие романса как жанра в музыке Доли.Обыкновенные дроби
Доли.Обыкновенные дроби Предложения экспериментов на установке РАДЭКС
Предложения экспериментов на установке РАДЭКС Метод АВС
Метод АВС Творчество Жана Огюста Доминика Энгра
Творчество Жана Огюста Доминика Энгра Положение о портфолио педагогических работниковобразовательных учреждений, учреждений образования Мурманской области, проход
Положение о портфолио педагогических работниковобразовательных учреждений, учреждений образования Мурманской области, проход МКА5 3 курс (1)
МКА5 3 курс (1) С Днём Геолога
С Днём Геолога Всеобуч
Всеобуч A BC Треугольник называется равнобедренным, если две его стороны равны.
A BC Треугольник называется равнобедренным, если две его стороны равны. Этикет
Этикет Эсхил «Прометей прикованный» Урок литературы 9 класс
Эсхил «Прометей прикованный» Урок литературы 9 класс 1С-Рейтинг: ИТС
1С-Рейтинг: ИТС Опыт взаимодействия крахмала с йодом
Опыт взаимодействия крахмала с йодом Отгадайте загадку
Отгадайте загадку  Правила игры в волейбол
Правила игры в волейбол ОФИЦИАЛЬНАЯ СУВЕНИРНАЯ ПРОДУКЦИЯ
ОФИЦИАЛЬНАЯ СУВЕНИРНАЯ ПРОДУКЦИЯ Она была поэтом. Посвящается памяти Анны Ахматовой (1889 – 1966)
Она была поэтом. Посвящается памяти Анны Ахматовой (1889 – 1966) Имидж современного учителя
Имидж современного учителя  История и современность ВФСК ГТО
История и современность ВФСК ГТО Д.И. Менделеев
Д.И. Менделеев Расчетные и лицевые счета в банках. Выдача справок по вкладам. Розыск вклада. Наложение и снятие ареста на вклад
Расчетные и лицевые счета в банках. Выдача справок по вкладам. Розыск вклада. Наложение и снятие ареста на вклад Факторинг от ВТБ – новые возможности для развития бизнеса
Факторинг от ВТБ – новые возможности для развития бизнеса Анализ эпизода литературного произведения
Анализ эпизода литературного произведения Туризм из дома. На карантине
Туризм из дома. На карантине Бизнес Менеджер Пример работы с формами
Бизнес Менеджер Пример работы с формами