Содержание
- 2. Цель урока: Сформировать представление учащихся о составе, строении, номенклатуре, видах и классификации комплексных соединений. Научить давать
- 3. Содержание урока 1. Понятие : Комплексные соединения 2. Строение комплексных соединений 3. Номенклатура комплексных соединений 4.
- 4. Комплексные называют соединения, содержащие сложные ионы и молекулы, способные к существованию как а кристаллическом виде, так
- 5. Швейцарский химик Альфред Вернер, лауреат Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал
- 6. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ N H H H Cl + - [ [ * * * *
- 7. [N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-
- 8. Лигандами могут быть: а) полярные молекулы NH3 H2O CO NO б) простые ионы CI- Br- I-
- 9. (OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2 ·4 = 0 x
- 10. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Ответ: Na+[Al+3(OH)-4] Ответ: K+[Mg+2Cl-3] Ответ:Na+4[Fe+2(CN)-6]
- 11. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2- 4- 3- 5- 6- ди- три- тетра- пента- гекса- ЧИСЛИТЕЛЬНЫЕ: НАЗВАНИЯ ЛИГАНДОВ:
- 12. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ НАЗВАНИЯ АНИОНОВ: Fe - феррат Cu - купрат Ag - аргентат Au -
- 13. тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия [Cr+3 (H2O)0 6] Cl-3 хлорид
- 14. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия
- 15. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3
- 16. Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Гексагидроксохромат (III) натрия СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Ответ: Na3[Cr(OH)6]
- 17. ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация комплексных соединений [Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- комплексный ион ион внешн. среды
- 18. Практическое применение комплексных соединений 1) в аналитической химии для определения многих ионов 2) для разделения некоторых
- 19. Закрепление Задание 2 Заполните пропуски в листе рассказа «Комплексные соединения». Строение комплексных соединений объясняется с позиций
- 20. Домашнее задание Напишите формулы следующих соединений: 1) сульфат гексаамминхрома (II); 2) нитрат гидроксодиамминакваплатины (II); 3) гексацианоферрат
- 22. Скачать презентацию





![[N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372918/slide-6.jpg)

![(OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372918/slide-8.jpg)
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Ответ: Na+[Al+3(OH)-4] Ответ: K+[Mg+2Cl-3] Ответ:Na+4[Fe+2(CN)-6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372918/slide-9.jpg)


![тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия [Cr+3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372918/slide-12.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372918/slide-13.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372918/slide-14.jpg)
![Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Гексагидроксохромат (III) натрия СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Ответ: Na3[Cr(OH)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372918/slide-15.jpg)
![ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация комплексных соединений [Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- комплексный ион ион внешн. среды](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372918/slide-16.jpg)



 «Обзор законодательства Республики Казахстан в сфере социальной поддержки и обеспечения социальными услугами»
«Обзор законодательства Республики Казахстан в сфере социальной поддержки и обеспечения социальными услугами» Роспись петуха по мотивам Филимоновской росписи
Роспись петуха по мотивам Филимоновской росписи Гражданское право. Понятие и виды сроков в гражданском праве
Гражданское право. Понятие и виды сроков в гражданском праве Модернизм
Модернизм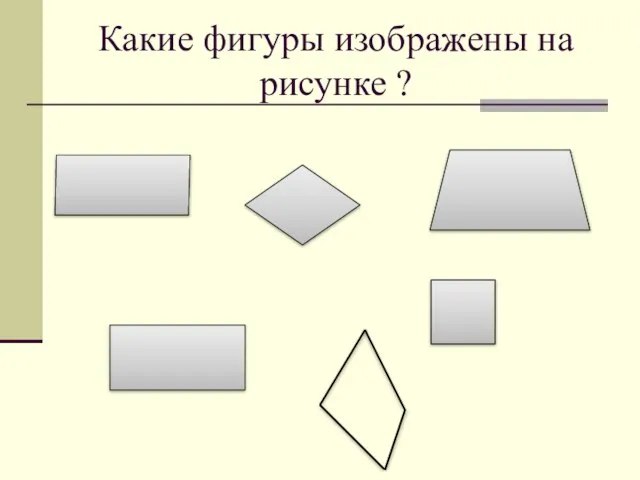 Какие фигуры изображены на рисунке ?
Какие фигуры изображены на рисунке ? Перенос слова переносятся по слогам
Перенос слова переносятся по слогам Принтеры
Принтеры Методическая разработка «Создание презентаций» Элективный курс для 10 класса.
Методическая разработка «Создание презентаций» Элективный курс для 10 класса. Вейк-лебедка - летний бизнес. Вейкпарк в пляжной зоне
Вейк-лебедка - летний бизнес. Вейкпарк в пляжной зоне Федеральное Собрание РФ
Федеральное Собрание РФ Инжиниринг нефтехимии и нефтегазопереработки
Инжиниринг нефтехимии и нефтегазопереработки Китайский клуб МИИТа
Китайский клуб МИИТа Мой город, с тебя начинается Родина (город Сатка)
Мой город, с тебя начинается Родина (город Сатка) Спартакиада пенсионеров муниципального образования Город Гатчина
Спартакиада пенсионеров муниципального образования Город Гатчина Эры. Основные события органического мира
Эры. Основные события органического мира Презентация на тему Операционные системы на мобильных устройствах
Презентация на тему Операционные системы на мобильных устройствах  Живопись
Живопись Михайленко Юлия Борисовна учитель начальных классов ГБОУ гимназии № 1518 г. Москвы
Михайленко Юлия Борисовна учитель начальных классов ГБОУ гимназии № 1518 г. Москвы Муниципальное общеобразовательное учреждение лингвистическая гимназия № 70
Муниципальное общеобразовательное учреждение лингвистическая гимназия № 70 МОСКВА- ГОРОД ГЕРОЙ . Битва за Москву(30 сентября 1941- 20 апреля 1942)
МОСКВА- ГОРОД ГЕРОЙ . Битва за Москву(30 сентября 1941- 20 апреля 1942) Векторы в пространстве и не только
Векторы в пространстве и не только Презентация на тему История развития отечественной вычислительной техники
Презентация на тему История развития отечественной вычислительной техники Трансформация изображения через трансформацию формы - серия открыток
Трансформация изображения через трансформацию формы - серия открыток ОРНАМЕНТЫ в национальном костюме
ОРНАМЕНТЫ в национальном костюме Цветник для солнечного места “Степной бриз ”
Цветник для солнечного места “Степной бриз ” Презентация на тему Тургенев. Стихи в прозе
Презентация на тему Тургенев. Стихи в прозе 287 Воскресшему служу я
287 Воскресшему служу я Берлину заменить Северный поток-2 другим проектом
Берлину заменить Северный поток-2 другим проектом