Содержание
- 2. Кислотно-основное титрование (добавление порциями) Индикаторы В аналитической химии - кислотно-основные индикаторы - специальные вещества, добавляемые в
- 3. В системе форм индикатора B + HB (которых мало) скачок рН может приводить к почти количественному
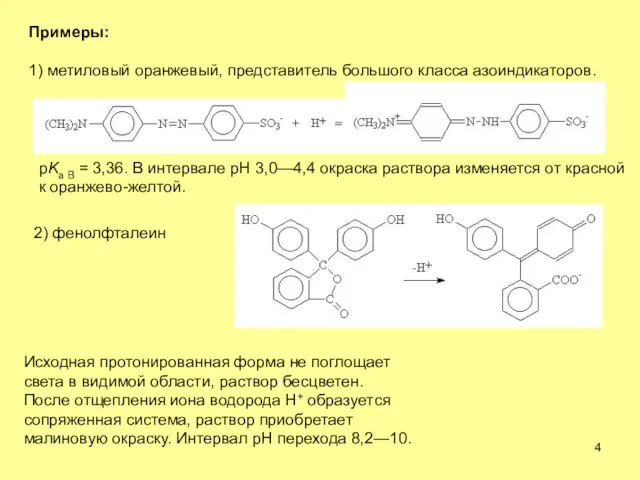
- 4. Примеры: 1) метиловый оранжевый, представитель большого класса азоиндикаторов. pKa B = 3,36. В интервале рН 3,0—4,4
- 5. Отчетливое изменение окраски индикатора происходит в довольно широком интервале рН. Ориентировочно принимают, что он равен lg
- 6. Замечание: строго говоря, требование CA >> CB не является обязательным. Главное, что влияние индикатора на основной
- 7. Независимо от типа реакции титрования она должна удовлетворять следующим требованиям: -Реакция должна быть стехиометрической, -протекать количественно
- 8. Понятие эквивалента является одним из основных понятий в химии вообще и в аналитической химии в частности.
- 9. Количества эквивалентов веществ, вступающих в реакцию или образующихся в реакции, одинаковы. Иными словами, один эквивалент вещества
- 10. Кривая титрования — график зависимости концентрации (или логарифма концентрации) формы определяемого компонента от доли титрования, объема
- 11. Использование доли титрования нецелесообразно, когда исходный раствор содержит несколько компонентов. Например, в некоторых случаях возможно раздельное
- 12. Обычно конечная точка титрования не совпадает с точкой эквивалентности (ТЭ). Тогда говорят об индикаторной погрешность титрования:
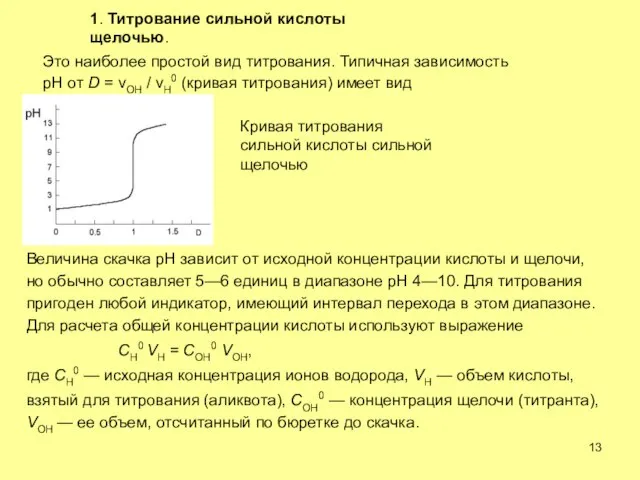
- 13. 1. Титрование сильной кислоты щелочью. Это наиболее простой вид титрования. Типичная зависимость рН от D =
- 14. Это выражение означает равенство в точке эквивалентности количеств молей ионов водорода и гидроксила (СH0 VH =
- 15. Случайная погрешность определения CH0 по данным единичного титрования может быть оценена, если известны погрешности остальных величин:
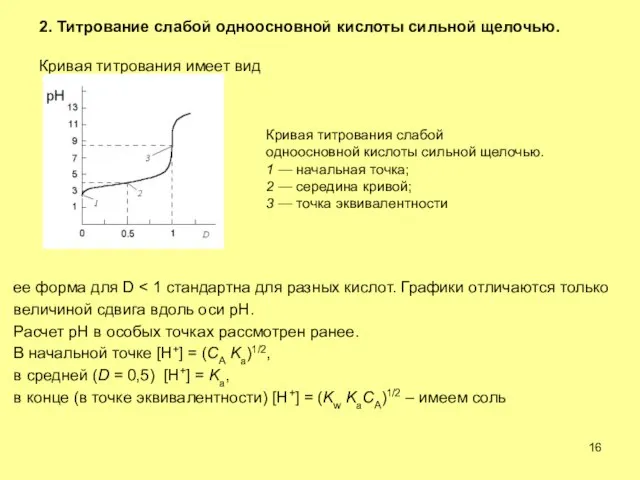
- 16. 2. Титрование слабой одноосновной кислоты сильной щелочью. Кривая титрования имеет вид Кривая титрования слабой одноосновной кислоты
- 17. Выбор индикатора B зависит от pKa. Переход его окраски должен начинаться при D не менее 0.99.
- 18. 3. Титрование слабых многоосновных кислот. Титрование слабой двухосновной кислоты с неразделенными ступенями проводится аналогично описанному выше
- 19. Пример. Титрование H3PO4 щелочью с метиловым оранжевым и фенолфталеином. Титрование слабого двухкислотного основания A сильной кислотой
- 20. Титрование с индикатором до скачка окраски очень широко распространено из-за простоты исполнения и вместе с тем
- 21. Определение спиртов. Реакция спирта с уксусным ангидридом (определенное количество) в пиридине или др. органическом растворителе (CH3CO)2O
- 22. Определение аминов. NH4+ pKa слишком мала, и прямо титровать щелочью нельзя. Добавляют избыток титрованной щелочи, нагревают
- 23. Задача. 50,0 мл раствора, содержащего Н2SО4 и Н3РО4 , титруют 0,1000 М раствором NаОН. До первого
- 24. Равновесия комплексообразования в растворе Константы устойчивости M + i X = MXi, i = [MXi] /
- 25. Закономерности комплексообразования M + i X = MXi, i замещение молекул воды, т.е. M(H2O)n + i
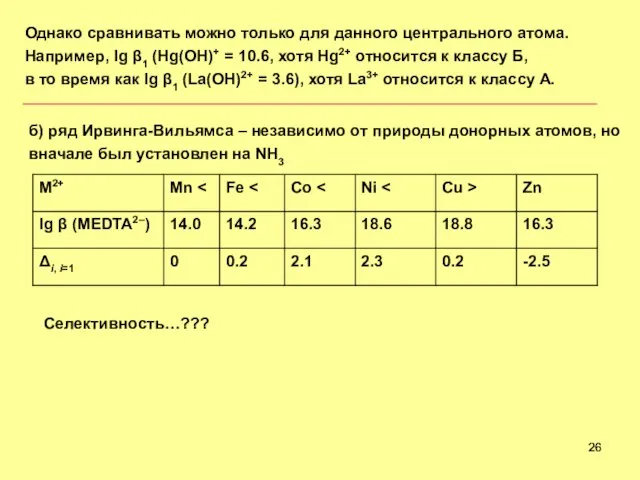
- 26. Однако сравнивать можно только для данного центрального атома. Например, lg 1 (Hg(OH)+ = 10.6, хотя Hg2+
- 27. в) ступенчатые эффекты T, S, L Ti = lg (Ki / Ki+1) - полный Si =
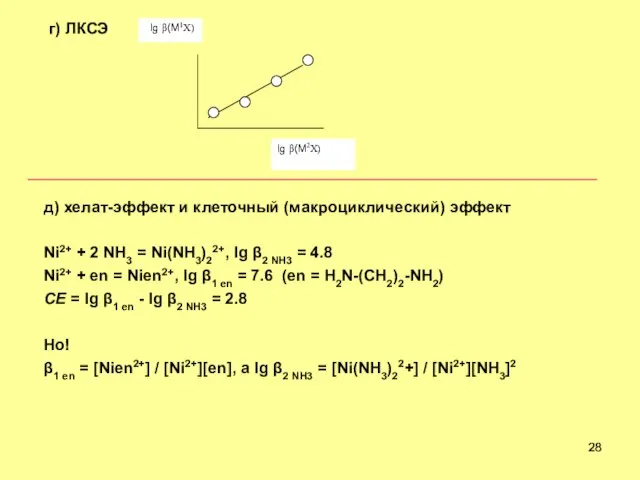
- 28. г) ЛКСЭ lg (M1X) д) хелат-эффект и клеточный (макроциклический) эффект Ni2+ + 2 NH3 = Ni(NH3)22+,
- 29. Равновесия: AuCl4- + 2 NH3 = AuCl3NH3 + Cl- + NH3 = AuCl2(NH3)2+ + 2 Cl-,
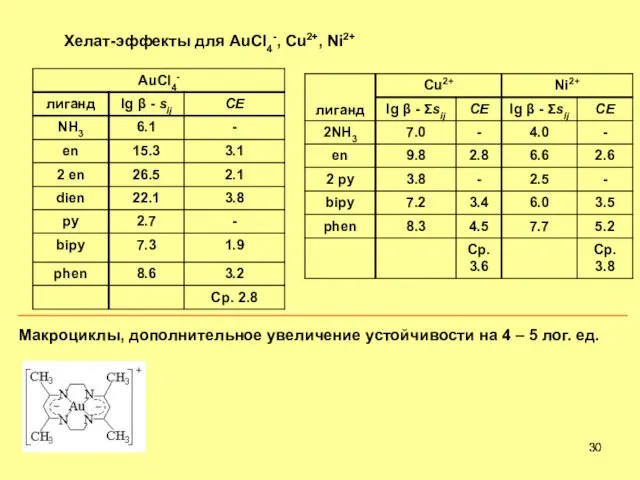
- 30. Хелат-эффекты для AuCl4-, Cu2+, Ni2+ Макроциклы, дополнительное увеличение устойчивости на 4 – 5 лог. ед.
- 31. Маскирование A + X = AX, AX — основная аналитическая реакция B + X = BX,
- 32. Примеры основных лигандов Характеристики лигандов: функционально-аналитические группы (ФАГ, специфические) – группы атомов, ответственные за аналитическую реакцию.
- 33. Пример. Методика: определение Zn в алюминиевом сплаве. Al3+ маскируют фторидом, Zn2+ титруют ЭДТА в присутствии ксиленолового
- 34. 3) S2O32– при окислении 2 S2O32– - 2 e = S4O62– 4) S2–: HS– Например, в
- 35. 7) CN– (через N или C) устойчивые комплексы почти со всеми Ме, кроме щелочных и щелочноземельных.
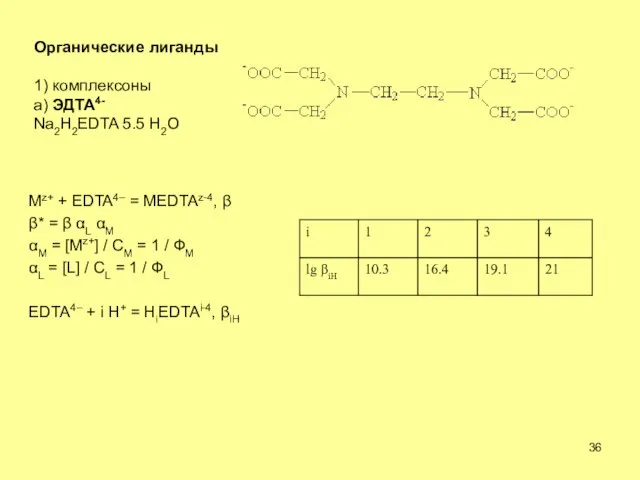
- 36. Органические лиганды 1) комплексоны а) ЭДТА4- Na2H2EDTA 5.5 H2O Mz+ + EDTA4– = MEDTAz-4, *
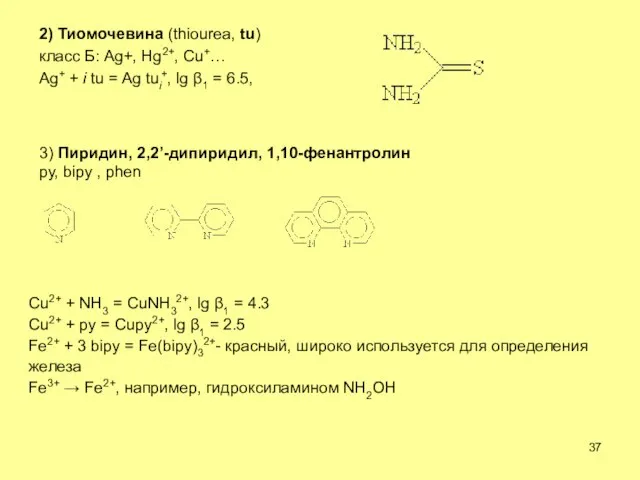
- 37. 2) Тиомочевина (thiourea, tu) класс Б: Ag+, Hg2+, Cu+… Ag+ + i tu = Ag tui+,
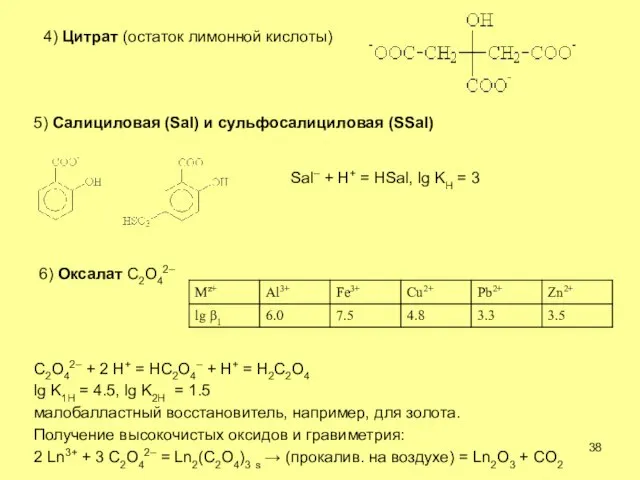
- 38. 4) Цитрат (остаток лимонной кислоты) 5) Салициловая (Sal) и сульфосалициловая (SSal) Sal– + H+ = HSal,
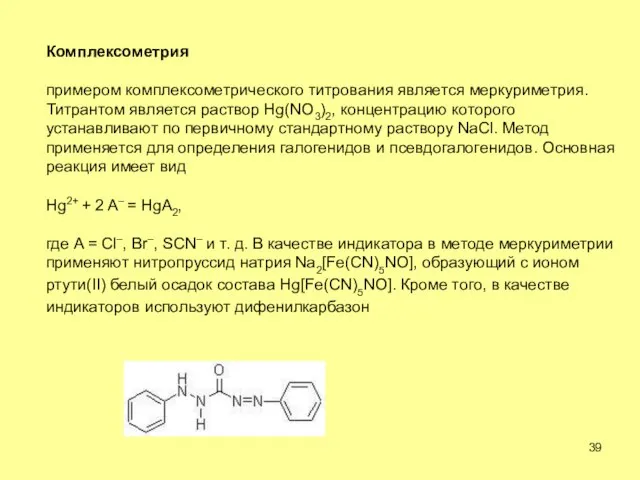
- 39. Комплексометрия примером комплексометрического титрования является меркуриметрия. Титрантом является раствор Hg(NO3)2, концентрацию которого устанавливают по первичному стандартному
- 40. Комплексонометрия Объединяет методы титрования, основанные на реакциях комплексообразования ионов металлов с комплексонами. Комплексоны — органические соединения,
- 41. Na2H2Y является вторичным стандартом, концентрацию которого определяют с помощью растворов солей металлов с точно установленной концентрацией.
- 42. Замечание. Тем не менее, для препарата (фиксанала) Na2H2ЭДТА 2 H2O указывается fэкв = 1/2, и
- 43. В большинстве случаев комплексонометрическое титрование ионов M2+ проводят в щелочной среде в присутствии аммиачного буфера. В
- 44. Равновесные концентрации [M] = M[M], [Y] = Y[Y], где M = 1/M; Величины долей формы Y4–
- 45. Кривые комплексонометрического титрования строят в координатах pM—D. Как обычно, кривая титрования состоит из трех частей: -до
- 46. 2) Рассмотрим возможность определения содержания 2 ионов металлов при совместном присутствии. Пусть их концентрации одинаковы. Найдем
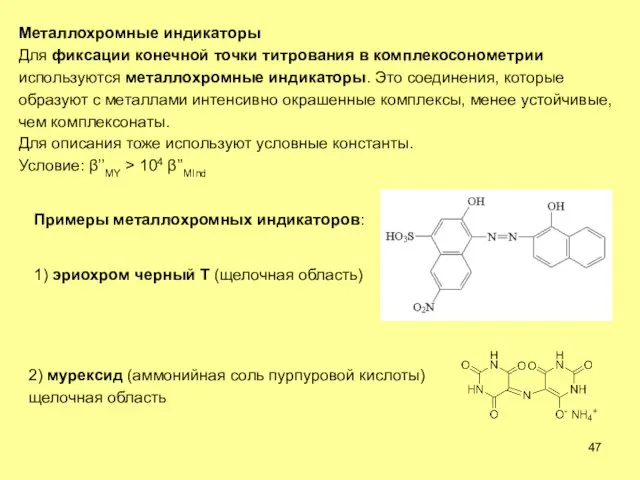
- 47. Металлохромные индикаторы Для фиксации конечной точки титрования в комплекосонометрии используются металлохромные индикаторы. Это соединения, которые образуют
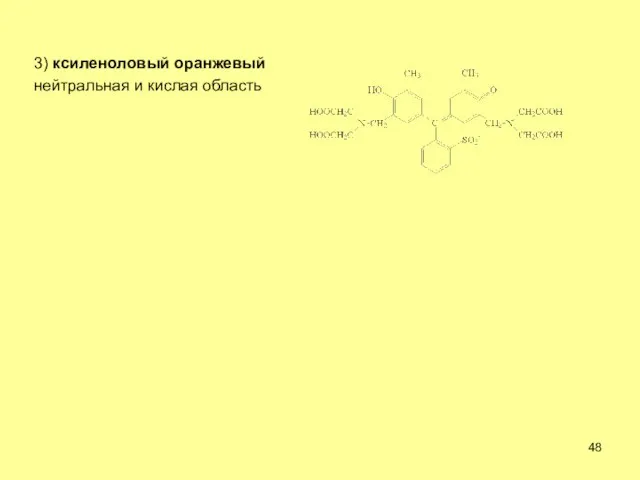
- 48. 3) ксиленоловый оранжевый нейтральная и кислая область
- 49. Определение жесткости воды Жесткость воды обусловлена наличием растворенных солей, в основном, кальция и магния. Играет большую,
- 51. Скачать презентацию
































![Равновесные концентрации [M] = M[M], [Y] = Y[Y], где M = 1/M;](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372919/slide-43.jpg)



 КОМПАНИЯ EURORESEARCH AND CONSULTING ЕВРОРЕСЕЧ И КОНСАЛТИНГ
КОМПАНИЯ EURORESEARCH AND CONSULTING ЕВРОРЕСЕЧ И КОНСАЛТИНГ Государственный бюджет (3 класс)
Государственный бюджет (3 класс) Значение международного языка в нашей жизни
Значение международного языка в нашей жизни НОВИНКА!Стеновые панелиПазлБорд
НОВИНКА!Стеновые панелиПазлБорд Arkadaşlarima
Arkadaşlarima Муссовые торты, пирожные и капкейки
Муссовые торты, пирожные и капкейки Страны_Западной_и_Центральной_Европы (2)
Страны_Западной_и_Центральной_Европы (2) Презентация на тему Современное искусство
Презентация на тему Современное искусство  Мы зарабатываем, Только если зарабатываете вы
Мы зарабатываем, Только если зарабатываете вы Методология системного подхода
Методология системного подхода Разработка генплана проектируемого объекта с организацией рельефа
Разработка генплана проектируемого объекта с организацией рельефа Построение новых и аудит существующих дилерских сетей
Построение новых и аудит существующих дилерских сетей Презентация на тему ГЕНОМНЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ ГЕНЕТИЧЕСКОГО АППАРАТА СВЕДЕНИЯ о ГЕНОМЕ ЧЕЛОВЕКА ГЕНОМНЫЕ МУТАЦИИ
Презентация на тему ГЕНОМНЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ ГЕНЕТИЧЕСКОГО АППАРАТА СВЕДЕНИЯ о ГЕНОМЕ ЧЕЛОВЕКА ГЕНОМНЫЕ МУТАЦИИ Самое главное на земле - это жизнь
Самое главное на земле - это жизнь «О повышении заработной платы учителям общеобразовательных учреждений»
«О повышении заработной платы учителям общеобразовательных учреждений» Анализ финансового состояния предприятия и пути его улучшения (на материалах ФКП Алексинский химический комбинат)
Анализ финансового состояния предприятия и пути его улучшения (на материалах ФКП Алексинский химический комбинат) Что вы получаете сотрудничая с нами. Оператор недвижимости Перспектива 24
Что вы получаете сотрудничая с нами. Оператор недвижимости Перспектива 24 7кл технические открытия
7кл технические открытия Компетентностный подход в обучении
Компетентностный подход в обучении Иски в Римском праве
Иски в Римском праве  Использование биомассы для получения энергии
Использование биомассы для получения энергии Stories containing idiomatic expressions
Stories containing idiomatic expressions Презентация на тему Этика
Презентация на тему Этика Правление Александра I (Благословенный)
Правление Александра I (Благословенный) Результаты содержательного мониторинга деятельности стажировочных площадок
Результаты содержательного мониторинга деятельности стажировочных площадок Музыкальная живопись и живописная музыка
Музыкальная живопись и живописная музыка Результаты конкурса 2012 года Анализ итогов 2011 года
Результаты конкурса 2012 года Анализ итогов 2011 года Инженерная графика. Введение
Инженерная графика. Введение