Содержание
- 2. Кремний в виде кристаллов входит в состав горных пород образует бесцветные кристалла кварца и горного хрусталя
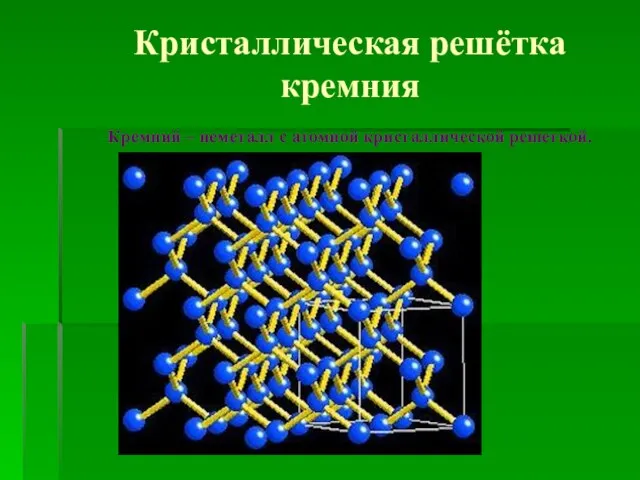
- 3. Кремний – кристаллическое вещество темно-серого цвета с металлическим блеском. Кристаллическая решетка кремния напоминает структуру алмаза.
- 4. Кристаллическая решётка кремния Кремний – неметалл с атомной кристаллической решеткой.
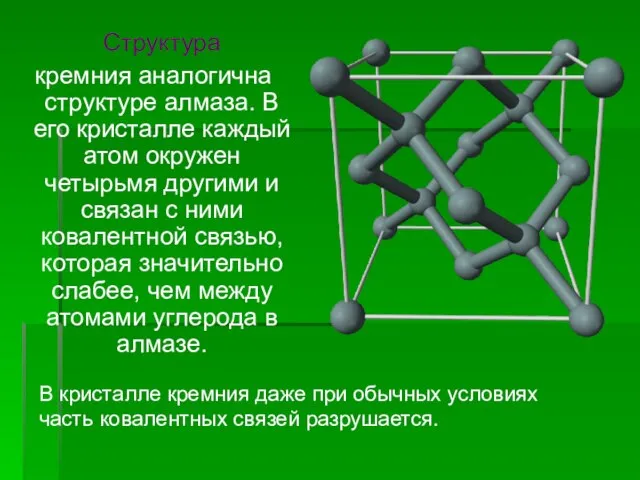
- 5. Структура кремния аналогична структуре алмаза. В его кристалле каждый атом окружен четырьмя другими и связан с
- 6. Структура связей атома кремния в кристаллической решетке
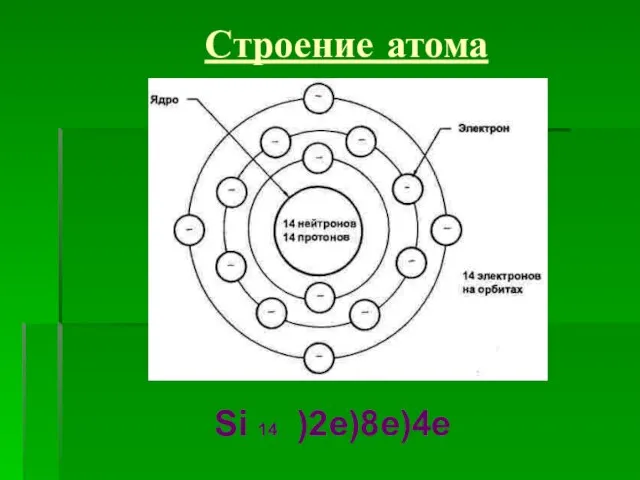
- 7. Строение атома Si 14 )2e)8e)4e
- 8. Соединения кремния 0 +4 +2 Примеры: Si, SiO2, SiO.
- 9. Физические свойства кремния Темно-серые, блестящие, непрозрачные кристаллы Хрупкий Твердый Тугоплавкий, Плохой проводник тока
- 10. Химические свойства кремния а) восстановительные 1) Si + O2 =SiO2 2) Si + 2CL2 = SiCL4
- 11. Методы получения кремния В промышленности кремний получают восстановлением кремнезема SiO2 коксом в электрических печах при 1500-17000С:
- 12. Применение кремния материал для электроники материал для сосудов; компонент сплавов с железом; - сверхчистый кремний –
- 13. Соединения кремния 1. Оксид кремния (IV) Оксид кремния SiO2 (IV) называют также кремнеземом. Физические свойства: бесцветное,
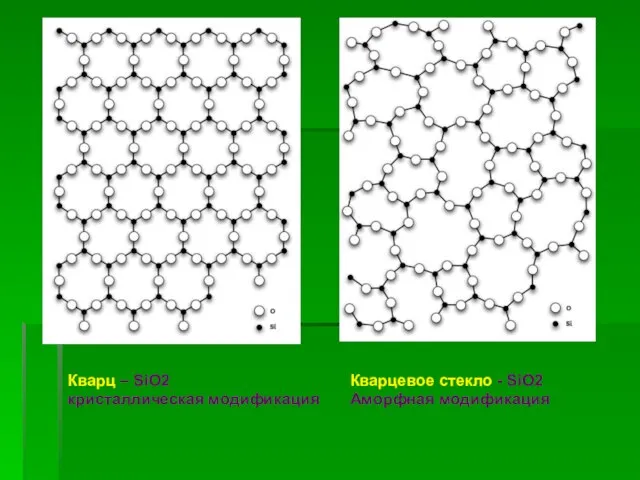
- 14. Модификации кремнезёма (кварца) кристаллический кремнезем — в виде минерала кварца и его разновидностей (горный хрусталь, халцедон,
- 15. Кварц – SiO2 кристаллическая модификация Кварцевое стекло - SiO2 Аморфная модификация
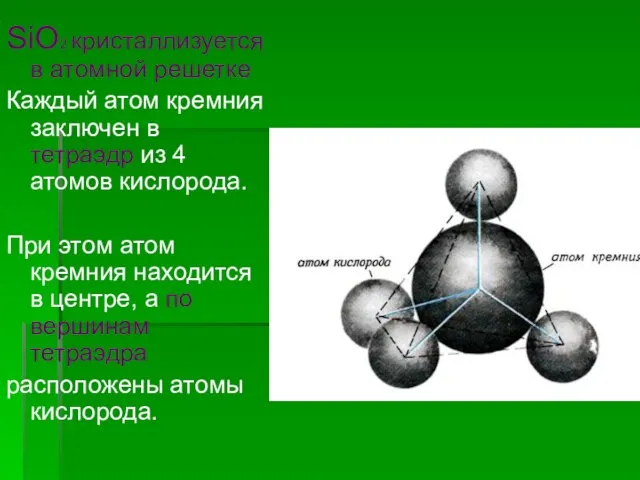
- 16. SiO2 кристаллизуется в атомной решетке Каждый атом кремния заключен в тетраэдр из 4 атомов кислорода. При
- 17. Весь кусок кремнезема SiO2 можно рассматривать как кристалл, формула которого (SiO2)n. Такое строение оксида кремния (IV)
- 18. Химические свойства оксида кремния (IV) Относится к кислотным оксидам: 1. При сплавлении его с твердыми щелочами,
- 19. 2. Реагирует со щелочами в растворе (образует ортосиликаты). Кип. SiO2 (ам.)+ 4NaOH?Na4SiO4+ 2H2O 3. Взаимодействует только
- 20. 4. Восстанавливается углеродом, магнием, железом (в доменном процессе). Кип а) SiO2 + 3C(кокс)?SiC+CO б)SiO2 + 2Mg?Si+
- 21. Кремневые кислоты H2SiO3 — кислота очень слабая, в воде мало растворима. Состав кремниевых кислот представляют в
- 22. Силикаты Силикаты – химические соединения, содержащие кремнекислотные остатки различного состава [SinOm]. Основа всех силикатов - кремнекислородный
- 23. Применение силикатов в качестве жидкого стекла - концентрированных растворов силикатов калия и натрия; его используют: а)
- 25. Скачать презентацию















![Силикаты Силикаты – химические соединения, содержащие кремнекислотные остатки различного состава [SinOm]. Основа](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361920/slide-21.jpg)

 УАТТ ДЖЕЙМС (1736–1819)
УАТТ ДЖЕЙМС (1736–1819) Физика 7
Физика 7 Разработка проектной идеи образовательного ресурса. №3
Разработка проектной идеи образовательного ресурса. №3 Хумус Бар
Хумус Бар Лекция 7
Лекция 7 Презентация на тему Гаршин сказка о жабе и розе
Презентация на тему Гаршин сказка о жабе и розе  Презентация на тему Белки
Презентация на тему Белки Презентация на тему Применение жиров
Презентация на тему Применение жиров  Первомайская центральная районная детская библиотека
Первомайская центральная районная детская библиотека Чудо Земли - хлеб
Чудо Земли - хлеб Бытовой жанр в русской живописи конца ХVIII в. - первой половины ХIХ в
Бытовой жанр в русской живописи конца ХVIII в. - первой половины ХIХ в Выставка работ
Выставка работ Отчет о проделанной работе с резидентами по дисциплине Клиническая фармакология, 2019-2021 годы обучения
Отчет о проделанной работе с резидентами по дисциплине Клиническая фармакология, 2019-2021 годы обучения 孔子学院在乌克兰和俄罗斯
孔子学院在乌克兰和俄罗斯 Презентация на тему Саудовская Аравия
Презентация на тему Саудовская Аравия  Методические рекомендации к заполнению классного журнала в государственном образовательном учреждении общего образования
Методические рекомендации к заполнению классного журнала в государственном образовательном учреждении общего образования Представление нечисловой информации
Представление нечисловой информации Дед Мороз на новогодних открытках
Дед Мороз на новогодних открытках Разветвляющийся алгоритм
Разветвляющийся алгоритм Пролог к изучению поэмы Н.В. Гоголя «Мертвые души»
Пролог к изучению поэмы Н.В. Гоголя «Мертвые души» Познавательные процессы (память)
Познавательные процессы (память) Диспансеризация сельскохозяйственных животных при внутренних болезнях
Диспансеризация сельскохозяйственных животных при внутренних болезнях Инвестиционная деятельность предприятия
Инвестиционная деятельность предприятия «МОЯ СТРАНА – МОЯ РОССИЯ»
«МОЯ СТРАНА – МОЯ РОССИЯ» Любовная лирика Ф.И.Тютчева
Любовная лирика Ф.И.Тютчева Нестероидные противовоспалительные средства
Нестероидные противовоспалительные средства Почему болеют мои одноклассники
Почему болеют мои одноклассники Штат Колорадо
Штат Колорадо