Слайд 2Технология глюкозы, получаемой ферментативным способом
При кислотном гидролизе крахмала практически нет возможности

регулировать углеводный состав гидролизатов, так как кислота не проявляет специфичности к гликозидным связям в крахмале и поэтому происходит беспорядочное расщепление молекул крахмала, а продуктами гидролиза служат глюкоза и ее полимеры различной степени полимеризации. При этом для любой данной степени гидролиза состав углеводов аналогичен. Кислота катализирует также расщепление примесей крахмала, что ухудшает качество гидролизатов. Возможность варьирование углеводного состава и других физико-химических свойств продуктов гидролиза крахмала обеспечивается на основе ферментативного гидролиза путем подбора и селекции соответствующих продуцентов ферментов, а также разработки определённого технологического режима процесса.
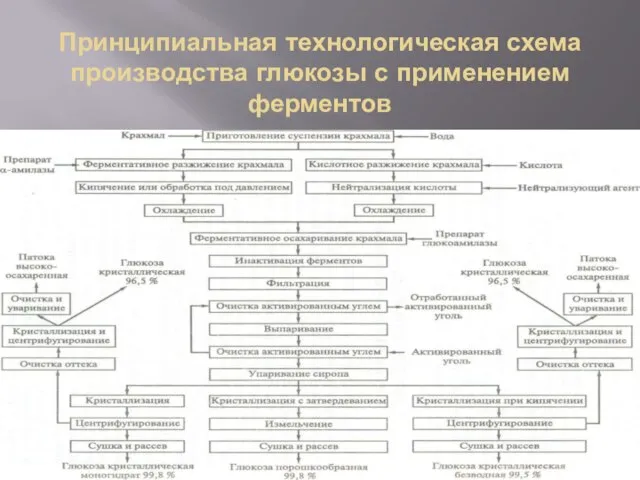
Слайд 3Принципиальная технологическая схема производства глюкозы с применением ферментов
Слайд 4Применение ферментных препаратов для получения различных видов сахаристых продуктов из крахмала
В

основе технологии всех видов сахаристых продуктов из крахмала лежит регулируемая декстринизация (разжижение) клейстеризованного крахмала. В качестве сырья обычно используют кукурузный или картофельный крахмал в виде водных суспензий концентрацией 35 —38 %. Для разжижения крахмала применяют препараты α-амилаза. Их вносят в начальной стадии процесса поскольку клейстеризация концентрированной крахмальной суспензии возможна только при условии ее одновременного разжижения. Полная желатинизация крахмальных гранул происходит при температуре выше 120 ° С. Поэтому при использовании препаратов α-амилаза низкой термостабильности, таких, как Амилосубтилин или БАН (его аналог), процесс разжижения проводят в две стадии, с промежуточной термообработкой. Амилосубтилин проявляет максимальную разжижающую способность при рН 6 — 6,2 в течение 40 мин при тёмпературе 84...86°С.
Слайд 5Схема разжижения крахмала Амилосубтилином включает:
разжижение 35%-й крахмальной суспензии с рН 6

—6,2 в течение 40 мин при температуре 85...88 °С и дозировке а-амилазы 0,5 ед/г крахмала;
термообработку в течение 1 — 3 мин при 120...130 °С с последующим охлаждением до 85 ° С;
разжижение в течение 90 мин при температуре 85 °С и дозировке фермента 0,2 ед/г крахмала.
Слайд 6Данные изменения содержания редуцирующих веществ в процессе гидролиза 30%-й суспензии картофельного крахмала

Амилолихетермом (0,45ед. амилазы/г, t = 55...105°С, х = 1,5 ч) показывают, что, изменяя продолжительность процесса, можно регулировать степень расщепления крахмала.
Продолжительность гидролиза 5 7 10 15 20 30 60 90
Содержание РВ, % СВ 5,8 6,7 10 12,7 14,7 25,2 28,9 30,2
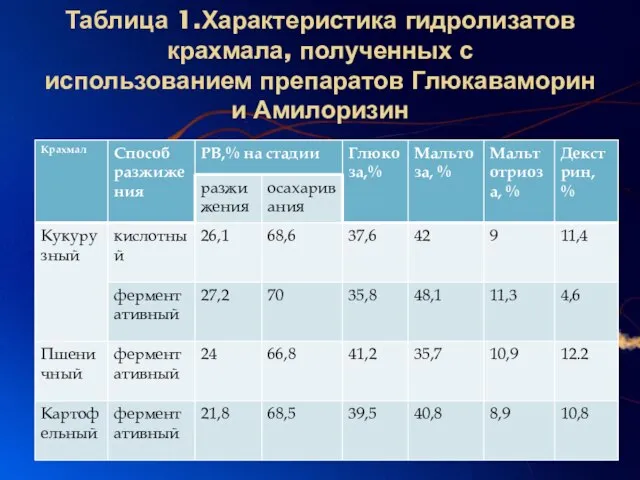
Слайд 7Таблица 1.Характеристика гидролизатов крахмала, полученных с использованием препаратов Глюкаваморин и Амилоризин
Слайд 8Таблица 2. Условия проведения гидролиза крахмала зернового сорго при получении паточных сиропов
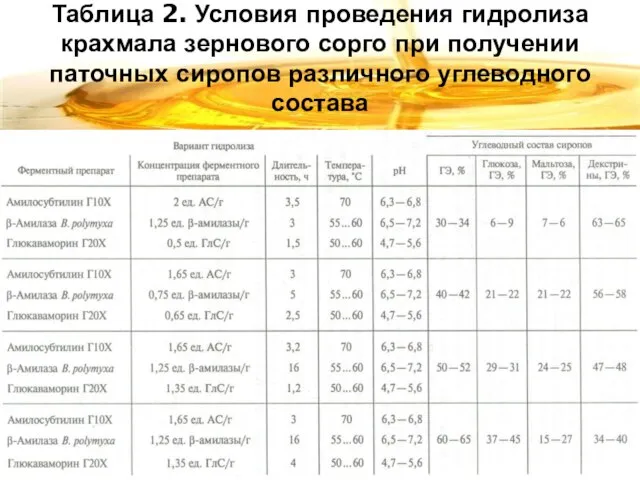
различного углеводного состава
Слайд 9Получение глюкозно-фруктозных и других сиропов, заменителей сахарозы
По данным статистики, потребность в

новых сахаристых продуктах, глюкозно-фруктозных сиропах (ГФС) составляет примерно 850 тыс. т/год. При этом основные потребители глюкозно-фруктозноых сиропов — безалкогольная, хлебопекарная и консервная промышленности.
В основе производства глюкозно-фруктозных сиропов лежит ферментативный гидролиз крахмалосодержащего сырья с последующей изомеризацией глюкозы во фруктозу с помощью иммобилизованной глюкозоизомеразы (ГлИ), основными источниками которой служат микроорганизмы.
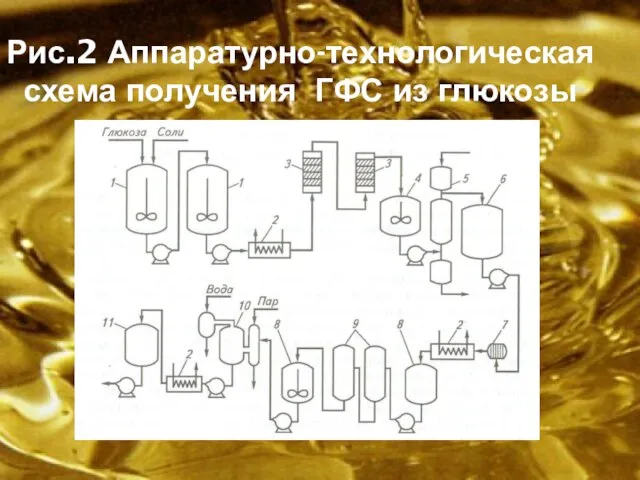
Слайд 10Рис.2 Аппаратурно-технологическая схема получения ГФС из глюкозы
Слайд 11ЭММИССИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
Эмиссионный спектральный анализ основан на получении и изучении

спектров испускания или излучения (так называемых эмиссионных спектров) элементов анализируемого вещества. Он даёт возможность определить элементарный состав вещества. По положению и относительной интенсивности отдельных линий в этих спектрах проводят качественный спектральный анализ. Сравнивая интенсивность специально выбранных спектральных линий в спектре пробы с интенсивностью тех же линий в спектрах эталонов, определяют содержание элемента, выполняя, таким образом, количественный спектральный анализ.
В этом методе сжигают некоторое количество пробы в газовом пламени или электрической дуге. Проба при этом испаряется, молекулярные соединения диссоциируют на атомы и ионы, которые возбуждаются и дают спектры испускания (эмиссионный спектр). По числу и положению линий в этих спектрах определяют, какие элементы входят в состав анализируемого образца, т.е. проводят качественный спектральный анализ.
Слайд 12Пламенная эмиссионная спектроскопия
Появление специализированных пламенных эмиссионных спектрометров привело к обособлению методов

фотометрии пламени и придало ему известную самостоятельность.
Как и любой другой прибор эмиссионной спектроскопии, фотометр для фотометрии пламени имеет источник возбуждения (пламенная горелка), диспергирующий элемент (обычно светофильтр) и приемник света – рецептор (обычно фотоэлемент). В спектрофотометрах для пламени вместо светофильтров применяют призмы и дифракционные решетки. Анализируемый раствор вводится в пламя горелки в виде аэрозоля. При этом растворитель испаряется, а соли металла диссоциируют на атомы, которые при определенной температуре возбуждаются. Возбужденные атомы, переходя в нормальное состояние, излучают свет характерной частоты, который выделяется с помощью светофильтров, а его интенсивность измеряется фотоэлементом.











 Семь чудес Усть - Усы
Семь чудес Усть - Усы Физиология гладких мышц сосудов
Физиология гладких мышц сосудов  Обучающая анимация по физике
Обучающая анимация по физике Это вся моя родня…
Это вся моя родня… Изменения в законодательстве: новые требования по энергосбережению и повышению энергетической эффективности
Изменения в законодательстве: новые требования по энергосбережению и повышению энергетической эффективности Всероссийская олимпиада школьников. Новые нормативные документы
Всероссийская олимпиада школьников. Новые нормативные документы Программа трансформации блока управления персоналом в Госкорпорации «Росатом» и ее организациях
Программа трансформации блока управления персоналом в Госкорпорации «Росатом» и ее организациях Процедура ОРС (открытия расчетного счета)
Процедура ОРС (открытия расчетного счета) Презентация на тему Парад Алфавита
Презентация на тему Парад Алфавита Ассортимент продукции Орехомания
Ассортимент продукции Орехомания Россия из века в век. 1150 лет Российской государственности
Россия из века в век. 1150 лет Российской государственности The best job for me it’s a doctor
The best job for me it’s a doctor Флористический коллаж
Флористический коллаж 20171031_naselenie_yaroslavskoy_oblasti
20171031_naselenie_yaroslavskoy_oblasti Как налоговая по-новому будет проверять компании и искать серые схемы налоговой оптимизации
Как налоговая по-новому будет проверять компании и искать серые схемы налоговой оптимизации Вязание
Вязание ЗВОНКИ.
ЗВОНКИ. Презентация на тему Мягкий знак на конце существительных после шипящих
Презентация на тему Мягкий знак на конце существительных после шипящих Программное обеспечение компьютера
Программное обеспечение компьютера Занимательная физика
Занимательная физика Удивительная Культура Китая
Удивительная Культура Китая Презентация на тему Моё здоровье – вклад в развитие страны
Презентация на тему Моё здоровье – вклад в развитие страны  Индия и Китай в средние века
Индия и Китай в средние века Polskie pieniądze
Polskie pieniądze Деньги на Древней Руси
Деньги на Древней Руси Наука как форма духовной культуры общества
Наука как форма духовной культуры общества НАШ ПАРТНЕР из СИНГАПУРА Ти Йи Джиа Фуд Мануфактуринг Пте Лтд (Tee Yih Jia Food Manufacturing Pte Ltd) является ведущим производителем заморожен
НАШ ПАРТНЕР из СИНГАПУРА Ти Йи Джиа Фуд Мануфактуринг Пте Лтд (Tee Yih Jia Food Manufacturing Pte Ltd) является ведущим производителем заморожен Основные направления организации работы по подготовке и проведению всероссийского конкурса «Российская организация высокой соц
Основные направления организации работы по подготовке и проведению всероссийского конкурса «Российская организация высокой соц