в механическую. Для этого используют рабочее тело – вещество, способное воспринимать тепло и совершать работу. В качестве него может быть использован идеальный газ, водяной пар и т.д. С рабочим теплом в тепловой машине осуществляют круговой процесс или цикл, при котором система после ряда изменений возвращается в исходное состояние (рис.).
Работа цикла: A = Aрасш– Асж = А12– А21. Для этого на участке 1 → 2 рабочее тело нагревается, подводится тепло от нагревателя Q1, а на участке 2 → 1 – охлаждается, отдает холодильнику тепло Q2.
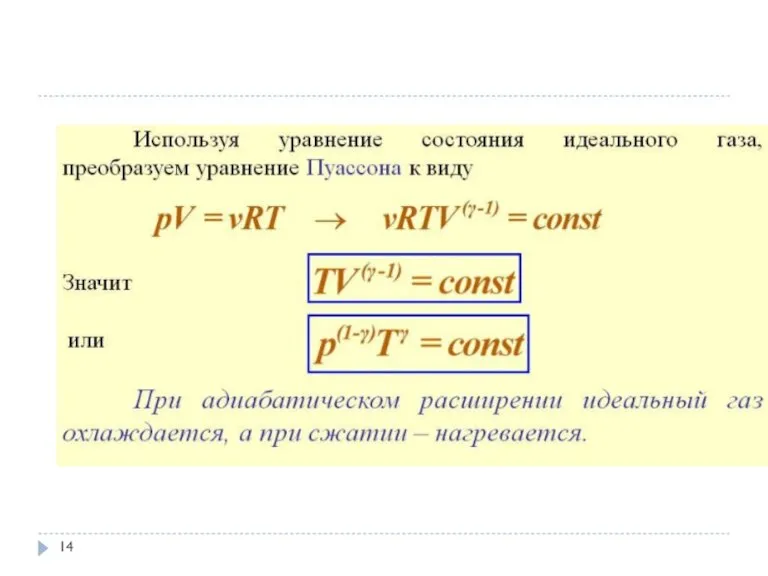
по первому началу термодинамики
откуда
Коэффициент полезного действия (КПД) η равен:
Под КПД понимают отношение работы , совершенный за один цикл, или теплоты,
преобразованной в полезную работу, ко всему подведенному количеству теплоты





















 45%
45% Молодёжные субкультуры
Молодёжные субкультуры Сила упругости. Закон Гука
Сила упругости. Закон Гука 03.2016 Гуляев Р.А. Дубровина Т.Л
03.2016 Гуляев Р.А. Дубровина Т.Л Язык живописи. Перспектива
Язык живописи. Перспектива Презентация на тему Агропромышленный комплекс Легкая и пищевая промышленность
Презентация на тему Агропромышленный комплекс Легкая и пищевая промышленность К 240- летию со дня рождения
К 240- летию со дня рождения Программа автоматизации организации школьного питания «Вижен-Софт:Питание в школе»
Программа автоматизации организации школьного питания «Вижен-Софт:Питание в школе» Презентация на тему If I went to Britain
Презентация на тему If I went to Britain Прокуратура РФ
Прокуратура РФ Научно-исследовательский институт столичного образования в научном комплексе МГПУ
Научно-исследовательский институт столичного образования в научном комплексе МГПУ Удивительный мир веществ
Удивительный мир веществ Опыт и уроки формирования методологии реализации проекта NCSA
Опыт и уроки формирования методологии реализации проекта NCSA растительный мир
растительный мир Огневая подготовка
Огневая подготовка История изменения моды в Англии XX-XXI веков
История изменения моды в Англии XX-XXI веков Салаты
Салаты Зонирование (00000002)
Зонирование (00000002) Системы смягчения рисков в сельской местности
Системы смягчения рисков в сельской местности Костюм Западной Европы XIX века
Костюм Западной Европы XIX века Рекомендательный аннотированный список русской детской и современной детской литературы. Составлен библиотекарем гимнази
Рекомендательный аннотированный список русской детской и современной детской литературы. Составлен библиотекарем гимнази Художественное объединение Голубая роза
Художественное объединение Голубая роза ОСНОВНЫЕ НАПРАВЛЕНИЯ ДЕЯТЕЛЬНОСТИ
ОСНОВНЫЕ НАПРАВЛЕНИЯ ДЕЯТЕЛЬНОСТИ Какой я
Какой я Урок-игра "Обыкновенные дроби"
Урок-игра "Обыкновенные дроби" Правила описания объекта закупки (ПООЗ) 44 -ФЗ
Правила описания объекта закупки (ПООЗ) 44 -ФЗ Рынок инновационной продукции: понятие, субъект, объект, отличительные особенности
Рынок инновационной продукции: понятие, субъект, объект, отличительные особенности Разработка мероприятий по совершенствованию систем контроля качества демонтажных работ
Разработка мероприятий по совершенствованию систем контроля качества демонтажных работ