Содержание
- 2. Положение в ПС Деление всех химических элементов периодической системы Д.И.Менделеева на металлы и неметаллы является условным.
- 3. Изменение свойств элементов-металлов Сравните восстановительную способность металлов, принадлежащих к одному периоду, одной подгруппе Прочность связи валентных
- 4. Изменение свойств атомов металлов побочных подгрупп С увеличением порядкового номера элемента радиус атома изменяется мало Величина
- 5. ОТКРЫТИЕ МЕТАЛЛОВ Было открыто затем и железо и золото с медью, Веское также еще серебро и
- 6. Это внушило ту мысль, что, расплавив, металлы возможно В форму любую отлить и любую придать им
- 7. Ныне в презрении медь, а золото в высшем почете. Так обращенье времен изменяет значенье предметов: Что
- 8. МЕТАЛЛЫ — это вещества, обладающие высокой электропроводностью и теплопроводностью, ковкостью, пластичностью и металлическим блеском. Эти характерные
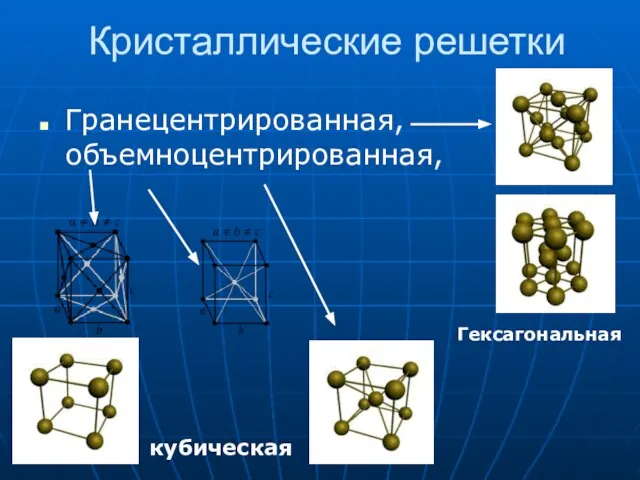
- 9. Кристаллические решетки Гранецентрированная, объемноцентрированная, кубическая Гексагональная
- 10. Физические свойства Металлический блеск, Твердость, Пластичность, Ковкость Тепло- и электропроводимость Теплопроводность и электропроводность уменьшается в ряду
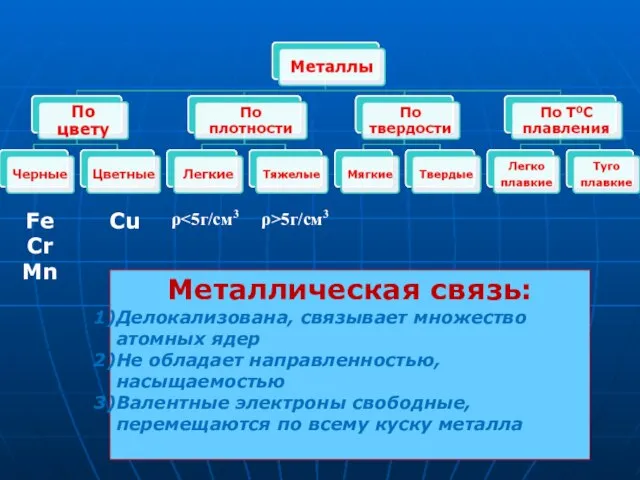
- 11. Fe Cr Mn ρ ρ>5г/см3 Cu Металлическая связь: Делокализована, связывает множество атомных ядер Не обладает направленностью,
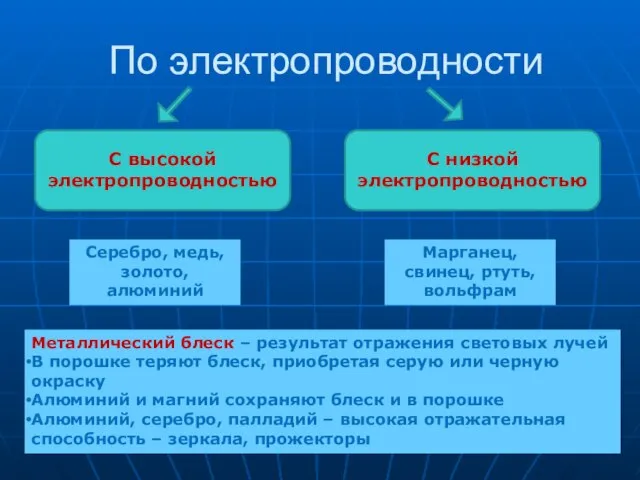
- 12. По электропроводности С высокой электропроводностью С низкой электропроводностью Серебро, медь, золото, алюминий Марганец, свинец, ртуть, вольфрам
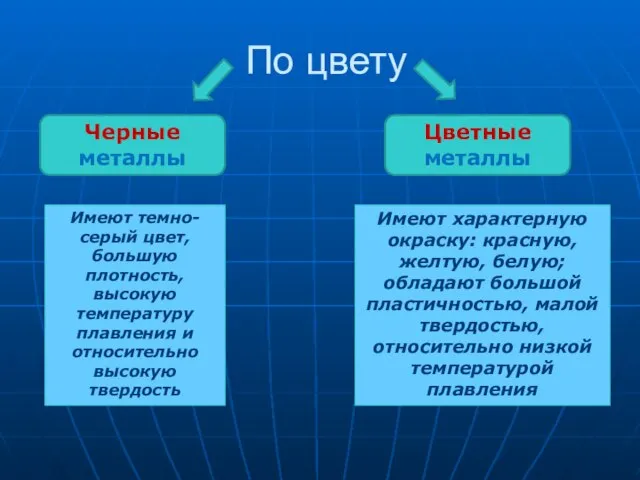
- 13. По цвету Имеют темно-серый цвет, большую плотность, высокую температуру плавления и относительно высокую твердость Черные металлы
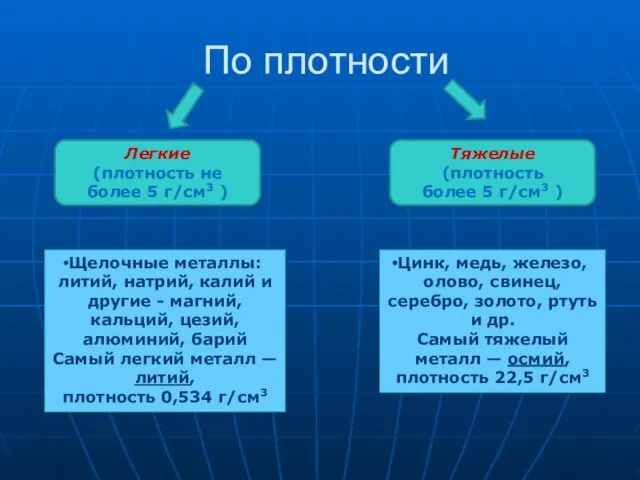
- 14. По плотности Легкие (плотность не более 5 г/см3 ) Тяжелые (плотность более 5 г/см3 ) Щелочные
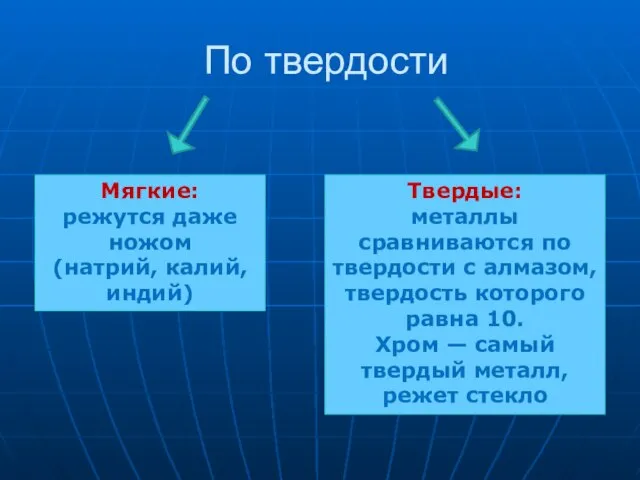
- 15. По твердости Мягкие: режутся даже ножом (натрий, калий, индий) Твердые: металлы сравниваются по твердости с алмазом,
- 16. По температуре плавления Легкоплавкие (температура плавления до 1539°С) Тугоплавкие (температура плавления выше 1539°С) Ртуть — tпл.=—38,9°С;
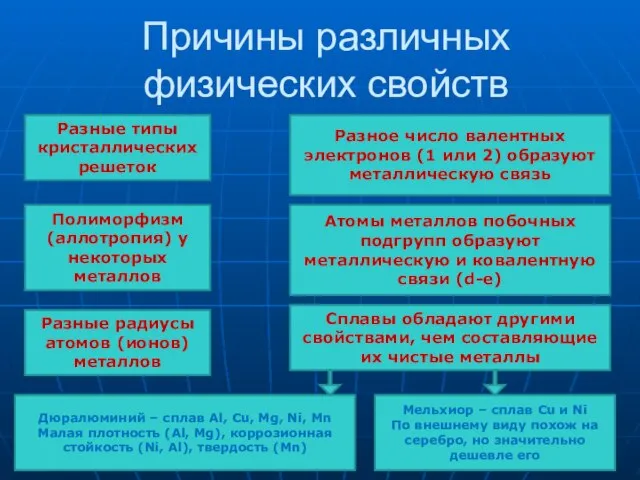
- 17. Причины различных физических свойств Разные типы кристаллических решеток Полиморфизм (аллотропия) у некоторых металлов Разное число валентных
- 18. Нахождение металлов в природе Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной
- 19. Нахождение металлов в природе — в самородном состоянии: серебро , золото , платина , медь ,
- 20. Способы получения металлов Восстановление: — из их оксидов углем или оксидом углерода (II) ZnО + С
- 21. Способы получения металлов Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем) 2ZnS + ЗО2
- 22. Способы получения металлов Электролизом расплавов солей СuСl2 ? Сu2++ 2Сl- Катод (восстановление): Сu2+ 2е- = Сu0
- 23. Гидрометаллургия Методы получения металлов, основанные на химических реакциях, происходящих в растворах 1 стадия – перевод нерастворимых
- 24. Химические свойства металлов В химическом отношении все металлы характеризуются сравнительной легкостью отдачи валентных электронов и способностью
- 25. Химические свойства металлов Восстановительная способность различных металлов неодинакова и определяется положением в электрохимическом ряду напряжения металлов
- 26. Химические свойства металлов
- 27. Химические свойства металлов ОТНОШЕНИЕ МЕТАЛЛОВ К ОКИСЛИТЕЛЯМ - ПРОСТЫМ ВЕЩЕСТВАМ Восстановление неметаллов Реакции с галогенами и
- 28. Химические свойства металлов Менее энергично металлы взаимодействуют с серой: Сu + S = СuS Fе +
- 29. ОТНОШЕНИЕ МЕТАЛЛОВ К ОКИСЛИТЕЛЯМ - СЛОЖНЫМ ВЕЩЕСТВАМ ОТНОШЕНИЕ МЕТАЛЛОВ К ВОДЕ а) активные металлы интенсивно взаимодействуют
- 30. ОТНОШЕНИЕ МЕТАЛЛОВ К ВОДНЫМ РАСТВОРАМ ЩЕЛОЧЕЙ Zn + 2H2O + 2NaOH = Na2[Zn(OH)4] + H2 1)
- 31. ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ По окислительной активности кислоты условно делят на 2 группы: 1) кислоты -
- 32. ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ - СЛАБЫМ ОКИСЛИТЕЛЯМ металлы, стоящие в ряду напряжений до водорода Zn +
- 33. Некоторые малоактивные металлы Медь не взаимодействует с разбавленной соляной кислотой, но образует комплекс с концентрированной кислотой
- 34. ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ - СИЛЬНЫМ ОКИСЛИТЕЛЯМ а) Отношение металлов к концентрированной H2SO4 . Окислителем в
- 35. 4Mg + 5 H2SO4(к) = 4MgSO4 + H2S + 4H2O 3Zn + 4 H2SO4(к) = 3ZnSO4
- 36. Отношение металлов к разбавленной HNO3 Окислителем в растворах HNO3 является нитрат-ион: NO3-. Пассивация - торможение (или
- 37. Разбавленная кислота 4Ca + 10HNO3 = 4Ca(NO3)2 + NH4NO3 + 3H2O 5Ni + 12HNO3 = 5Ni(NO3)2
- 38. Отношение металлов к концентрированной HNO3 Ba + 4 HNO3 (к) = Ba(NO3)2 + 2NO2 + 2H2O
- 39. Ряд элементов, имеющих высокие (+4 и более) степени окисления Sn + 4HNO3(к) = H2SnO3 + 4NO2
- 40. Отношение металлов к смесям кислот HNO3 + 3HCl (“царская водка”) Au + HNO3 + 4HCl =
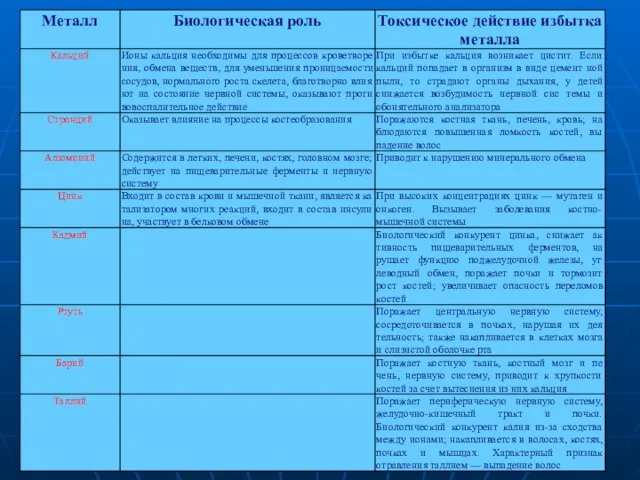
- 41. Биологическая роль металлов и их токсическое действие
- 43. Упражнения Сравните взаимодействие, сделайте выводы об их восстановительной способности, напишите возможные уравнения реакций: Na, Li, Cu,
- 44. Взаимодействие с органическими веществами Составьте уравнения реакций: взаимодействия Na и К с этанолом, этиленгликолем, фенолом. Какая
- 46. Скачать презентацию



































 Тема урока:Прикладная среда графического редактора Paint.
Тема урока:Прикладная среда графического редактора Paint. Презентация на тему Система национальных счетов
Презентация на тему Система национальных счетов Двадцатилетний брак великого князя Московского Василия III с Соломонией Сабуровой был бесплоден. Отправив законную жену в монастыр
Двадцатилетний брак великого князя Московского Василия III с Соломонией Сабуровой был бесплоден. Отправив законную жену в монастыр Cn(H2O)m
Cn(H2O)m 20140111_prezentatsiya_k_igre
20140111_prezentatsiya_k_igre Умей предупреждать болезни
Умей предупреждать болезни Еженедельное совещание. Статус работ блока Геология и разработка
Еженедельное совещание. Статус работ блока Геология и разработка Изделие Святой Николаус-Чудотворец
Изделие Святой Николаус-Чудотворец Среднее арифметическое, мода и размах ряда.
Среднее арифметическое, мода и размах ряда. Амплуа игроков в волейболе и их функции
Амплуа игроков в волейболе и их функции Страховые представители АО Страховая компания СОГАЗ-Мед
Страховые представители АО Страховая компания СОГАЗ-Мед «EVA 2011 Москва» 28 – 30 ноября 2011 Сбор и долговременное сохранение электронной информации в сфере культуры. Л.А. Куйбышев, Н.В. Браккер,
«EVA 2011 Москва» 28 – 30 ноября 2011 Сбор и долговременное сохранение электронной информации в сфере культуры. Л.А. Куйбышев, Н.В. Браккер,  Диего Веласкес. Сдача Бреды 1634–1635
Диего Веласкес. Сдача Бреды 1634–1635 К НЕМУ НЕ ЗАРАСТЕТНАРОДНАЯ ТРОПА А. С. Пушкину посвящается…
К НЕМУ НЕ ЗАРАСТЕТНАРОДНАЯ ТРОПА А. С. Пушкину посвящается… тема: «Воображение как общая способность»
тема: «Воображение как общая способность»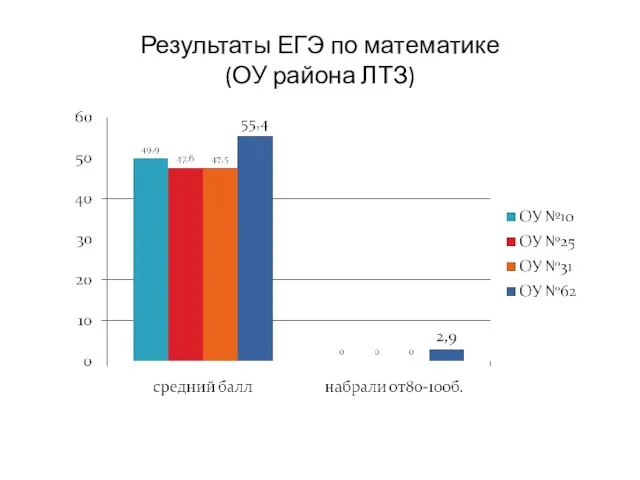 Результаты ЕГЭ по математике (ОУ района ЛТЗ)
Результаты ЕГЭ по математике (ОУ района ЛТЗ) Качество влияния личности на ход истории (на примере А. Гитлера и И. Сталина)
Качество влияния личности на ход истории (на примере А. Гитлера и И. Сталина) Организация обучения учителей по курсу «Основы религиозных культур и светской этики» в Калининградской области
Организация обучения учителей по курсу «Основы религиозных культур и светской этики» в Калининградской области ООО Глобал Контейнер Лоджистикс
ООО Глобал Контейнер Лоджистикс Жак Рене Ширак
Жак Рене Ширак Игра в слова
Игра в слова Бизнес-план Пончиковой
Бизнес-план Пончиковой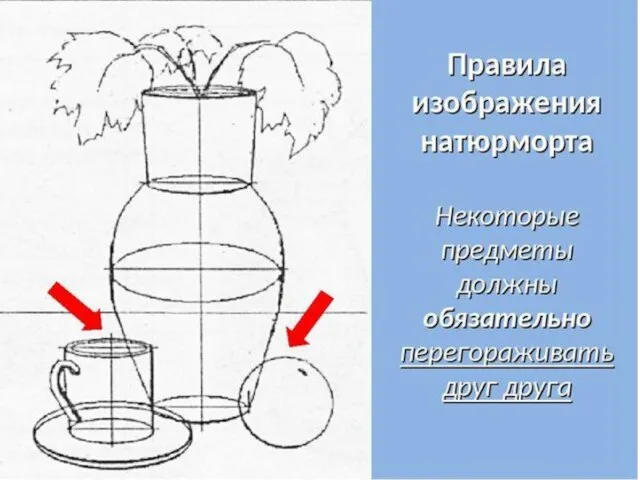 Занятие 3 года обучения на каникулах. Декоративный натюрморт
Занятие 3 года обучения на каникулах. Декоративный натюрморт Лабораторная группаРезультаты серологического этапа ДЭН выводы, задачи2008 год
Лабораторная группаРезультаты серологического этапа ДЭН выводы, задачи2008 год Виды наказаний
Виды наказаний Ультразвуковой датчик
Ультразвуковой датчик Легенды театральной сцены
Легенды театральной сцены ПОДПИСКА
ПОДПИСКА