Содержание
- 2. ДНК Выделение ДНК Использование ДНК Методы исследования ДНК
- 3. Выделение ДНК ДНК может быть выделена из различного материала: свежего, замороженного, сушенного, фиксированного и т.д. В
- 4. Использование ДНК Молекулярно биологические исследования Филогенетика и генеалогия Клинические исследования Генетическая инженерия Криминалистика – судебно-медицинская экспертиза
- 5. Методы анализа ДНК Физико-химические методы Цитологические методы Биохимические и молекулярно биологические методы Биоинформатические методы Комплексные методы
- 6. Физико-химические методы Рентгеновская кристаллография Спектрофотометрия Проточная цитометрия Центрифугирование в градиенте плотности Электрофорез
- 7. Кристаллография - Дифракционная рентгенография При облучении кристалла сфокусированным рентгеновским лучом на выходе получается рассеянный в результате
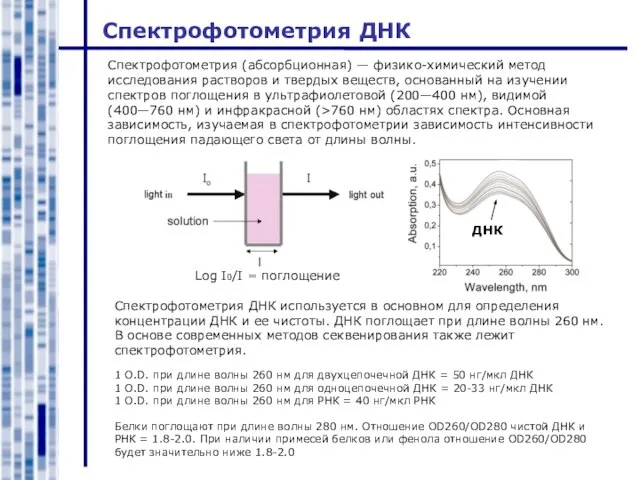
- 8. Спектрофотометрия ДНК Спектрофотометрия (абсорбционная) — физико-химический метод исследования растворов и твердых веществ, основанный на изучении спектров
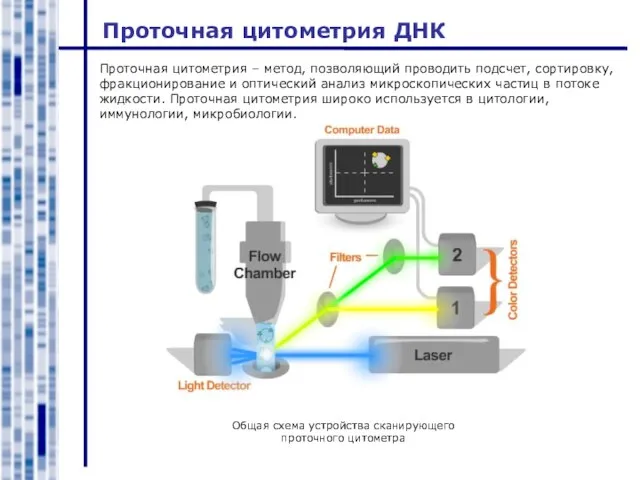
- 9. Проточная цитометрия ДНК Проточная цитометрия – метод, позволяющий проводить подсчет, сортировку, фракционирование и оптический анализ микроскопических
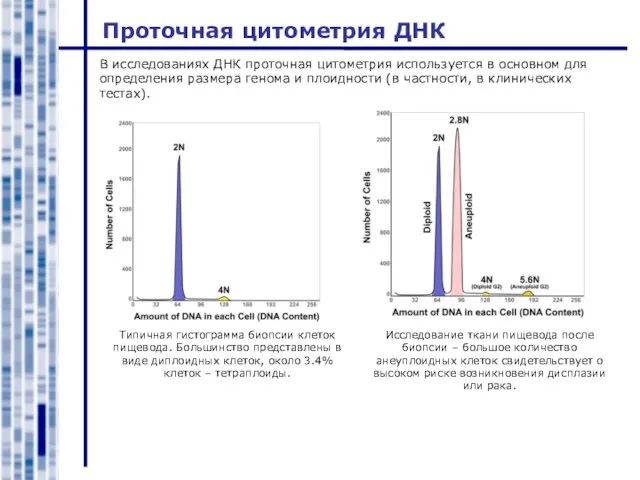
- 10. Проточная цитометрия ДНК Исследование ткани пищевода после биопсии – большое количество анеуплоидных клеток свидетельствует о высоком
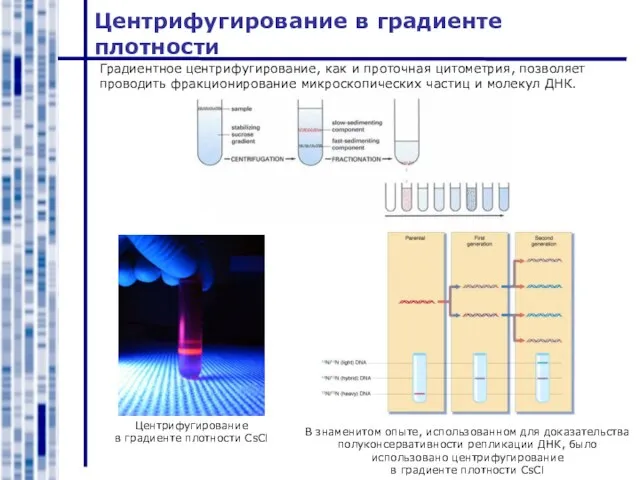
- 11. Центрифугирование в градиенте плотности Центрифугирование в градиенте плотности CsCl Градиентное центрифугирование, как и проточная цитометрия, позволяет
- 12. Зональный электрофорез ДНК Электрофорез - это один из видов направленных движений заряженных частиц коллоидных систем в
- 13. Цитологические методы Световая микроскопия Электронная микроскопия Гибридизация in situ
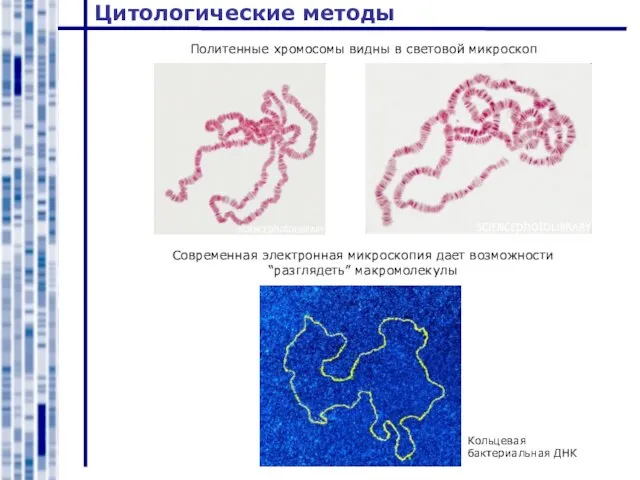
- 14. Цитологические методы Политенные хромосомы видны в световой микроскоп Современная электронная микроскопия дает возможности “разглядеть” макромолекулы Кольцевая
- 15. Цитологические методы - FISH Гибридизация in situ позволяет определить, в каком сегменте хромосомы расположен соответствующий маркер.
- 16. Биохимические и молекулярно биологические методы Рестрикция Клонирование Полимеразная цепная реакция Секвенирование Гибридизация Обратная транскрипция
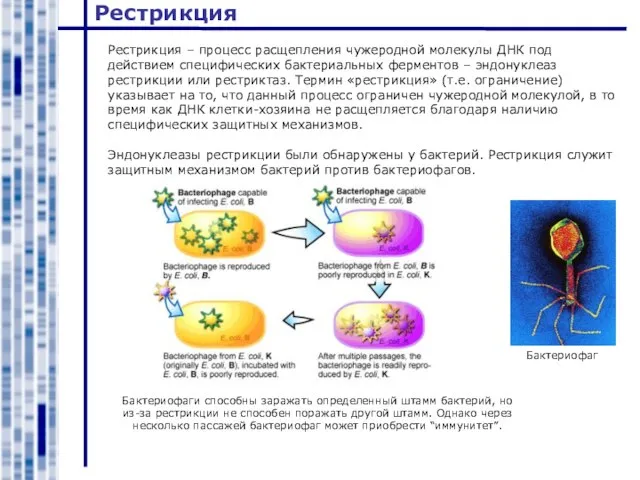
- 17. Рестрикция Рестрикция – процесс расщепления чужеродной молекулы ДНК под действием специфических бактериальных ферментов – эндонуклеаз рестрикции
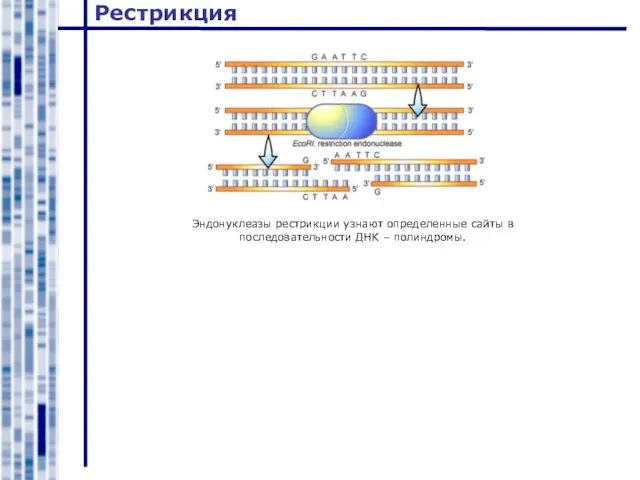
- 18. Рестрикция Эндонуклеазы рестрикции узнают определенные сайты в последовательности ДНК – полиндромы.
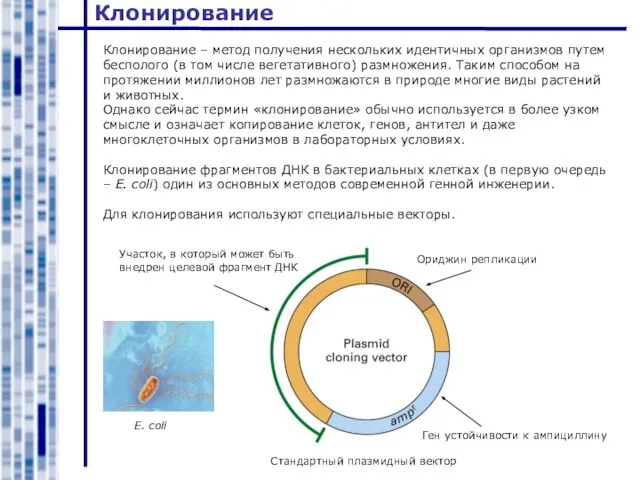
- 19. Клонирование Клонирование – метод получения нескольких идентичных организмов путем бесполого (в том числе вегетативного) размножения. Таким
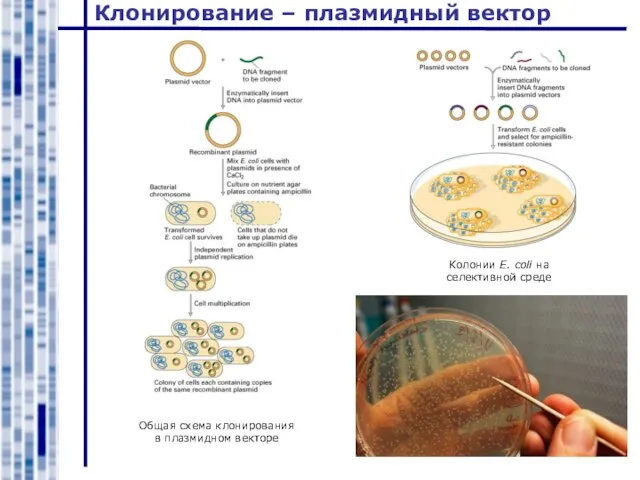
- 20. Клонирование – плазмидный вектор Общая схема клонирования в плазмидном векторе Колонии E. coli на селективной среде
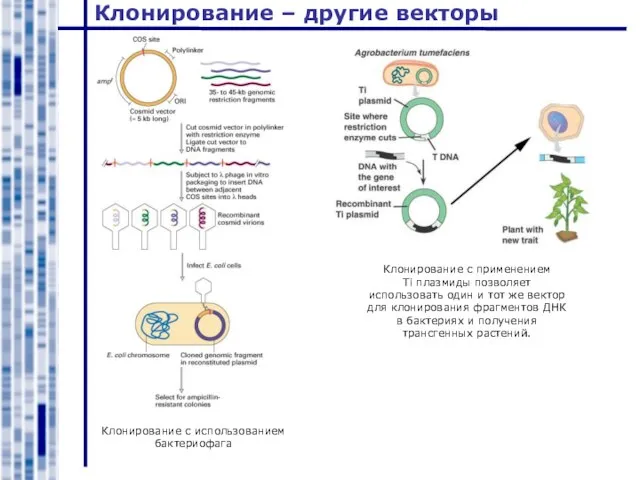
- 21. Клонирование – другие векторы Клонирование с использованием бактериофага Клонирование с применением Ti плазмиды позволяет использовать один
- 22. Полимеразная цепная реакция Полимеразная цепная реакция (ПЦР) — экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения
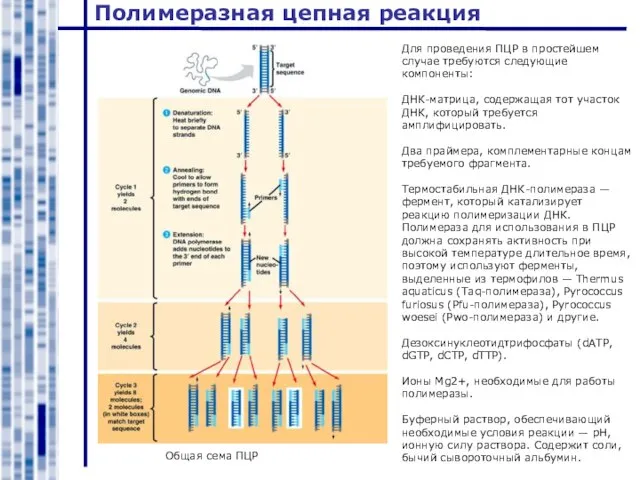
- 23. Полимеразная цепная реакция Общая сема ПЦР Для проведения ПЦР в простейшем случае требуются следующие компоненты: ДНК-матрица,
- 24. Полимеразная цепная реакция «Вложенная» ПЦР (Nested PCR) — применяется для уменьшения числа побочных продуктов реакции. Используют
- 25. Полимеразная цепная реакция Touchdown (Stepdown) ПЦР (Touchdown PCR) — с помощью этого метода уменьшают влияние неспецифического
- 26. Секвенирование Секвенирование биополимеров (белков и нуклеиновых кислот — ДНК и РНК) — определение их первичной аминокислотной
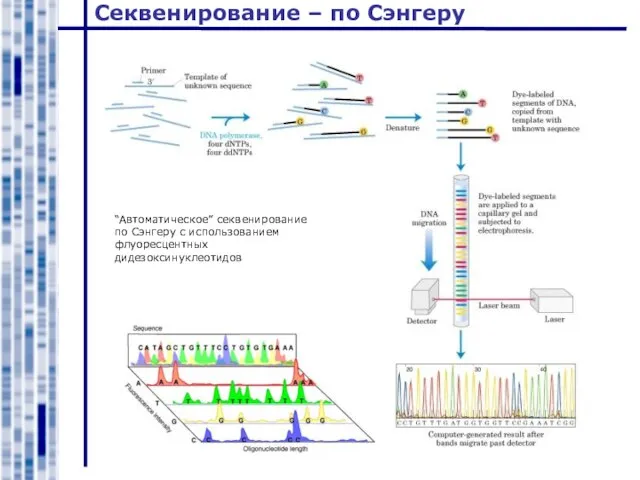
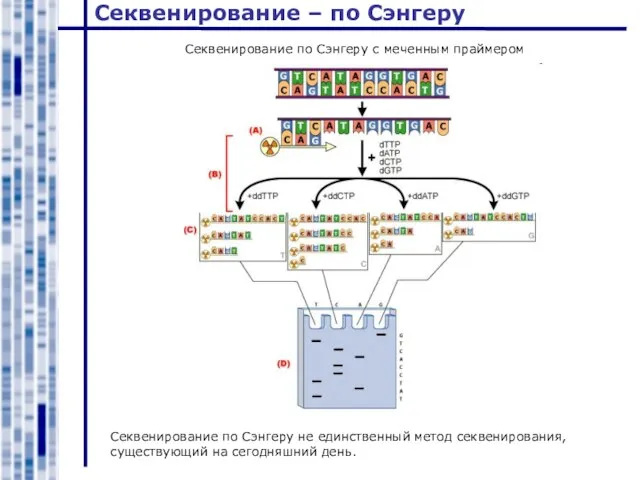
- 27. Секвенирование – по Сэнгеру “Автоматическое” секвенирование по Сэнгеру с использованием флуоресцентных дидезоксинуклеотидов
- 28. Секвенирование – по Сэнгеру Секвенирование по Сэнгеру не единственный метод секвенирования, существующий на сегодняшний день. Секвенирование
- 29. Секвенирование – letter by letter Метод “буква за буквой” (letter by letter) позволяет осуществлять секвенирование молекул
- 30. Секвенирование – letter by letter 3. Флуоресцентная метка и блокер удаляются при облучении молекулы лазером. 4.
- 31. Секвенирование Существуют и другие методы секвенирования. Например, секвенирование при помощи электронного сканирующего микроскопа. Разрабатывается метод секвенирования
- 32. Гибридизация Если водный раствор ДНК нагреть до 100°С или повысить рН до 13, то ДНК диссоциирует
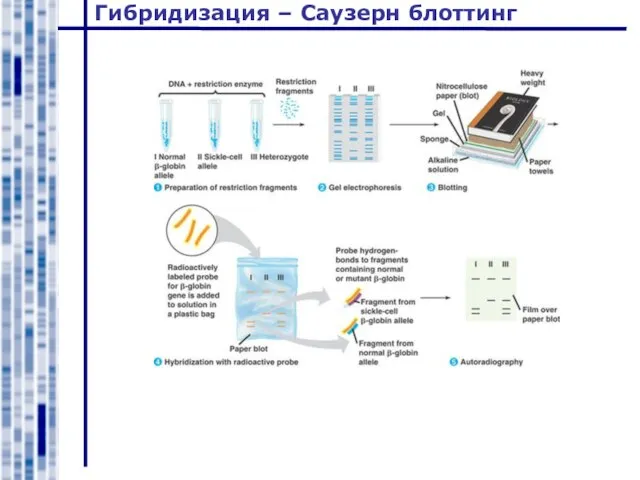
- 33. Гибридизация – Саузерн блоттинг
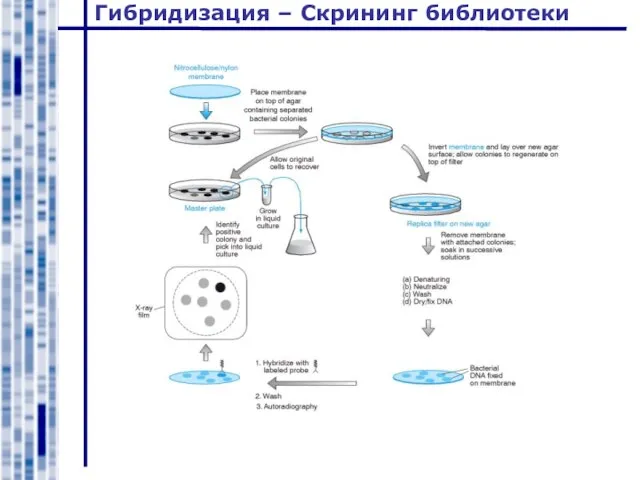
- 34. Гибридизация – Скрининг библиотеки
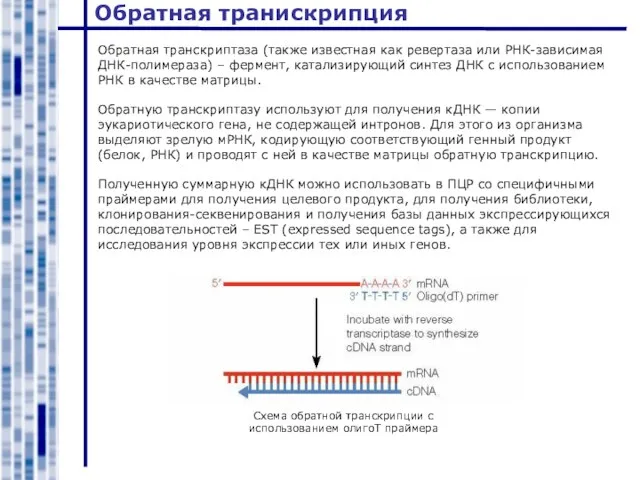
- 35. Обратная транискрипция Обратная транскриптаза (также известная как ревертаза или РНК-зависимая ДНК-полимераза) – фермент, катализирующий синтез ДНК
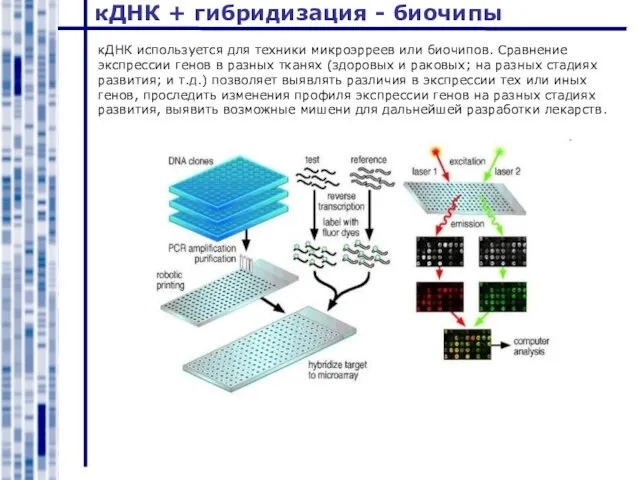
- 36. кДНК + гибридизация - биочипы кДНК используется для техники микроэрреев или биочипов. Сравнение экспрессии генов в
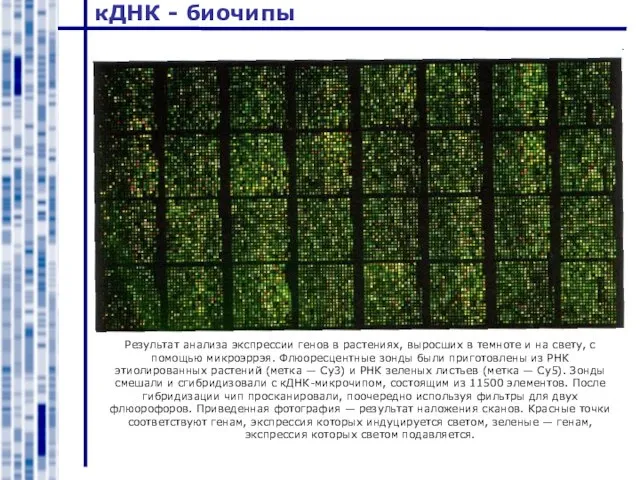
- 37. кДНК - биочипы Результат анализа экспрессии генов в растениях, выросших в темноте и на свету, с
- 38. Биоинформатические методы Объем генетической информации, накапливаемой в банках данных, увеличивается с возрастающей скоростью. Биоинформатические методы позволяют
- 39. Биоинформатические методы – анализ последовательностей ДНК Секвенирование – первый шаг на пути исследования последовательностей ДНК и
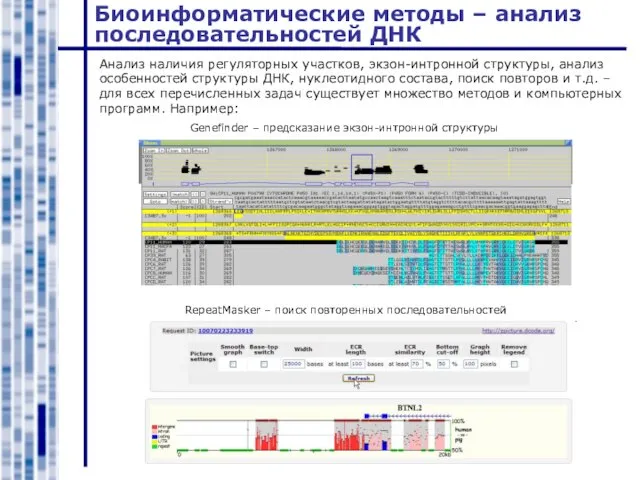
- 40. Биоинформатические методы – анализ последовательностей ДНК Анализ наличия регуляторных участков, экзон-интронной структуры, анализ особенностей структуры ДНК,
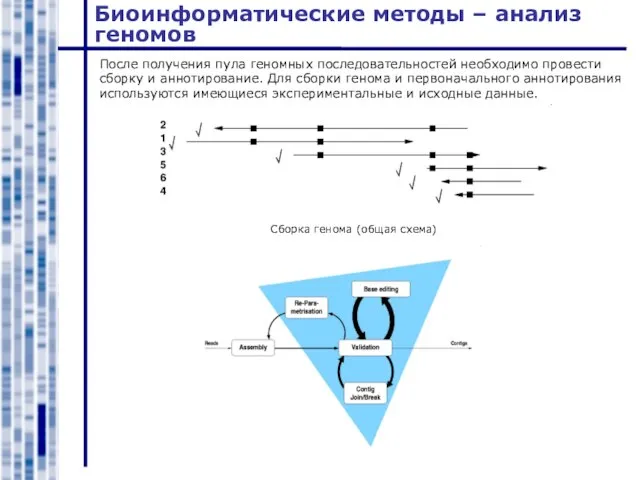
- 41. Биоинформатические методы – анализ геномов После получения пула геномных последовательностей необходимо провести сборку и аннотирование. Для
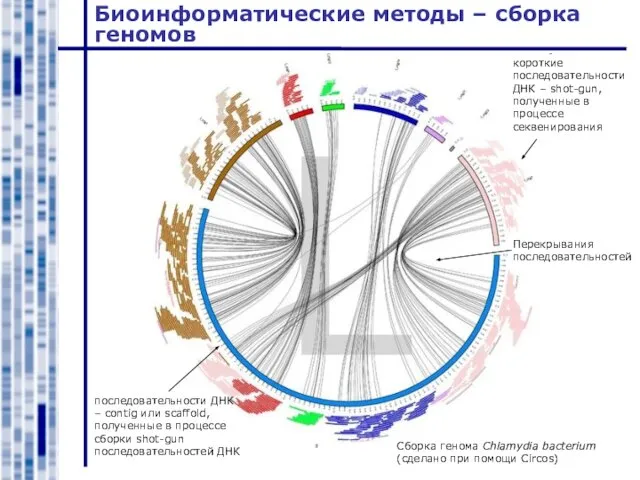
- 42. Биоинформатические методы – сборка геномов Сборка генома Chlamydia bacterium (сделано при помощи Circos) короткие последовательности ДНК
- 43. Биоинформатические методы – сборка геномов Еще одна иллюстрация процесса сборки генома Chlamydia bacterium (сделано при помощи
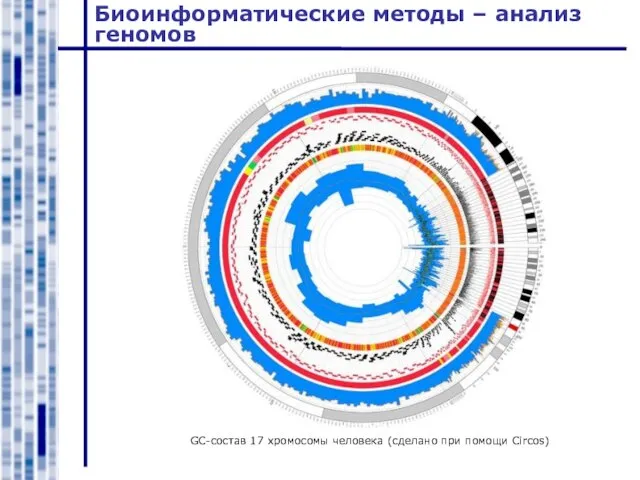
- 44. Биоинформатические методы – анализ геномов GC-состав 17 хромосомы человека (сделано при помощи Circos)
- 45. Биоинформатические методы – аннотирование геномов Анализ геномов – 17 хромосома человека, зеленым показаны предсказанные гены, желтым
- 47. Скачать презентацию





















 Бессмертная комедия А. С. Грибоедова «Горе от ума»
Бессмертная комедия А. С. Грибоедова «Горе от ума» Урок коллективного посещения в 5 классе
Урок коллективного посещения в 5 классе ПЕДАГОГИЧЕСКИЙ СОВЕТОДАРЁННЫЕ ДЕТИ: реалии, проблемы, перспективы.
ПЕДАГОГИЧЕСКИЙ СОВЕТОДАРЁННЫЕ ДЕТИ: реалии, проблемы, перспективы. Ранения. Первая медицинская помощь
Ранения. Первая медицинская помощь Совершенствование сервисно-транспортной инфраструктуры придомовых территорий
Совершенствование сервисно-транспортной инфраструктуры придомовых территорий СТЕКЛЯННЫЕ ТОВАРЫ
СТЕКЛЯННЫЕ ТОВАРЫ Применение электролиза. Основная химическая промышленность
Применение электролиза. Основная химическая промышленность Маршрут прогулки по городу Борисоглебск
Маршрут прогулки по городу Борисоглебск Региональный студенческий хакатон ООО АИС город
Региональный студенческий хакатон ООО АИС город Берегите зрение
Берегите зрение Конкурентные преимущества и перспективы развития казахстанского фондового рынка
Конкурентные преимущества и перспективы развития казахстанского фондового рынка Древние восточные церкви. Православие за рубежом в xх – xxi вв
Древние восточные церкви. Православие за рубежом в xх – xxi вв Pro-психологов: психологическая служба образовательной организации
Pro-психологов: психологическая служба образовательной организации ST Main Page
ST Main Page Лекарственная аллергия
Лекарственная аллергия Знаковые модели. Моделирование и формализация
Знаковые модели. Моделирование и формализация Развитие координационных способностей у юных борцов вольного стиля
Развитие координационных способностей у юных борцов вольного стиля Диплом партнёра центра спортивного комплексного обучения по хоккею г. Сморгони
Диплом партнёра центра спортивного комплексного обучения по хоккею г. Сморгони МЕТОДИКА ПРОВЕДЕНИЯ КОРРЕКЦИОННЫХ ЗАНЯТИЙ
МЕТОДИКА ПРОВЕДЕНИЯ КОРРЕКЦИОННЫХ ЗАНЯТИЙ Политический конфликт
Политический конфликт Чемпионат и первенство города Ярославля по зимнему триатлону
Чемпионат и первенство города Ярославля по зимнему триатлону AI автомобиля в изменчивом мире на примере Ex Machina
AI автомобиля в изменчивом мире на примере Ex Machina Восприятие речи
Восприятие речи Конаково
Конаково Сударыня - Масленица
Сударыня - Масленица Візуальний контакт під час ділової комунікації
Візуальний контакт під час ділової комунікації Технологии проведения избирательной кампании
Технологии проведения избирательной кампании Общественная организацияг.Балаково Саратовской области«Попечительский совет средней школы №11»
Общественная организацияг.Балаково Саратовской области«Попечительский совет средней школы №11»