Содержание
- 2. Благодарю за внимание!
- 3. Иммунологическая толерантность (терпимость) 1- активное состояние иммунной системы, которое характеризуется неотвечаемостью на антигены (требуется предварительный контакт
- 4. Иммунологическая толерантность формируется естественными и искусственными путями. Естественные пути: Физиологические: -терпимость к своим молекулам поддерживается в
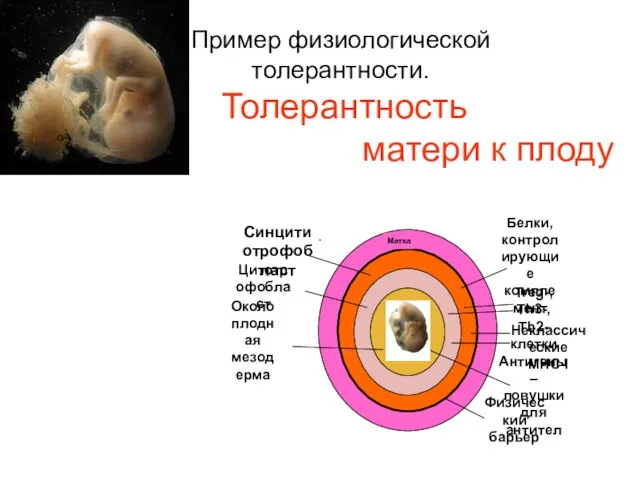
- 5. Пример физиологической толерантности. Толерантность матери к плоду
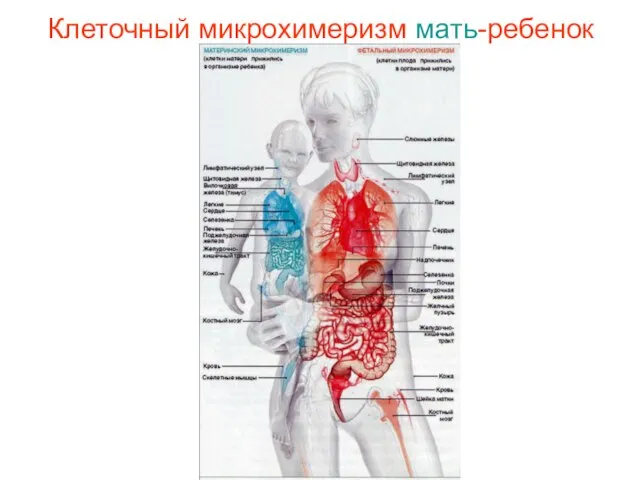
- 7. Клеточный микрохимеризм мать-ребенок
- 8. История идей в изучении толерантности
- 9. Американский генетик R.OWEN, впервые описавший в 1945 году эритроцитарный мозаицизм у дизиготных телят-двоен (химеризм)
- 10. 1960
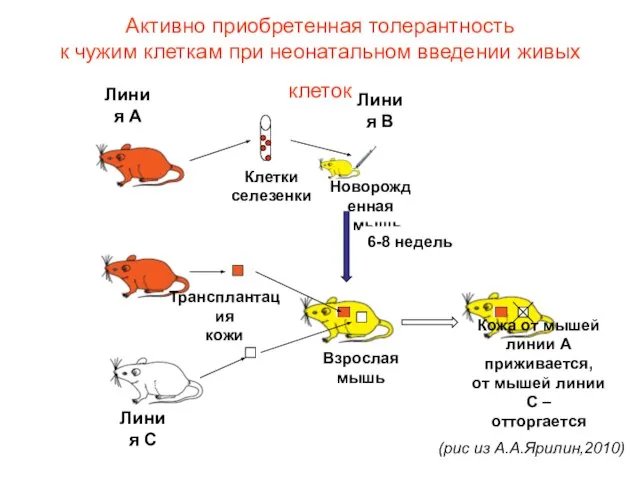
- 11. Активно приобретенная толерантность Billingham RE, Brent L, Medawar P. Nature,1953;172:603-6 Взята самка СВА на 15—16-й день
- 12. Активно приобретенная толерантность к чужим клеткам при неонатальном введении живых клеток (рис из А.А.Ярилин,2010)
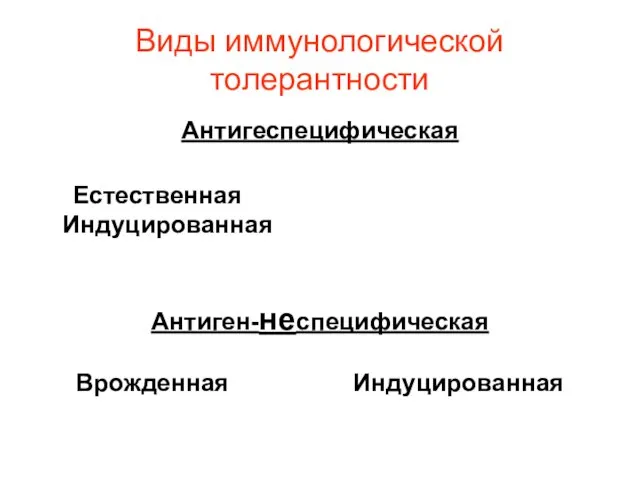
- 13. Виды толерантности
- 14. Виды иммунологической толерантности Антигеспецифическая Естественная Индуцированная Антиген-неспецифическая Врожденная Индуцированная
- 15. Антигеспецифическая Естественная Толерантность к молекулам своего организма (аутотолерантность) Формирование толерантности к своим молекулам в процессе эмбриогенеза
- 16. Антиген-специфическая индуцированная толерантность Введение антигена в эмбрион или в первые сутки после рождения (эксперименты, врожденные и
- 17. Антигеннеспецифическая иммунологическая врожденная толерантность Обусловлена неспособностью к иммунному ответу при: Грубых генетических дефектах в иммунной системе
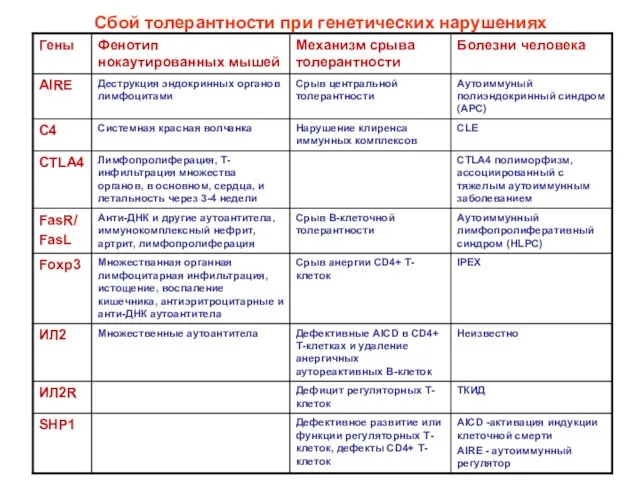
- 18. Сбой толерантности при генетических нарушениях
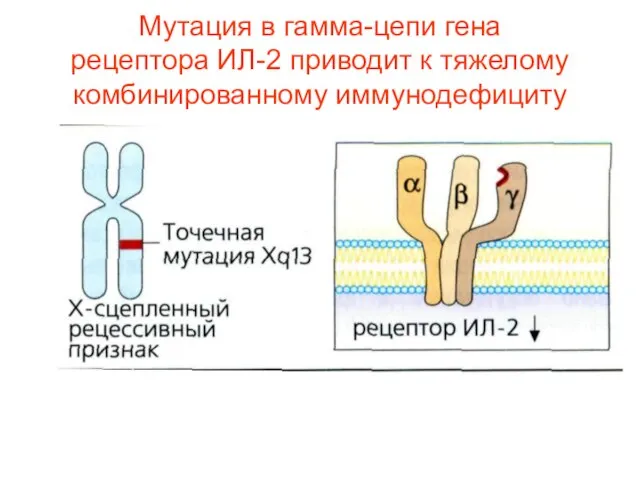
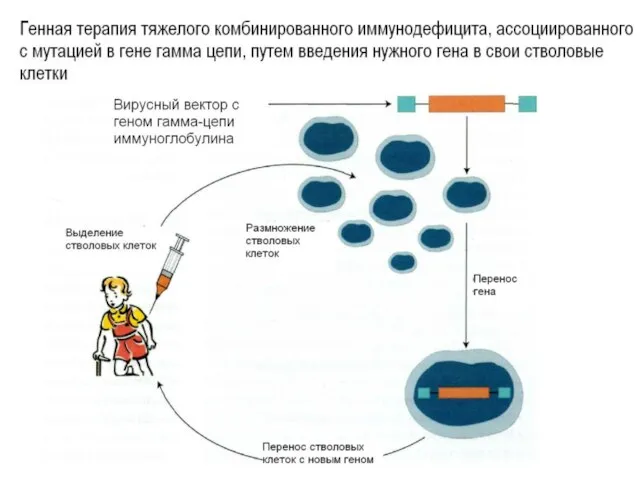
- 19. Мутация в гамма-цепи гена рецептора ИЛ-2 приводит к тяжелому комбинированному иммунодефициту
- 21. Антигеннеспецифическая индуцированная толерантность Супрессивные воздействия на иммунную систему Инфекционные Радиационные Токсические Лекарственные и др. Удаление лимфоидных
- 22. Индукции специфической аутотолерантности предшествует контакт с антигеном Запоминание «своих» молекул в эмбриональном периоде Центральная толерантность –
- 24. Клеточный ответ Толерантность Гуморальный ответ
- 25. Механизмы аутотолерантности Т-клеток Центральный Удаление аутореактивных клонов (гены AIRE – аутоиммунные регуляторы) Периферический «Иммунологическая привилегия» органов
- 26. Центральная аутотолерантность
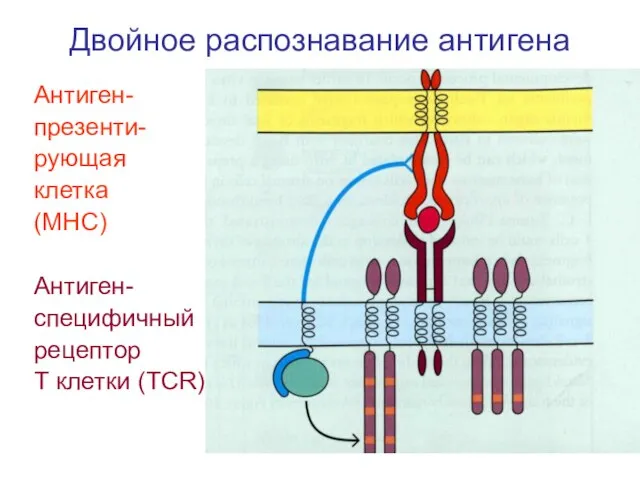
- 27. Двойное распознавание антигена Антиген- презенти- рующая клетка (МНС) Антиген- специфичный рецептор Т клетки (ТСR)
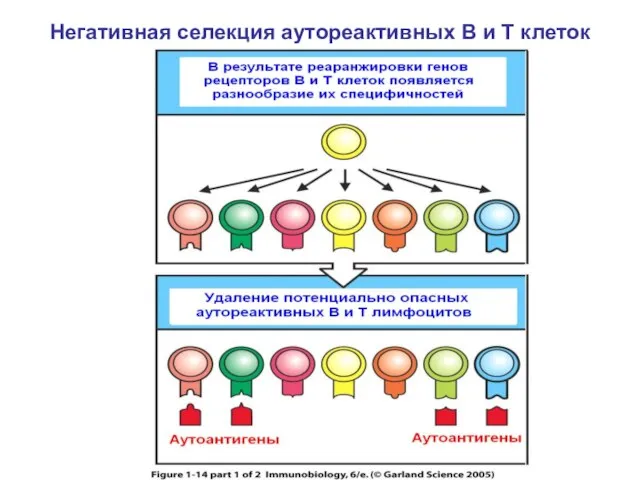
- 28. Негативная селекция аутореактивных В и Т клеток
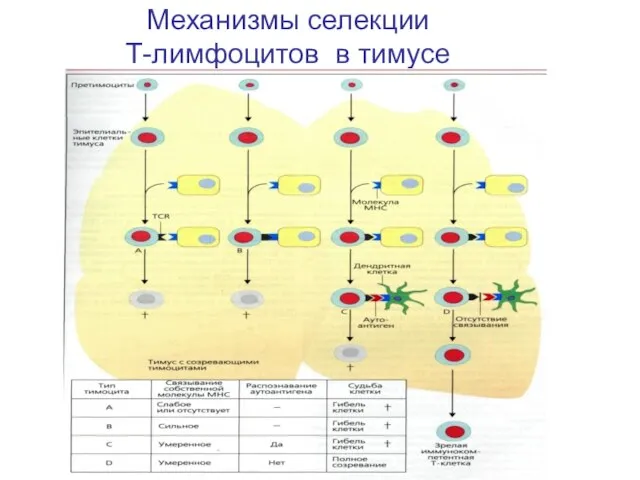
- 29. Позитивная селекция для тимоцитов, несущих рецепторы, способные к связыванию собственных молекул гистосовместимости (молекул MHC), которая обозначается
- 30. Механизмы селекции Т-лимфоцитов в тимусе
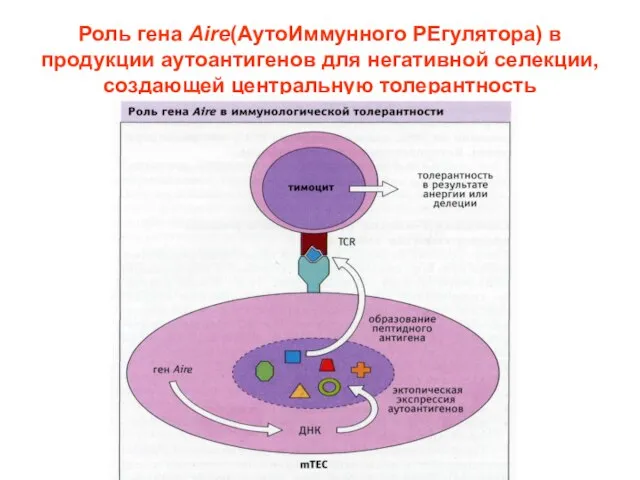
- 31. Роль гена Aire(АутоИммунного РЕгулятора) в продукции аутоантигенов для негативной селекции, создающей центральную толерантность
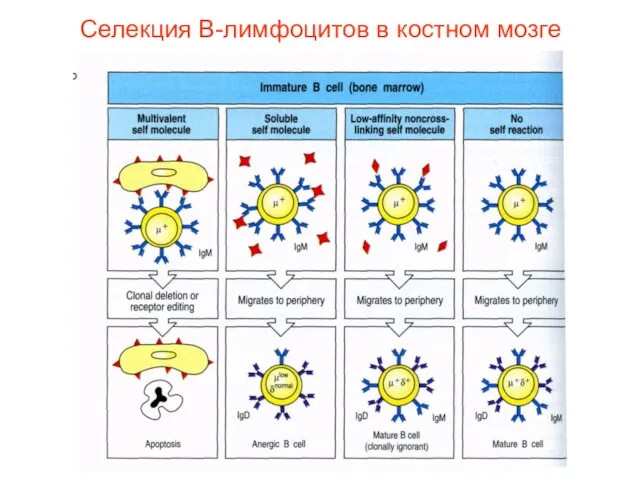
- 32. Селекция В-лимфоцитов в костном мозге
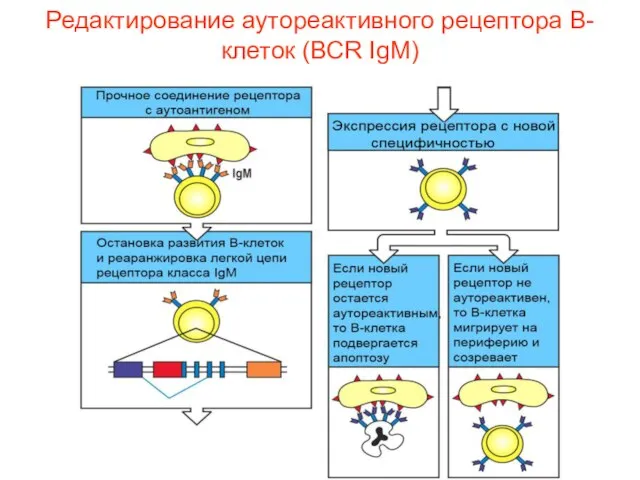
- 33. Редактирование аутореактивного рецептора В-клеток (ВСR IgM)
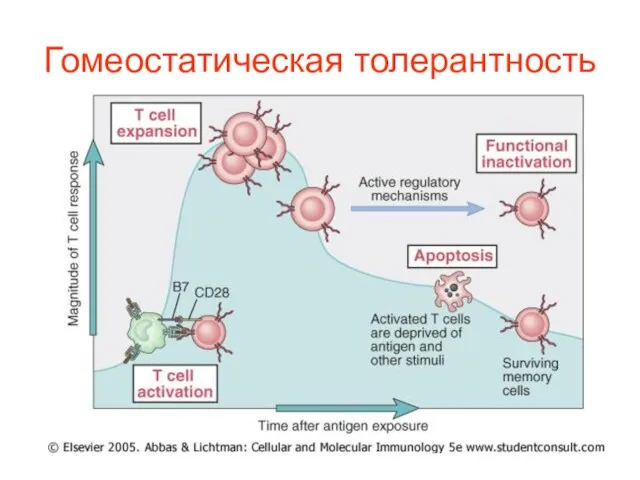
- 34. Гомеостатическая толерантность
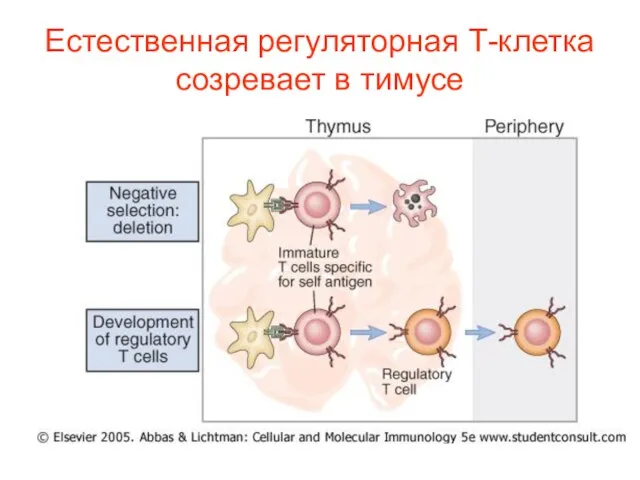
- 36. Естественная регуляторная Т-клетка созревает в тимусе
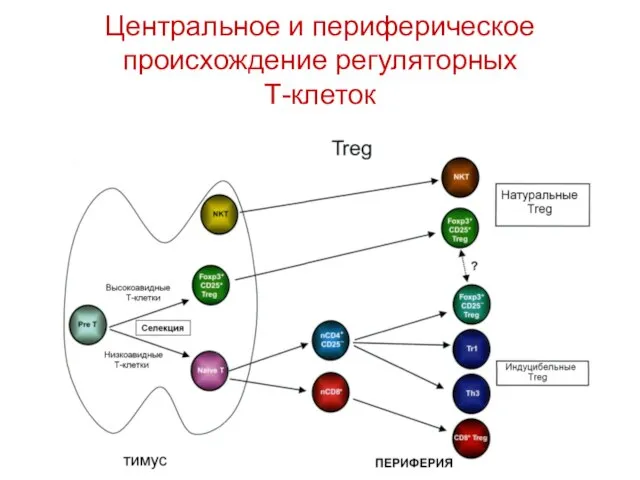
- 37. Центральное и периферическое происхождение регуляторных Т-клеток
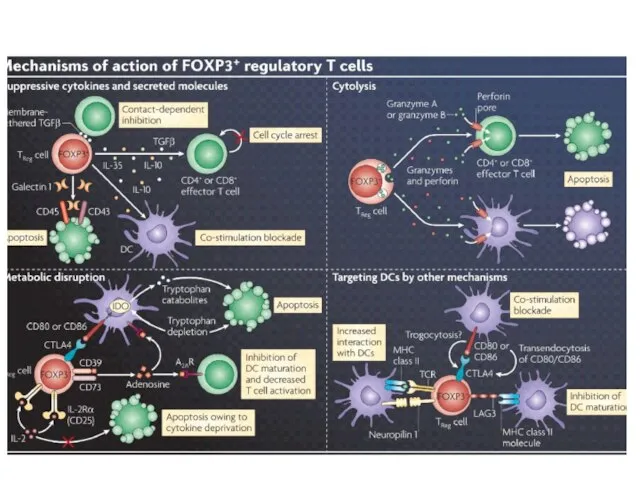
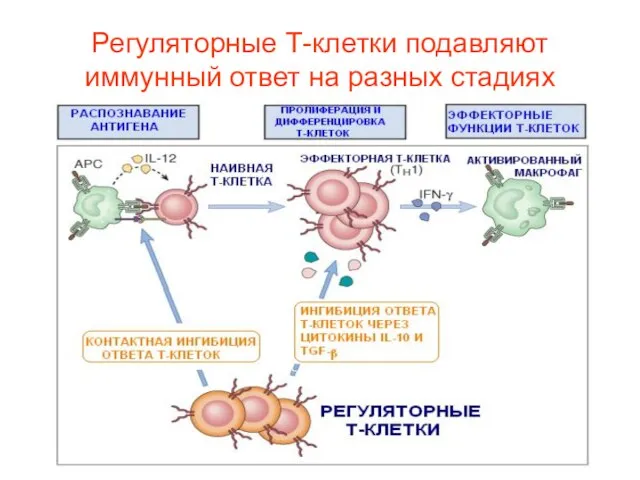
- 38. Регуляторные Т-клетки подавляют иммунный ответ на разных стадиях
- 39. Сокращение числа эффекторных Т-клеток на 90-95% после удаления патогена происходит по следующим причинам: Большое число оставшихся
- 40. Периферическая аутотолерантность
- 41. К периферической толерантности Незаметность антигенов для иммунной системы. Она проявляется по отношению к некоторым антигенам, расположенным
- 42. Разделение аутореактивных циркулирующих Т-лимфоцитов и аутоантигенов Для предотвращения доступа антигенпредставляющих клеток к достаточно большим количествам своих
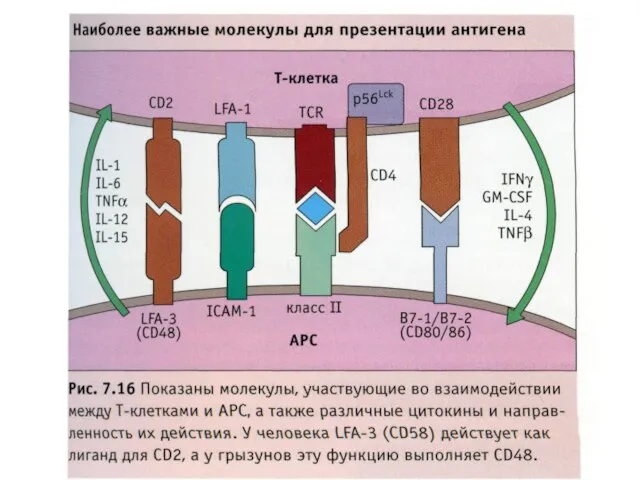
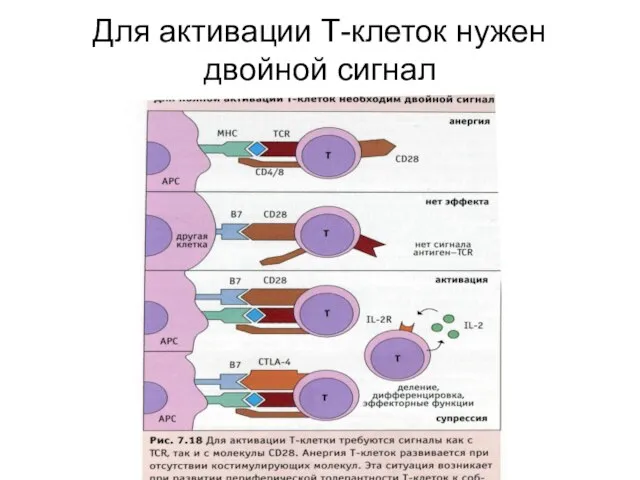
- 44. Для активации Т-клеток нужен двойной сигнал
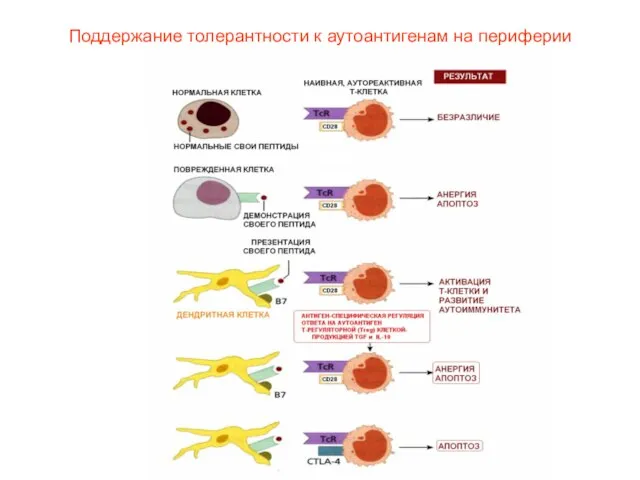
- 45. Поддержание толерантности к аутоантигенам на периферии
- 46. Толерантность в привилегированных зонах- яичке и глазном яблоке Для предотвращения воспаления и последующей аутоиммунной реакции в
- 47. В-клеточная толерантность В-клеточная толерантность выражена в меньшей степени, чем толерантность Т-клеток в связи с отсутствием эквивалента
- 48. Оральная толерантность
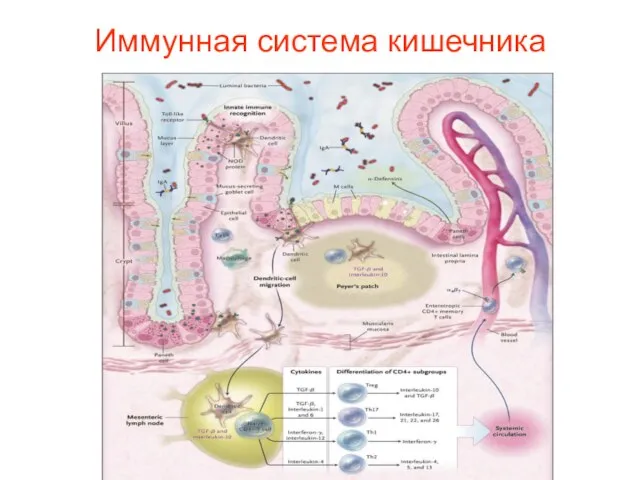
- 49. Иммунная система кишечника
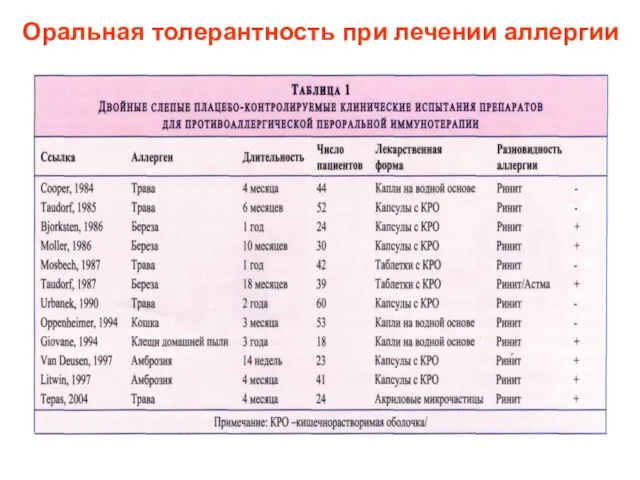
- 50. Оральная толерантность при лечении аллергии
- 51. ИММУННЫЕ МЕХАНИЗМЫ РАЗВИТИЯ ПАТОЛОГИЧЕСКИХ ПРОЦЕССОВ Клеточный ответ Гуморальный ответ
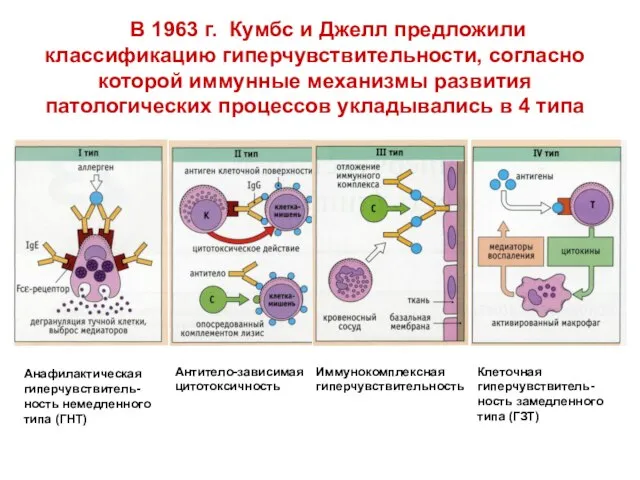
- 52. Анафилактическая гиперчувствитель-ность немедленного типа (ГНТ) В 1963 г. Кумбс и Джелл предложили классификацию гиперчувствительности, согласно которой
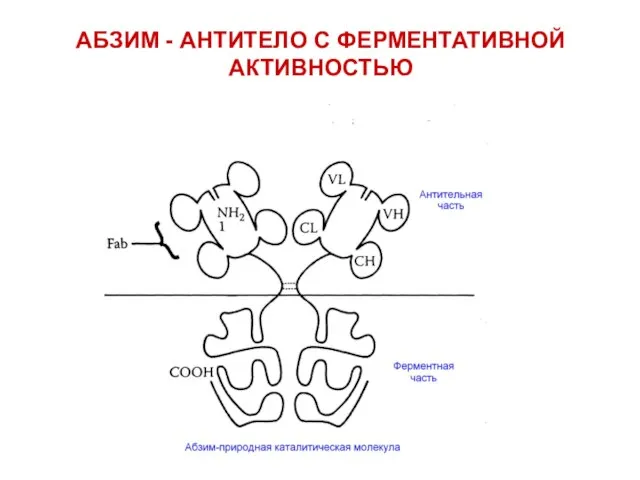
- 53. АБЗИМ - АНТИТЕЛО С ФЕРМЕНТАТИВНОЙ АКТИВНОСТЬЮ
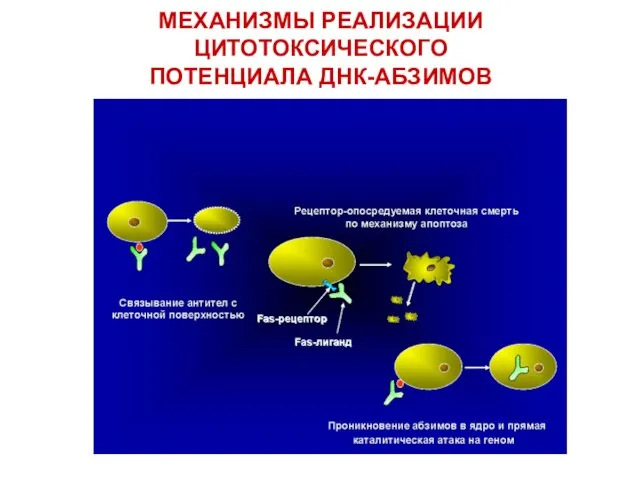
- 54. МЕХАНИЗМЫ РЕАЛИЗАЦИИ ЦИТОТОКСИЧЕСКОГО ПОТЕНЦИАЛА ДНК-АБЗИМОВ
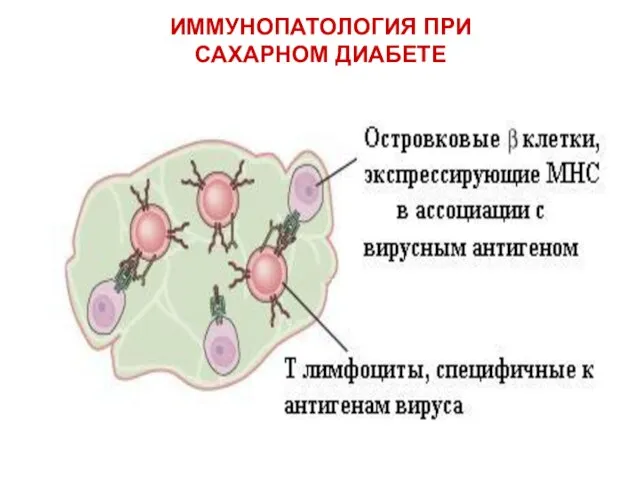
- 55. ИММУНОПАТОЛОГИЯ ПРИ САХАРНОМ ДИАБЕТЕ
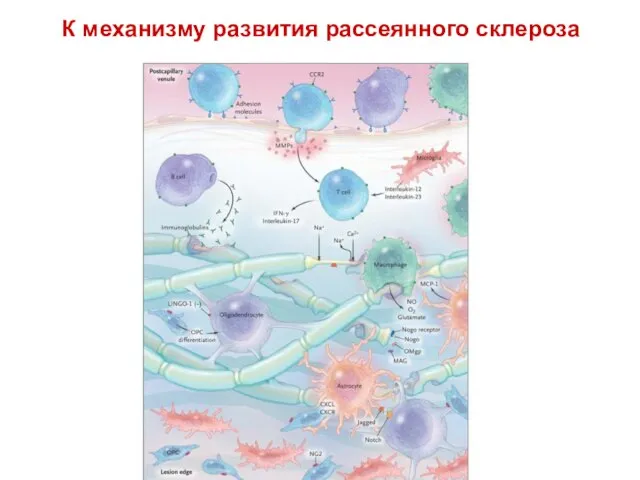
- 56. К механизму развития рассеянного склероза Figure 4. The Multiple Sclerosis Plaque. Within a postcapillary venule, various
- 57. Эктопическая лимфоидная ткань У части пациентов с аутоиммунными болезнями в мишеневом органе эктопически развивается организованная лимфоидная
- 58. Инфекция и аутоиммунитет Аутоиммунные болезни связаны с вирусными инфекциями, которые часто предшествуют возникновению воспаления в мишеневом
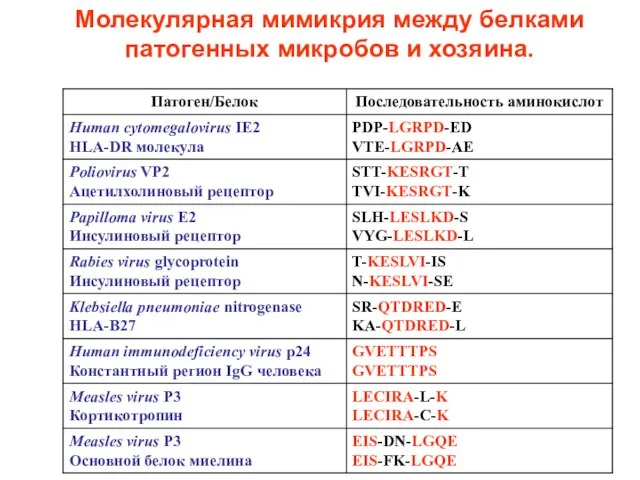
- 59. Молекулярная мимикрия между белками патогенных микробов и хозяина.
- 60. К механизмам развития иммунопатологических процессов (1/3) К настоящему времени открыты новые механизмы индукции и развития иммунопатологических
- 61. К механизмам развития иммунопатологических процессов (2/3) 11. Антигенная мимикрия между молекулами патогенов и хозяина 12. Индукция
- 62. К механизмам развития иммунопатологических процессов (3/3) 21. Лимфопролиферативные заболевания 22. Злокачественные новообразования 23. Антиммунные воздействия патогенов
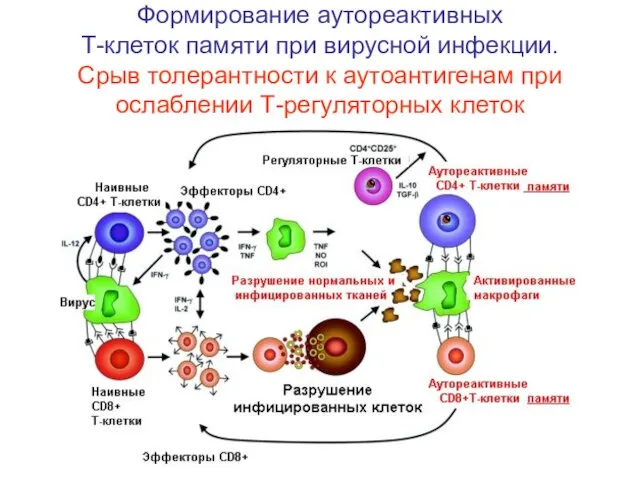
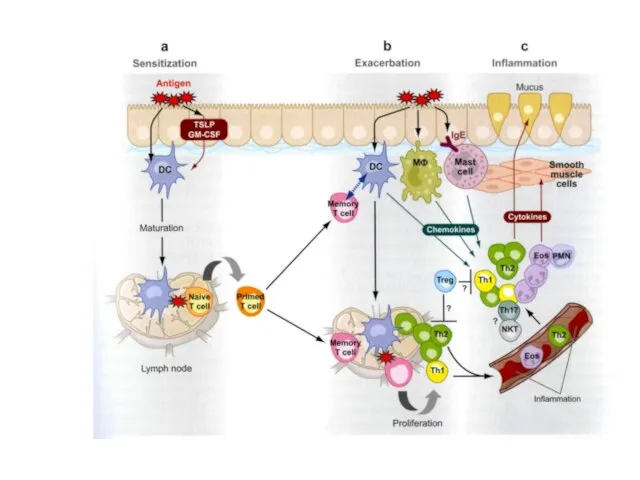
- 63. Формирование аутореактивных Т-клеток памяти при вирусной инфекции. Срыв толерантности к аутоантигенам при ослаблении Т-регуляторных клеток
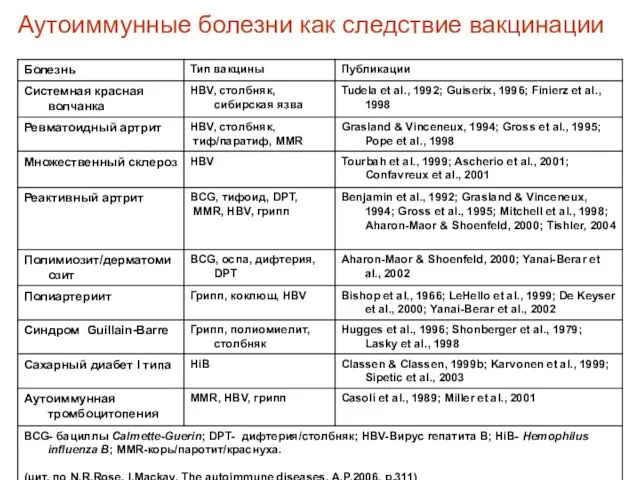
- 64. Аутоиммунные болезни как следствие вакцинации
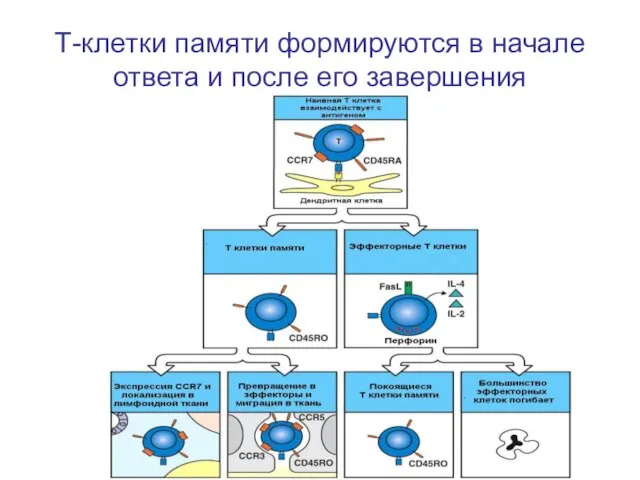
- 65. Т-клетки памяти формируются в начале ответа и после его завершения
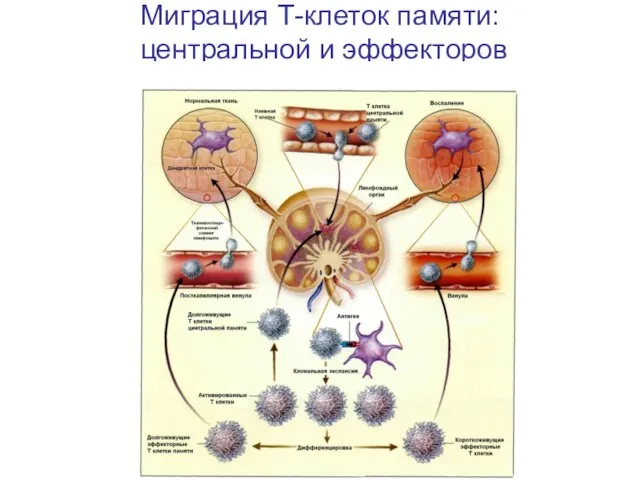
- 67. Миграция Т-клеток памяти: центральной и эффекторов
- 69. Роль Т-клеток памяти в прогрессии или рецидиве аутоиммунных болезней Несколько работ свидетельствует о роли Т-клеток памяти
- 70. Роль Т-клеток памяти в прогрессии или рецидиве аутоиммунных болезней (продолжение) Изолированные T-клетки памяти с фенотипом CD4+CCR4+CD44high
- 71. Роль Т-клеток памяти в прогрессии или рецидиве аутоиммунных болезней (продолжение) Т- клетки памяти имеют повышенную функциональную
- 72. Имеются экспериментальные доказательстива, поддерживающие гипотезу о чрезпеченочной циркуляции кишечных лимфоцитов памяти, возникших при воспалении в слизистой
- 73. Фиброз вокруг желчного протока при склерозирующем холангите
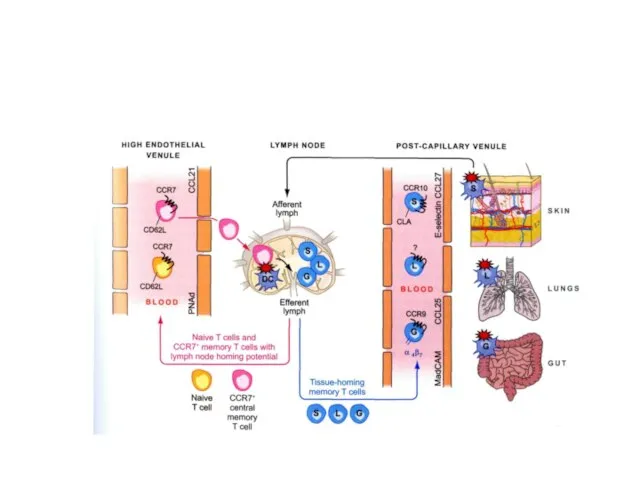
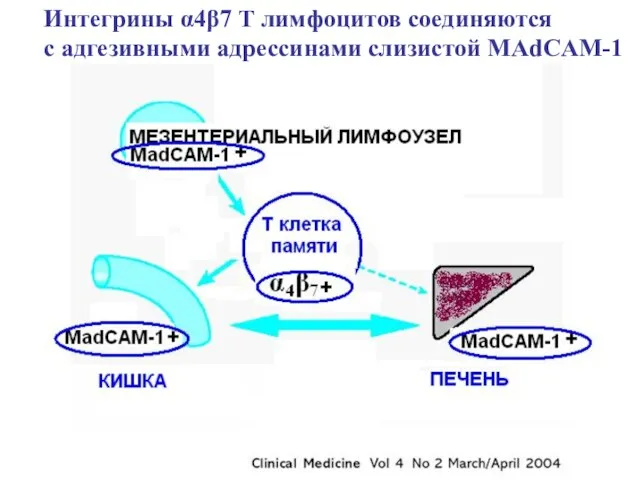
- 74. Интегрины α4β7 Т лимфоцитов соединяются с адгезивными адрессинами слизистой MAdCAM-1
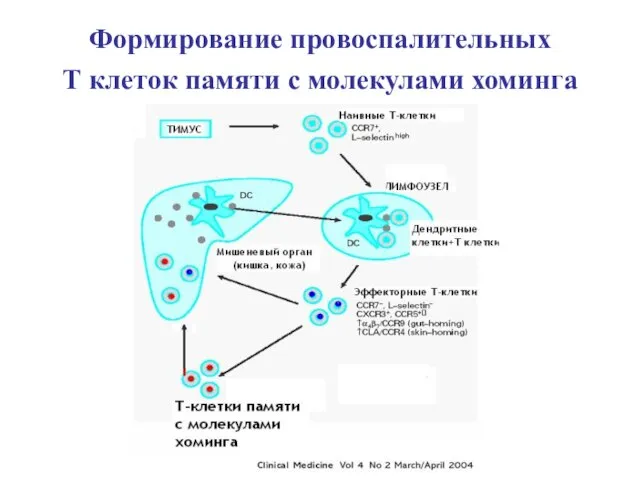
- 75. Формирование провоспалительных Т клеток памяти с молекулами хоминга
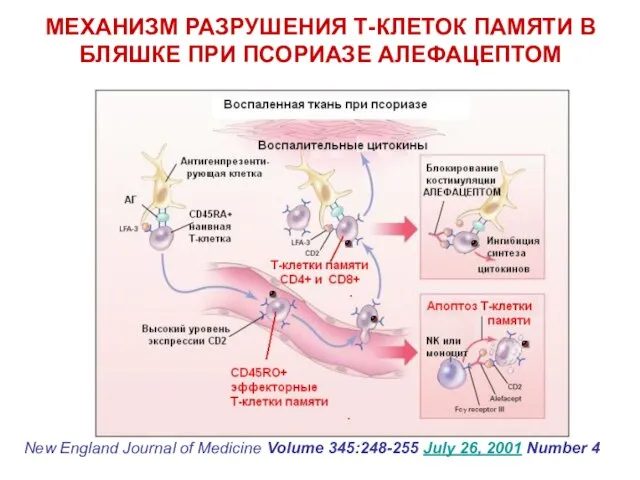
- 76. МЕХАНИЗМ РАЗРУШЕНИЯ Т-КЛЕТОК ПАМЯТИ В БЛЯШКЕ ПРИ ПСОРИАЗЕ АЛЕФАЦЕПТОМ New England Journal of Medicine Volume 345:248-255
- 77. Увидел – расскажи другу!
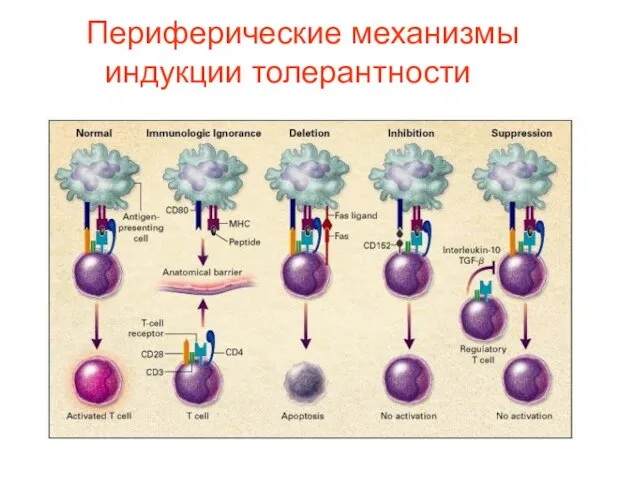
- 78. Peripheral Mechanisms of the Induction of Tolerance. T cells that are physically separated from their specific
- 81. Медицинский Уотергейт-1974 Доктор Вильям Саммерлин был руководителем клиники кожных болезней в Стэнфордском университете в Калифорнии. Результаты
- 83. Скачать презентацию








































 Внутренняя политика Александра I в 1814-25 гг
Внутренняя политика Александра I в 1814-25 гг «Школа – социокультурный и образовательный центр села»
«Школа – социокультурный и образовательный центр села» Тематический семинар
Тематический семинар ООО СоК Малиновка
ООО СоК Малиновка Отчёт о деятельности общеобразовательного учреждения за 2010-2011 учебный год
Отчёт о деятельности общеобразовательного учреждения за 2010-2011 учебный год Стратификация языка. Ярусы языковой системы
Стратификация языка. Ярусы языковой системы Расчёт напряженно-деформированного состояния лопатки компрессора авиационного двигателя
Расчёт напряженно-деформированного состояния лопатки компрессора авиационного двигателя Презентация на тему Разработка обеспечения деятельности Центра игровой поддержки "Тека-Дом" как обогащенной социо-предметной раз
Презентация на тему Разработка обеспечения деятельности Центра игровой поддержки "Тека-Дом" как обогащенной социо-предметной раз Презентация на тему Секреты пластилина. Петушок
Презентация на тему Секреты пластилина. Петушок Презентация на тему Электрическое поле 8 класс
Презентация на тему Электрическое поле 8 класс  Развлечения и отдых в Ноттингеме
Развлечения и отдых в Ноттингеме Особенности общения родителей и детей в эпоху Интернета
Особенности общения родителей и детей в эпоху Интернета Форматирование документа MS Word
Форматирование документа MS Word ПРИМЕРНАЯ ПРОГРАММА общеобразовательной дисциплиныИНФОРМАТИКА И ИКТ для НПО и СПО
ПРИМЕРНАЯ ПРОГРАММА общеобразовательной дисциплиныИНФОРМАТИКА И ИКТ для НПО и СПО Искусство Древней Греции. Гомеровский период
Искусство Древней Греции. Гомеровский период Дизайн. Рисунок
Дизайн. Рисунок Презентация на тему Дорожная азбука
Презентация на тему Дорожная азбука Pegas touristik este un lider in sfera turismului pe piata Rusei
Pegas touristik este un lider in sfera turismului pe piata Rusei Неполная разборка и сборка автомата Калашникова
Неполная разборка и сборка автомата Калашникова Женщины Советского Союза и Германии во время Второй мировой войны
Женщины Советского Союза и Германии во время Второй мировой войны Наши дела 2020
Наши дела 2020 Dead Sea in Danger
Dead Sea in Danger Викторина Наш Акмулла
Викторина Наш Акмулла Времена года в рисунках
Времена года в рисунках Monterra.me Будва, Черногория BUDVA 1 проект Площадь участка 6126м2 Коэффициент застройкиДУП в разработке Разрешённая брутто площадь строен
Monterra.me Будва, Черногория BUDVA 1 проект Площадь участка 6126м2 Коэффициент застройкиДУП в разработке Разрешённая брутто площадь строен Гаметогенез
Гаметогенез Итоги работы системы образования
Итоги работы системы образования Интернет-издание о высоких технологияхwww.cnews.ru
Интернет-издание о высоких технологияхwww.cnews.ru