Содержание
- 2. Содержание Загадочные творения природы Что такое кристалл Общее определение Монокристаллы и кристаллические агрегаты Симметрия в кристаллах
- 3. Загадочные творения природы Кристаллы одни из самых красивых и. В настоящее время изучением многообразия кристаллов занимается
- 4. Что такое кристалл. В школьных учебниках кристаллами обычно называют твердые тела, образующихся в природных или лабораторных
- 5. Кристаллов в природе существует великое множество и так же много существует различных форм кристаллов. В реальности,
- 6. Общее определение Итак, кристаллами называются «все твердые тела, в которых слагающие их частицы (атомы, ионы, молекулы)
- 7. Монокристаллы и кристаллические агрегаты. В отличие от других агрегатных состояний, кристаллическое состояние многообразно. Если взять, например,
- 9. Симметрия в кристаллах Рассматривая различные кристаллы, мы видим, что все они разные по форме, но любой
- 10. Поговорим о видах симметрии в кристалле. Прежде всего, в кристаллах могут быть оси симметрии только 1,
- 11. Категории кристаллов По симметрии, прежде всего по осям симметрии, кристаллы делятся на три категории. К высшей
- 12. Усеченная пирамида У кристаллов средней категории могут быть оси 3, 4 и 6 порядков, но только
- 13. Из кристаллов к высшей категории относятся: алмаз, квасцы, гранаты, германий, кремний, медь, алюминий, золото, серебро, серое
- 14. Каждая грань кристалла представляет собой плоскость, на которой располагаются атомы. Когда кристалл растет, все грани передвигаются
- 15. Исследования ученых в строении кристаллов В течение долгих лет геометрия кристаллов казалась таинственной и неразрешимой загадкой.
- 16. Закон постоянства двухгранных углов. Отклонения от закона. Симметричность кристаллов всегда привлекала внимание ученых. Уже в 79г.
- 17. История открытия закона постоянства углов прошла огромный, почти двухвековой путь, прежде чем этот закон был отчетливо
- 18. Однако по мере совершенствования методики и повышения точности измерения кристаллов выяснилось, что закон постоянства углов оправдывается
- 19. Грани реального кристалла никогда не представляют собой идеальных плоских поверхностей. Нередко они бывают покрыты ямками или
- 20. Необходимо сказать о случаях резкого изменения углов кристаллов, которое возникает при полиморфном превращении вещества (образование данным
- 21. Дефекты в кристаллах Кристалл заполнен дефектами. Как же влияют дефекты на прочность кристаллов. Они понижают прочность,
- 22. Выращивание кристаллов в домашних условиях на примере CuSO4 Основой выращивания кристаллов, как описано в любой литературе,
- 24. I.Приготовление маточного раствора (прямой и обратный способ): Примечание: Многие авторы в своих книгах для простоты указывают
- 25. Прямой способ. Для приготовления маточного раствора требуется чистый, хорошо вымытый термостойкий стакан на 1 л. В
- 26. II. Получение кристалла-затравки: На следующий день осматривают раствор, в нём не должно быть примесей, и если
- 27. Монокристалл выращивают из полученной затравки. Используя суровую нить, плотно на 1-2 раза обвивают затравку, чтобы она
- 28. Рис.15. Выращивание кристаллов меди. 1 – фильтровальная бумага; 2 – водород; 3 – насыщенный при комнатной
- 29. Рис. 17. Кристаллы меди. Когда вы решите вынуть кристаллы, то: сначала магнитом удаляют оставшееся железо; аккуратно
- 32. Скачать презентацию
Слайд 2Содержание
Загадочные творения природы
Что такое кристалл
Общее определение
Монокристаллы и кристаллические агрегаты
Симметрия в кристаллах
Категории кристаллов
Исследования
Содержание
Загадочные творения природы
Что такое кристалл
Общее определение
Монокристаллы и кристаллические агрегаты
Симметрия в кристаллах
Категории кристаллов
Исследования

Закон постоянства двугранных углов. Отклонение от закона
Дефекты в кристаллах
Выращивание кристаллов в домашних условиях
Слайд 3Загадочные творения природы
Кристаллы одни из самых красивых и. В настоящее время изучением
Загадочные творения природы
Кристаллы одни из самых красивых и. В настоящее время изучением

В давние времена считалось, что кристаллы представляют собой редкость. Действительно, нахождение в природе крупных однородных кристаллов - явление нечастое. Но мелкокристаллические вещества встречаются весьма часто. Так, например, почти все горные породы: гранит, песчаники известняк - кристалличны.
В настоящее время известны способы искусственного выращивания кристаллов. Кристалл можно вырастить в обыкновенном стакане, для этого требуется лишь определенный раствор и аккуратность, с которой необходимо ухаживать за растущим кристаллом.
аметист
малахит
Слайд 4 Что такое кристалл.
В школьных учебниках кристаллами обычно называют твердые тела,
Что такое кристалл.
В школьных учебниках кристаллами обычно называют твердые тела,

природный лунный камень
Слайд 5Кристаллов в природе существует великое множество и так же много существует различных
Кристаллов в природе существует великое множество и так же много существует различных

Во всех без исключения кристаллических постройках из атомов можно выделить множество одинаковых атомов, расположенных наподобие узлов пространственной решетки. Чтобы представить такую решетку, мысленно заполним пространство множеством равных параллелепипедов, параллельно ориентированных и соприкасающихся по целым граням. Простейший пример такой постройки представляет собой кладка из одинаковых кирпичиков. Если внутри кирпичиков выделить соответственные точки, например, их центры или вершины, то мы и получим модель пространственной решетки.
Слайд 6Общее определение
Итак, кристаллами называются «все твердые тела, в которых слагающие их частицы
Общее определение
Итак, кристаллами называются «все твердые тела, в которых слагающие их частицы

кристалл турмалина-рубеллита
Слайд 7 Монокристаллы и кристаллические агрегаты.
В отличие от других агрегатных состояний, кристаллическое
Монокристаллы и кристаллические агрегаты.
В отличие от других агрегатных состояний, кристаллическое

Если взять, например, обычную поваренную соль, то легко увидеть даже без микроскопа отдельные кристаллики. Каждый кристаллик есть вещество NaCl, но одновременно он имеет черты индивидуума. Он может быть большим или малым кубическим или прямоугольно-параллелепипедальным, по-разному ограненным и т.д.
Если мы хотим подчеркнуть, что имеем дело с одиночным, отдельным кристаллом, то называем его монокристаллом, чтобы подчеркнуть, что речь идет о скоплении многих кристаллов, используется термин кристаллический агрегат.
Слайд 9 Симметрия в кристаллах
Рассматривая различные кристаллы, мы видим, что все они
Симметрия в кристаллах
Рассматривая различные кристаллы, мы видим, что все они

Все кристаллы симметричны. Это значит, что в каждом кристаллическом многограннике можно найти плоскости симметрии, оси симметрии, центры симметрии и другие элементы симметрии так, чтобы совместились друг с другом одинаковые части многогранника. Введем еще одно понятие относящееся к симметрии - полярность. Представим конус и цилиндр, у обоих объектов есть по одной оси симметрии бесконечного порядка, но они различаются полярностью, у конуса ось полярна (представим центральную ось в виде стрелочки, указывающей к вершине), а у цилиндра ось неполярна.
Слайд 10 Поговорим о видах симметрии в кристалле. Прежде всего, в кристаллах могут
Поговорим о видах симметрии в кристалле. Прежде всего, в кристаллах могут

Слайд 11Категории кристаллов
По симметрии, прежде всего по осям симметрии, кристаллы делятся на три
Категории кристаллов
По симметрии, прежде всего по осям симметрии, кристаллы делятся на три

октаэдр
куб
Слайд 12Усеченная пирамида
У кристаллов средней категории могут быть оси 3, 4 и 6
Усеченная пирамида
У кристаллов средней категории могут быть оси 3, 4 и 6

Усеченная пирамида
призма
У кристаллов низшей категории не может быть ни одной оси симметрии 3,4 и 6 порядков, могут быть только оси 2 порядка, плоскости или центр симметрии. Структура данных кристаллов самая сложная.
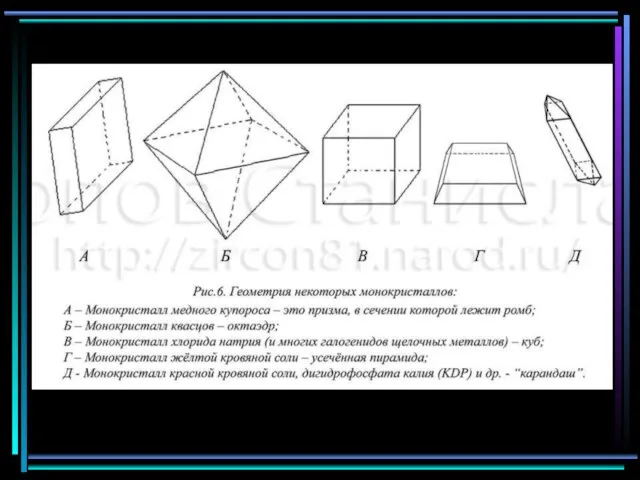
Слайд 13Из кристаллов к высшей категории относятся: алмаз, квасцы, гранаты, германий, кремний, медь,
Из кристаллов к высшей категории относятся: алмаз, квасцы, гранаты, германий, кремний, медь,

к средней категории – графит, рубин, кварц, цинк, магний, белое олово, турмалин, берилл;
к низшей – гипс, слюда, медный купорос, сегнетовая соль и др.
кварц
Медный купорос
Слайд 14 Каждая грань кристалла представляет собой плоскость, на которой располагаются атомы. Когда
Каждая грань кристалла представляет собой плоскость, на которой располагаются атомы. Когда

Слайд 15Исследования ученых в строении кристаллов
В течение долгих лет геометрия кристаллов казалась
Исследования ученых в строении кристаллов
В течение долгих лет геометрия кристаллов казалась

Слайд 16Закон постоянства двухгранных углов. Отклонения от закона.
Симметричность кристаллов всегда привлекала внимание
Закон постоянства двухгранных углов. Отклонения от закона.
Симметричность кристаллов всегда привлекала внимание

Слайд 17История открытия закона постоянства углов прошла огромный, почти двухвековой путь, прежде чем
История открытия закона постоянства углов прошла огромный, почти двухвековой путь, прежде чем

Так, например, И.Кеплер уже в 1615г. указывал на сохранение углов в 60о между отдельными лучиками у снежинок. В 1669 г. Н. Стенон открыл закон постоянства углов в кристаллах кварца и гематита. Внимательно разглядывая реальные кристаллы кварца, Стенон также обратил внимание на их отклонение от идеальных геометрических многогранников с плоскими гранями и прямыми ребрами. Годом позже Стенона Э. Бартолин сделал тот же вывод применительно кристаллам кальцита, а в 1695 г. Левенгук - к кристаллам гипса. Он показал, что и у микроскопически малых и у больших кристаллов гипса углы между соответственными гранями одинаковы. В России закон постоянства углов был отрыт М. В. Ломоносовым для кристаллов селитры (1749г.) пирита, алмаза и некоторых других минералов.
Версии Лиля закон постоянства углов звучит следующим образом: "Грани кристалла могут изменяться по своей форме и относительным размерам, но их взаимные наклоны постоянны и неизменны для каждого рода кристаллов."
Слайд 18Однако по мере совершенствования методики и повышения точности измерения кристаллов выяснилось, что
Однако по мере совершенствования методики и повышения точности измерения кристаллов выяснилось, что

Слайд 19Грани реального кристалла никогда не представляют собой идеальных плоских поверхностей. Нередко они
Грани реального кристалла никогда не представляют собой идеальных плоских поверхностей. Нередко они

Таким образом, можно говорить о скульптуре граней, являющейся причиной отклонения от равенства двугранных углов. Изучением различных наростов занимается раздел кристаллографии - Морфология внешней формы кристаллов.
Наблюдаются, конечно, и более закономерные изменения двугранных углов, например зависимость от температуры.
Слайд 20Необходимо сказать о случаях резкого изменения углов кристаллов, которое возникает при полиморфном
Необходимо сказать о случаях резкого изменения углов кристаллов, которое возникает при полиморфном

Учитывая все вышесказанное, можно так сформулировать закон постоянства углов: «Во всех кристаллах, принадлежащих к одной полиморфной модификации данного вещества, при одинаковых условиях углы между соответствующими гранями (и ребрами) постоянны».
Слайд 21Дефекты в кристаллах
Кристалл заполнен дефектами. Как же влияют дефекты на прочность кристаллов.
Дефекты в кристаллах
Кристалл заполнен дефектами. Как же влияют дефекты на прочность кристаллов.

Но, по мере того, как растет деформация кристалла, растет и число дефектов в нем. А так как дефекты взаимодействуют друг с другом, то, чем их больше, тем труднее им двигаться в кристалле.
Получается парадокс: если есть дефект кристалл - кристалл деформируется и разрушается легче, чем, если дефекта нет. А если дефектов слишком много, то кристалл опять становится прочным, и чем больше дефектов, тем он более упорядочивается. Значит, если мы научимся управлять числом и расположением дефектов, мы сможем управлять прочностью материалов.
Слайд 22Выращивание кристаллов в домашних условиях на примере CuSO4
Основой выращивания кристаллов, как описано
Выращивание кристаллов в домашних условиях на примере CuSO4
Основой выращивания кристаллов, как описано

Начинающему экспериментатору рекомендую начать опыт, используя в качестве исходного материала для получения кристаллов: медный купорос, гидрофталат калия, красную кровяную соль, бихромат или хромат калия, алюмокалиевые квасцы (ещё часто в литературе советуют хлорид натрия, но растить его крупные правильные кристаллы труднее
В каждой методике выращивания можно выделить несколько подпунктов:
- приготовление маточного раствора;
- получение кристалла-затравки;
- выращивание монокристалла.
Слайд 24I.Приготовление маточного раствора (прямой и обратный способ):
Примечание: Многие авторы в своих
I.Приготовление маточного раствора (прямой и обратный способ):
Примечание: Многие авторы в своих

Так иодид калия KI может вырасти из 50 мл концентрированного (но ненасыщенного) раствора, который находился в открытой аптекарской бутылочке, его рост – чистая случайность: вода испарялась, и кристалл рос. Как видите, для малых количеств методика сохраняется, но меняются объёмы посуды и растворителя.
Самое важное условие: для выращивания кристаллов используют только свежеприготовленные растворы!!!
Слайд 25Прямой способ.
Для приготовления маточного раствора требуется чистый, хорошо вымытый термостойкий стакан
Прямой способ.
Для приготовления маточного раствора требуется чистый, хорошо вымытый термостойкий стакан

Чтобы в раствор не попала пыль, его накрывают листом фильтровальной бумаги и оставляют в той части помещения, где сохраняется постоянная температура, где в дальнейшем Вы будете продолжать опыт.
Помните: чтобы кристаллы росли как можно правильно, кристаллизация должна идти медленно, на бесцветных веществах, чьи кристаллы должны быть прозрачны как стекло, скорость роста проявляется заметнее – при быстром росте кристаллы мутнеют!!!
Возможен и обратный способ приготовления насыщенного раствора. Вы максимально растворяете вещество при комнатной температуре, и когда растворение достигнет предела (вещество будет оставаться на дне), добавляете ещё 1-2 порции и греете сосуд с раствором на плите до t=50-60оС. Условие этого способа – используемая посуда должна быть термостойкой, а конфорка плиты ровной, это может создать неудобство при нагревании объёмов, например, в 1 л.
Слайд 26II. Получение кристалла-затравки:
На следующий день осматривают раствор, в нём не должно быть
II. Получение кристалла-затравки:
На следующий день осматривают раствор, в нём не должно быть

Готовый очищенный раствор аккуратно сливают с осадка кристаллов и в количестве 1л помещают в термостойкую круглодонную колбу. Туда же помещают 1 чайную ложку (с горкой) химически чистого вещества (это могут быть те же выпавшие кристаллы). Теперь колбу нагревают на водяной бане, добиваясь полного растворения. Полученный раствор греют ещё 5 мин на водяной бане при температуре не выше 60-70оС, после чего его переливают в чистый, подогретый до температуры раствора термостойкий стакан (можно ополоснуть кипятком). Стакан обворачивают плотно сухим полотенцем, накрывают фильтровальной бумагой и оставляют остывать. Сейчас раствор надо беречь от сквозняков, от резких перепадов температур.
Резкий перепад температур, как и резкое перемешивание остывшего раствора, могут вызвать преждевременную кристаллизацию, но кристаллы при этом получатся мелкие и бесформенные, они плотно осядут на стенках раствора и нагревание придётся повторять снова.
Спустя сутки, убирают полотенце, не стараясь колыхать стакан, чтобы не вызвать незапланированную кристаллизацию. Осматривают содержимое – на дне и на стенках должны образоваться небольшие плоские синие кристаллики-параллелограммы.
Помните: чем меньше выбранная вами затравка, чем она правильнее, тем легче раствору (системе) подстроиться под неё .
Слайд 27Монокристалл выращивают из полученной затравки. Используя суровую нить, плотно на 1-2 раза
Монокристалл выращивают из полученной затравки. Используя суровую нить, плотно на 1-2 раза

Второй конец нити можно примотать к крестовине из деревянных или пластиковых палочек, чья длина больше диаметра стакана.
Снова готовят насыщенный раствор на основе исходного маточного. Для этого готовый раствор ставят на водяную баню и добавляют 0,5 чайной ложки вещества (иногда меньше). Чем меньше Вы добавите его на этом этапе, тем лучше (можно также просто нагреть насыщенный раствор, без добавления вещества). Греют и перемешивают. Как только вещество растворилось, колбу вынимают, и раствор переливают в заранее приготовленный нагретый стакан. Стакан с раствором ставят на выбранное место, и дают 20-30 секунд постоять, чтобы жидкость немного успокоилась. Наш раствор непересыщенный, поэтому «лишние градусы» могут вызвать растворение затравки, что нам не нужно. Если раствор тёплый, ему дают остыть до 30оC или чуть меньше.
Затем затравку располагают в тёплом растворе (температура на 5-7оС выше комнатной) таким образом, чтобы кристаллик как бы висел в нём, на высоте1/2 или 3/5 от дна. Поместив затравку в раствор, понаблюдайте на просвет не оплывают ли грани у Вашей затравки, не создаются ли вокруг неё волнообразные завихрения. Если да – раствор ещё тёплый для затравки, такое бывает с хорошо растворимыми в воде веществами, надо затравку вынимать и подождать ещё.
Когда, наконец, разместили – всё, осталось только ждать, при этом стакан вертеть, наклонять, перемешивать раствор не рекомендуется.
Следует сказать, что можно вырастить кристалл и без нити. Для этого требуется широкий стакан с плоским дном, так как для этой цели затравку аккуратно укладывают на середину дна.
Теперь следует следить за ростом кристалла каждый день, ни в коем случае не поднимая, не поворачивая и не сотрясая стакан с раствором, иначе эта встряска породит в системе незапланированную, иногда мгновенную кристаллизацию
Слайд 28Рис.15. Выращивание кристаллов меди.
1 – фильтровальная бумага;
2 – водород;
3 – насыщенный при
Рис.15. Выращивание кристаллов меди.
1 – фильтровальная бумага;
2 – водород;
3 – насыщенный при

4 – слой из железных предметов;
5 – слой хлорида натрия NaCl;
6 – пузырьки воздуха, которые следует удалить;
7 – слой медного купороса CuSO4∙5H2O;
Слайд 29Рис. 17. Кристаллы меди.
Когда вы решите вынуть кристаллы, то:
сначала магнитом удаляют оставшееся
Рис. 17. Кристаллы меди.
Когда вы решите вынуть кристаллы, то:
сначала магнитом удаляют оставшееся

аккуратно сливают раствор;
пинцетом удаляют остатки фильтра;
пинцетом и пластмассовой ложкой выгребают слой хлорида натрия и кристаллы меди в чистый, заранее приготовленный стакан;


 Династия Романовых
Династия Романовых Зачем нужна людям письменность?
Зачем нужна людям письменность? Трение в нашей жизни
Трение в нашей жизни Социально-психологические аспекты социализации лиц с ограниченными возможностями здоровья (ОВЗ)
Социально-психологические аспекты социализации лиц с ограниченными возможностями здоровья (ОВЗ) Лекция 1
Лекция 1 Профессии типа «Человек – Природа»
Профессии типа «Человек – Природа» ВЫБОРЫ ПРЕЗИДЕНТА ШКОЛЫ
ВЫБОРЫ ПРЕЗИДЕНТА ШКОЛЫ Презентация на тему Экономика в новых условиях (9 класс)
Презентация на тему Экономика в новых условиях (9 класс) Портрет идеального клиента
Портрет идеального клиента Викторина по ПДД 1 класс
Викторина по ПДД 1 класс Аукцион объектов недвижимости
Аукцион объектов недвижимости Радиоактивность как свидетельство сложного строения атомов
Радиоактивность как свидетельство сложного строения атомов Моделирование
Моделирование Инвестиционный профиль Калужской области
Инвестиционный профиль Калужской области Летняя монотипия
Летняя монотипия презентация обж
презентация обж Благотворительная программа «Подарим детям сказку»
Благотворительная программа «Подарим детям сказку» Русские национальные виды спорта и игры
Русские национальные виды спорта и игры Зимние Олимпийские игры.
Зимние Олимпийские игры. Мотивационный спектр современной рекламы
Мотивационный спектр современной рекламы жизнь и творчество шолохова
жизнь и творчество шолохова Презентация на тему Зимние Олимпийские игры
Презентация на тему Зимние Олимпийские игры  Отряд Непарнокопытные
Отряд Непарнокопытные Стандарты оказания услуг салона красоты Beauty house
Стандарты оказания услуг салона красоты Beauty house Nobel_Prize_Winners_RAS
Nobel_Prize_Winners_RAS Проект СОРОЧИНСКАЯ ЯРМАРКА200-ЛЕТИЮ Н.В. ГОГОЛЯПОСВЯЩАЕТСЯ
Проект СОРОЧИНСКАЯ ЯРМАРКА200-ЛЕТИЮ Н.В. ГОГОЛЯПОСВЯЩАЕТСЯ VIII общешкольная конференция «Учись учиться»
VIII общешкольная конференция «Учись учиться» Предотвращение компьютерной преступности
Предотвращение компьютерной преступности