Содержание
- 2. Содержание Эволюция взглядов на строение вещества. Основные понятия и определения молекулярно-кинетической теории : Молекулярная физика Макроскопические
- 3. Еще задолго до нашей эры, в период расцвета древних культур, возникло учение о мельчайших частицах, из
- 4. Древнегреческие философы Анаксагор и Демокрит (в IV веке до нашей эры) считали, что любое вещество состоит
- 5. Взаимодействуют атомы давлением и ударом. Воззрения Демокрита, весьма далекие от современных, сыграли очень важную роль в
- 6. Атомисты считали, что разнообразие веществ, имеющихся в природе, объясняется не разнообразием различных сортов атомов, но разнообразием
- 7. Эпоха средневековья не продвинула вперед учение об атомах и молекулах. В XVII столетии, когда были заложены
- 8. Этим вращательным движением Ломоносов объяснил тепловые явления. Он утверждал, что «должна существовать наибольшая степень холода, состоящая
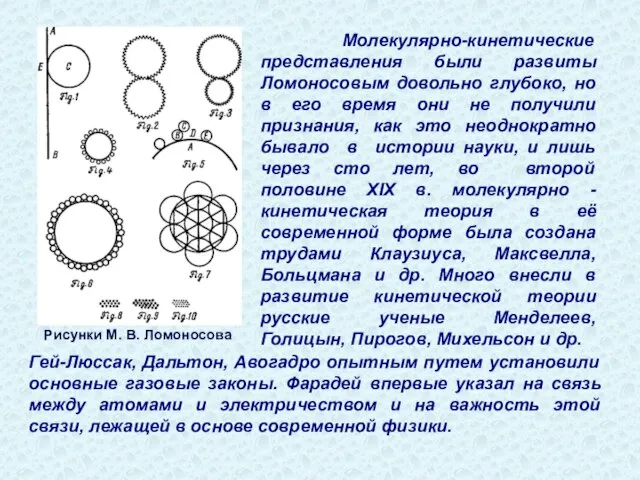
- 9. Рисунки М. В. Ломоносова Молекулярно-кинетические представления были развиты Ломоносовым довольно глубоко, но в его время они
- 10. Свойства вещества, которые обусловлены его молекулярным строением, изучает Молекулярная физика – раздел физики, в котором рассматриваются
- 11. Цель молекулярно-кинетической теории – объяснение свойств макроскопических тел и закономерностей тепловых процессов на основе представлений о
- 12. Макроскопические тела (от греч. «макрос» – большой) - это все тела, которые нас окружают: дома, машины,
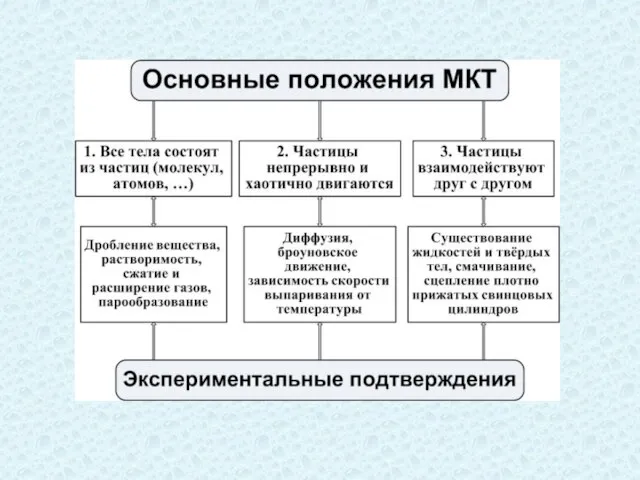
- 13. Все вещества состоят из молекул и атомов. Молекула – наименьшая электронейтральная частица вещества, сохраняющая его свойства.
- 15. Каждое из положений МКТ строго доказано исследовательским путём. Реальное существование молекул подтверждается экспериментально. В качестве примеров
- 16. Платина в электронном микроскопе Молекулы нафталина в ионном микроскопе Изображение предварительно отполированной, а затем подвергнутой ионной
- 17. Сканирующий электронно-ионный микроскоп. Ионный микроскоп JEM-ARM200F Рассказ про ионный микроскоп здесь Ионный микроскоп - электронно-оптический прибор,
- 18. Ионный микроскоп
- 19. Наиболее убедительными доказательствами реального существования молекул являются броуновское движение и диффузия. БРОУНОВСКОЕ ДВИЖЕНИЕ
- 20. Это явление открыто Р. Броуном в 1827 г., когда он проводил исследования пыльцы растений. Шотландский ботаник
- 21. Последовательные положения через каждые 30 секунд трех броуновских частиц – шариков гуммигута размером около 1 мкм.
- 22. Объяснить броуновское движение невозможно, если не предположить, что молекулы воды находятся в беспорядочном, никогда не прекращающемся
- 23. Броуновское движение
- 24. Диффузия Для наблюдения явления диффузии бросим несколько крупинок краски в высокий сосуд с водой. Они опустятся
- 25. Существование жидкостей и твёрдых тел, газов Агрегатное состояние — состояние вещества, характеризующееся определёнными качественными свойствами, например,
- 26. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния
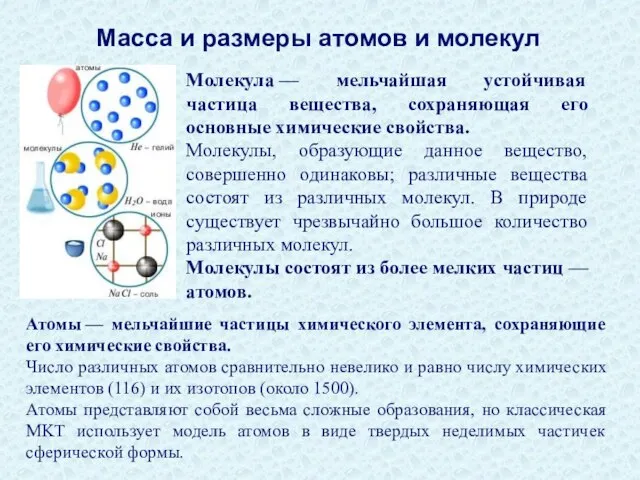
- 27. Молекула — мельчайшая устойчивая частица вещества, сохраняющая его основные химические свойства. Молекулы, образующие данное вещество, совершенно
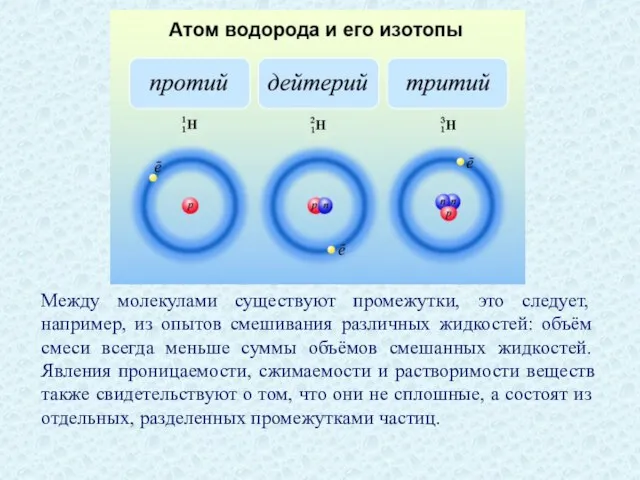
- 28. Между молекулами существуют промежутки, это следует, например, из опытов смешивания различных жидкостей: объём смеси всегда меньше
- 29. Несколько интересных фактов: ... разведя 1 мл чернил в 1 л воды, а затем 1 мл
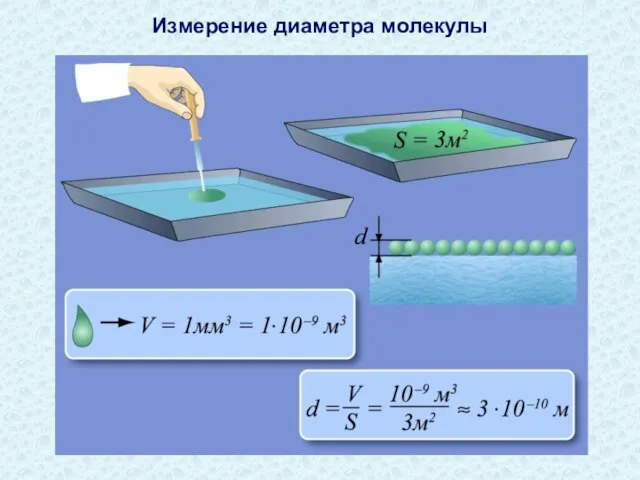
- 30. Измерение диаметра молекулы
- 31. Размеры молекул и атомов чрезвычайно малы. Так, линейные размеры молекул кислорода составляют 3∙10-10 м, воды –
- 32. Немного истории Понятие атомной массы ввёл Джон Дальтон в 1803 году, единицей измерения атомной массы сначала
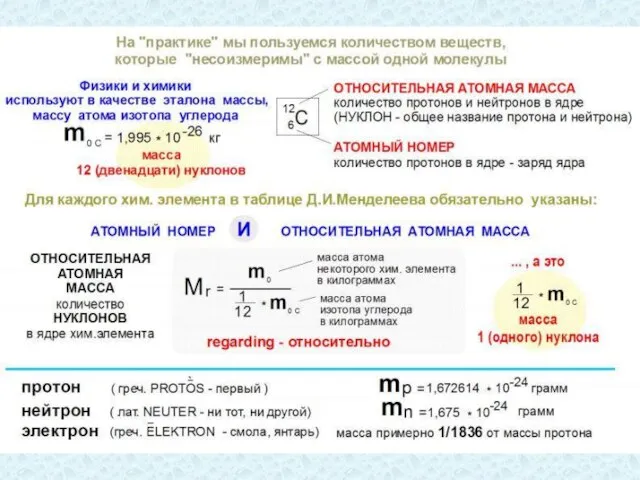
- 33. Масса нейтрона mn = 1,674929∙10-27 кг масса протона mp = 1,672623∙10-27 кг В ядре атома углерода
- 34. Масса произвольного атома может быть выражена в атомных единицах массы или в килограммах: Относительная атомная масса
- 35. Количеством вещества ν называется физическая величина, определяющая число молекул (или атомов, ионов) в данном теле. Количество
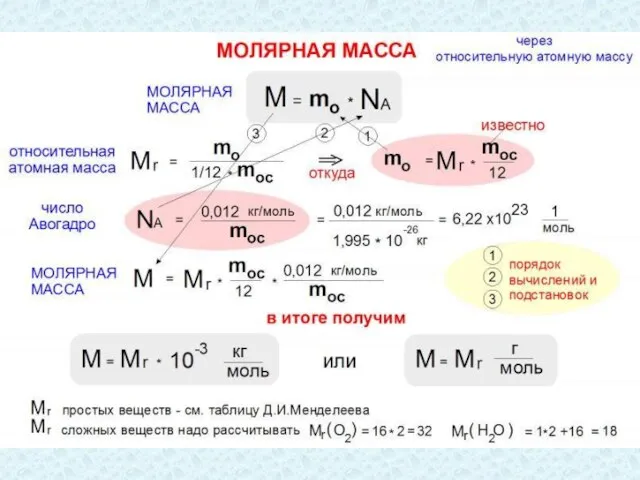
- 36. Молярная масса Масса вещества m связана с его молярной массой M и количеством вещества ν формулой
- 37. Постоянная Авогадро Амедео Авогадро Итальянский физик и химик 9 августа 1776 г. – 9 июля 1856
- 45. Скачать презентацию



































 Тема урока: Треугольники. Центр тяжести. Тип урока: Интегрированный урок физики и математики с применением информационных техн
Тема урока: Треугольники. Центр тяжести. Тип урока: Интегрированный урок физики и математики с применением информационных техн Кактус из бумаги
Кактус из бумаги Закрепление пройденного. Права человека
Закрепление пройденного. Права человека Анализ деятельности кредитной организации
Анализ деятельности кредитной организации  Технология изготовления и организация производства сварной конструкции Опора для вентиляционных конструкций
Технология изготовления и организация производства сварной конструкции Опора для вентиляционных конструкций Презентация на тему Безопасность Огонь Вода Газ
Презентация на тему Безопасность Огонь Вода Газ В землянке
В землянке Слоаврь
Слоаврь Муниципальное дошкольное образовательное учреждение«Детский сад компенсирующего вида № 7»
Муниципальное дошкольное образовательное учреждение«Детский сад компенсирующего вида № 7» Процессы памяти и их нарушения при нервно-психических заболеваниях
Процессы памяти и их нарушения при нервно-психических заболеваниях Education jobs
Education jobs Результаты муниципального этапа Всероссийской олимпиады школьников по учебным предметам в 2010 году
Результаты муниципального этапа Всероссийской олимпиады школьников по учебным предметам в 2010 году BUSINESS JET TRAVEL
BUSINESS JET TRAVEL Алгебра.8 класс Решение квадратных уравнений по формуле.
Алгебра.8 класс Решение квадратных уравнений по формуле. Опыт организации работы команды разработчиков на основе Rational ClearQuest. Тонкая настройка.
Опыт организации работы команды разработчиков на основе Rational ClearQuest. Тонкая настройка. Презентация на тему Голосеменные Классификация
Презентация на тему Голосеменные Классификация Энергетическая стратегия России до 2030 года: переход к инновационной энергетике будущего
Энергетическая стратегия России до 2030 года: переход к инновационной энергетике будущего Технологии решения проблем ЭМС на электросетевых объектах
Технологии решения проблем ЭМС на электросетевых объектах Место и время счастья
Место и время счастья Презентация на тему АНАТОМИЯ ОРГАНА ЗРЕНИЯ
Презентация на тему АНАТОМИЯ ОРГАНА ЗРЕНИЯ  Работа по стимулированию юридических лиц и индивидуальных предпринимателей к трудоустройству безработных
Работа по стимулированию юридических лиц и индивидуальных предпринимателей к трудоустройству безработных Виртуальное путешествие Как встречают Новый год люди всех земных широт
Виртуальное путешествие Как встречают Новый год люди всех земных широт Презентация на тему Пищеварительная система
Презентация на тему Пищеварительная система  рекомендации по подготовке мультимедийной ПРЕЗЕНТАЦИИ
рекомендации по подготовке мультимедийной ПРЕЗЕНТАЦИИ Самолет президента спешит на помощь
Самолет президента спешит на помощь Греко-римская борьба. Тестирование физической подготовленности в ИВС
Греко-римская борьба. Тестирование физической подготовленности в ИВС Презентация на тему Шаблоны написания сочинений ОГЭ
Презентация на тему Шаблоны написания сочинений ОГЭ  Анализ инвестиционных процессов
Анализ инвестиционных процессов