Слайд 2«Кислород – это самый распространенный на нашей планете элемент. Он рождает теплоту

человеческого дыхания и обжигающее пламя пожара»
Слайд 3
Цели урок
актуализировать знания у о положении элемента кислорода в ПСХЭ Д.И. Менделеева;
познакомить с

историей открытия кислорода;
дать понятие о кислороде как о химическом элементе и простом веществе: нахождение в природе, химические свойства кислорода; применение кислорода.
актуализировать понятия: горение и медленное окисление;
дать понятие о способах получения кислорода
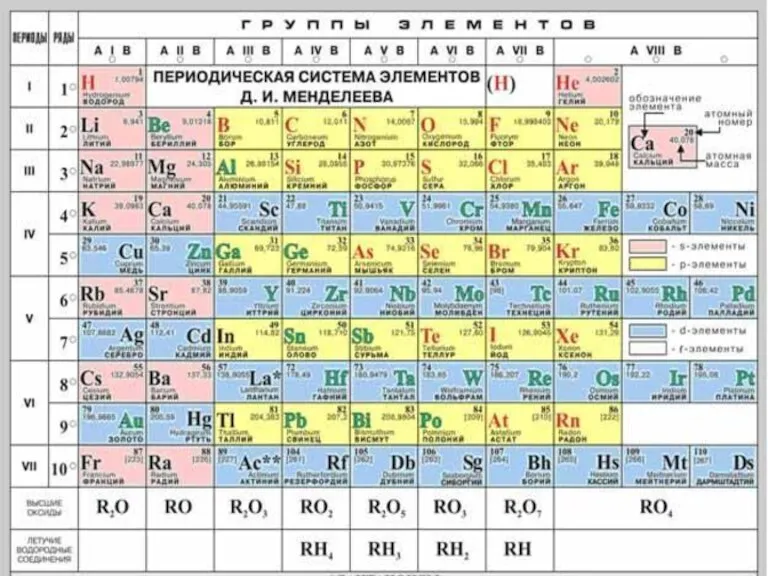
Слайд 5Кислород как химический элемент:
1. Кислород находится в VI группе, главной подгруппе, II

периоде, порядковый номер №8, Ar = 16.
2. Строение атома:
+8О ) ) 1S2S2 2P4
2 6
валентность II, степень окисления -2
(редко +2; +1; -1).
3. Входит в состав оксидов, оснований, солей, кислот, органических веществ, в том числе живых организмов. (Примеры?)
Слайд 6Кислород как элемент (продолжение).
4. В земной коре его 49% по массе, в

гидросфере – 89% по массе.
5. В составе воздуха (в виде простого вещества) – 20-21% по объёму.
Состав воздуха:
О2 – 20-21 %; N2 – 78%; CO2 – 0,03%,
остальное приходится на инертные газы, пары воды, примеси.
Слайд 7Открытие:
Интересным фактом является то, что впервые кислород выделили не химики. Это

сделал изобретатель подводной лодки К. Дреббель в начале XVII в. Этот газ он использовал для дыхания в лодке, при погружениив воду. Но работы изобретателя были засекречены.
Слайд 8 Открыт же был кислород практически одновременно, независимо друг от друга, великими

химиками XVIII века шведом Карлом Вильгельмом Шееле и англичанином Джозефом Пристли.
Слайд 9Физические свойства
Газ без цвета, без запаха, без вкуса, малорастворим в воде
(в 1

литре воды при 20 С растворяется 31 мл кислорода).
При -183 С и давлении 760 мм. рт. столба кислород переходит в голубую жидкость.
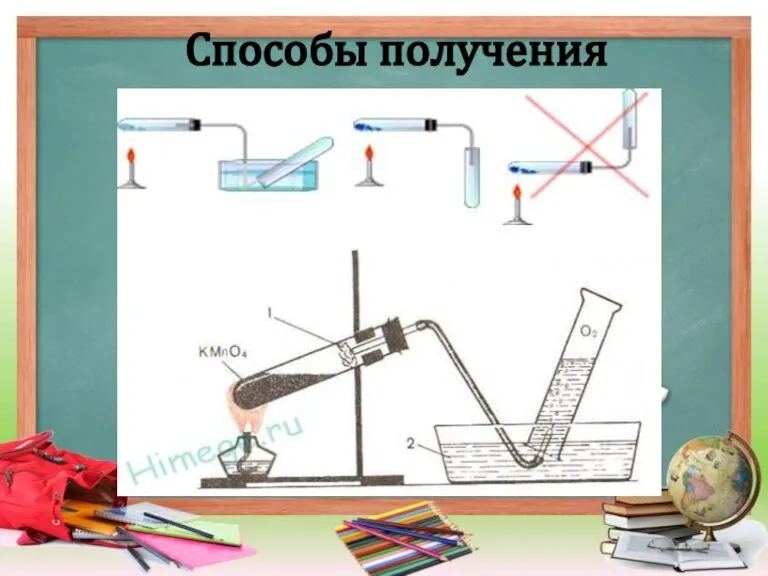
Слайд 10Получение кислорода в лаборатории проводится несколькими способами:
1. С помощью реакции разложения

бертолетовой соли (хлората калия).
2. Через разложение перекиси водорода при нагревании ее в присутствии оксида марганца, выступающего в роли катализатора.
3. Через разложение перманганата калия
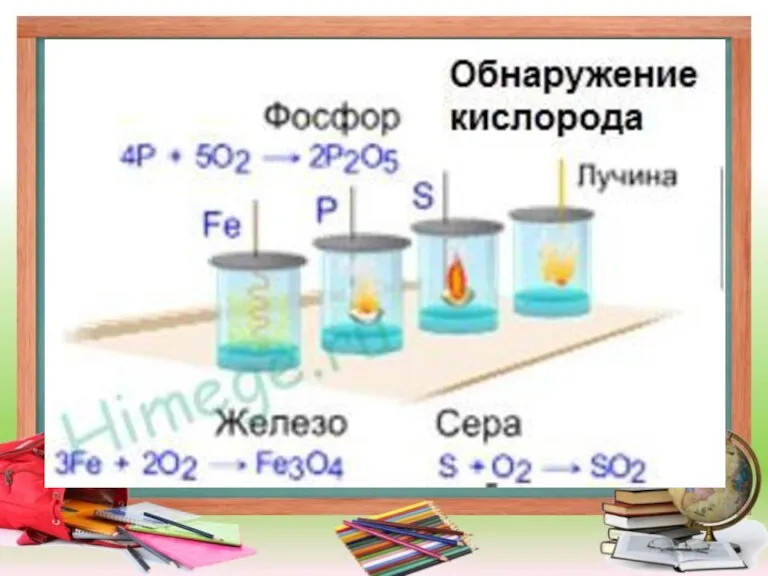
Слайд 12Химические свойства
Взаимодействие веществ с кислородом называется окислением.
С кислородом реагируют все элементы, кроме

Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель.
Слайд 15Разгадайте кроссворд:
Процесс взаимодействия простых и сложных веществ с кислородом.
Английский ученый открывший кислород.
Вещество

поддерживающее горение.
Тип реакции 2H2O —> 2H2+O2.
Вещества, получающиеся при горении.
Процесс сопровождающийся выделением тепла.
Тип реакции горения серы.
Самое распространенное вещество содержащее кислород.










 ОСЕНЬ - чудесная пора
ОСЕНЬ - чудесная пора NORMATIVE MATERIALS
NORMATIVE MATERIALS Фондовый рынок
Фондовый рынок Наши клиенты
Наши клиенты Корпоративная Программа «Северстали» «Дорога к дому»
Корпоративная Программа «Северстали» «Дорога к дому» Презентация на тему Мерзлотная Россия - Восточная и Северо-Восточная Сибирь
Презентация на тему Мерзлотная Россия - Восточная и Северо-Восточная Сибирь Презентация на тему КНЯЗЬ ИГОРЬ
Презентация на тему КНЯЗЬ ИГОРЬ  Экспертная компания в области бизнес консалтинга и управления проектами
Экспертная компания в области бизнес консалтинга и управления проектами ПОВЫШЕНИЕ ЭФФЕКТИВНОСТИ УЧЕТНОЙ ДЕЯТЕЛЬНОСТИ ИНВЕСТИЦИОННОЙ КОМПАНИИ С ИСПОЛЬЗОВАНИЕМ СИСТЕМЫ FINBRIDGE BACKOFFICE
ПОВЫШЕНИЕ ЭФФЕКТИВНОСТИ УЧЕТНОЙ ДЕЯТЕЛЬНОСТИ ИНВЕСТИЦИОННОЙ КОМПАНИИ С ИСПОЛЬЗОВАНИЕМ СИСТЕМЫ FINBRIDGE BACKOFFICE Особенности установки и настройки USB модема MF180.
Особенности установки и настройки USB модема MF180. Проект по теме “Категория соборности” Учитель-консультант Граблина Нина Васильевна
Проект по теме “Категория соборности” Учитель-консультант Граблина Нина Васильевна  Тест. Виды и жанры изобразительного искусства
Тест. Виды и жанры изобразительного искусства Рукотворная сказка
Рукотворная сказка Единый Биржевой Счёт
Единый Биржевой Счёт Сочетание реалистического и мистического в повести Н.В.Гоголя «Вий»
Сочетание реалистического и мистического в повести Н.В.Гоголя «Вий» Some taboos in English
Some taboos in English Лист. Строение и функции
Лист. Строение и функции Закаливание зимой Простудные заболевания
Закаливание зимой Простудные заболевания Повышенная государственная академическая стипендия (ПГАС)
Повышенная государственная академическая стипендия (ПГАС) Кабатлау дәресе. 4 класс
Кабатлау дәресе. 4 класс Успей купить до 28 июня 1100 руб
Успей купить до 28 июня 1100 руб Организационные преобразования в ИТ-департаменте
Организационные преобразования в ИТ-департаменте Пословицы и поговорки о…
Пословицы и поговорки о… Портрет Натюрморт Пейзаж Описание
Портрет Натюрморт Пейзаж Описание Машиностроительный комплекс
Машиностроительный комплекс Правильное питание
Правильное питание Презентация
Презентация КЛАСС ПАУКООБРАЗНЫЕ – ХЕЛИЦЕРОВЫЕ. Особенности строения и жизнедеятельности
КЛАСС ПАУКООБРАЗНЫЕ – ХЕЛИЦЕРОВЫЕ. Особенности строения и жизнедеятельности