Мониторинг неблагоприятных проявлений после иммунизации в соответствии с современными нормативными требованиями
Содержание
- 2. Нормативная база осуществления мониторинга за НППИ в Украине Закон Украины «О лекарственных средствах» 1996 г. (с
- 3. Осуществление мониторинга за НППИ возложено МЗ на Департамент медицинских иммунобиологических препаратов и иммунопрофилактики в структуре ГП
- 4. Принцип осуществления мониторинга за НППИ Департамент медицинских иммунобиологических препаратов и иммунопрофилактики при ГП «Государственный экспертный центр
- 5. Для чего необходимо проводить мониторинг за НППИ при применении вакцин? Выявить редко встречающиеся реакции в том
- 6. Основные методы получения информации о безопасности вакцин в пострегистрационный период Оперативно - от специалистов с медицинским
- 7. Изменения в репортировании про НППИ, согласно современным требованиям Заявитель информирует в виде очередных отчетов по безопасности
- 8. Специализированная экспертная оценка отчетов по безопасности МИБП В 2012 году получено 27 очередных отчетов по безопасности
- 9. Для чего необходимо проводить экспертную оценку отчетов по безопасности (PSUR) на МИБП? Обобщить все новые данные
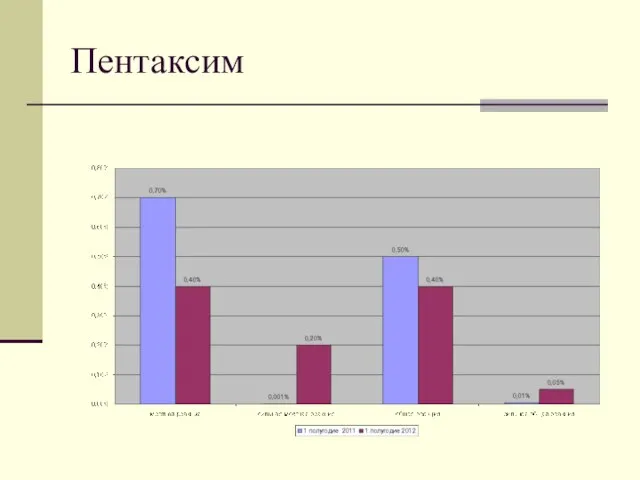
- 10. Пентаксим
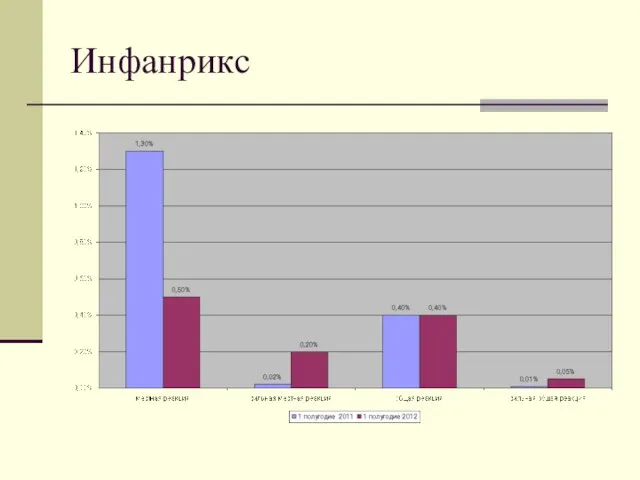
- 11. Инфанрикс
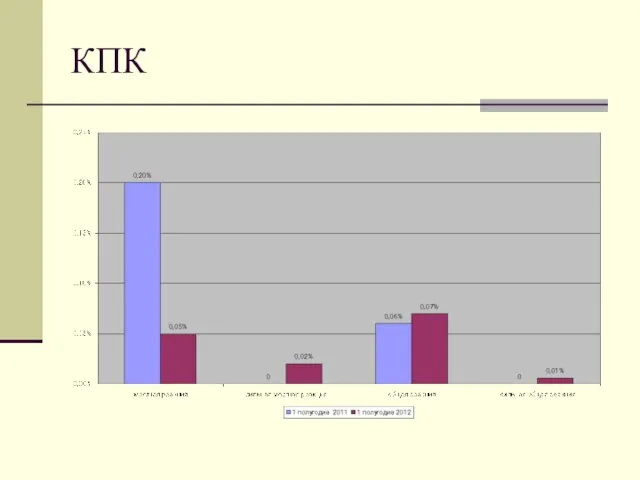
- 12. КПК
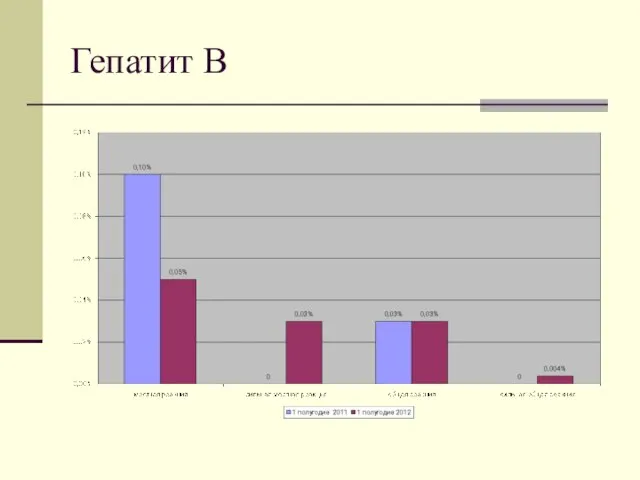
- 13. Гепатит В
- 14. Что необходимо для улучшения пострегистрационного надзора за НППИ? 1. Урегулирование вопроса по установлению запрета на использование
- 16. Скачать презентацию









 В. Гинуков. Условный портрет автора Слова
В. Гинуков. Условный портрет автора Слова Кафедра естественных наук
Кафедра естественных наук 249175
249175 Голосовой помощник Маруся
Голосовой помощник Маруся Девять предметов в системе счисления
Девять предметов в системе счисления Саморегулирующиеся организации «СРО Телеком» и СРО Телеком-Про»
Саморегулирующиеся организации «СРО Телеком» и СРО Телеком-Про» «Страницы семейного архива»
«Страницы семейного архива» Статистика терроризма
Статистика терроризма Социальные, этнические, конфессиональные и культурные различия личности
Социальные, этнические, конфессиональные и культурные различия личности Опиливание заготовок из сортового проката.Резание металла слесарной ножовкой.
Опиливание заготовок из сортового проката.Резание металла слесарной ножовкой. Гай Юлий Цезарь
Гай Юлий Цезарь Презентация на тему Новогодние игры со Снегурочкой и Дедом Морозом
Презентация на тему Новогодние игры со Снегурочкой и Дедом Морозом Презентация на тему Ёлочка из перьев
Презентация на тему Ёлочка из перьев Структура спонсорского пакета для чемпионата Санкт-Петербурга по водному поло.u
Структура спонсорского пакета для чемпионата Санкт-Петербурга по водному поло.u Заголовок Название раздела 1 Ленвендо Кто мы www.lenvendo.ru.
Заголовок Название раздела 1 Ленвендо Кто мы www.lenvendo.ru. ПОЛЯРИЗАЦИЯ И ДИФРАКЦИЯ СВЕТА
ПОЛЯРИЗАЦИЯ И ДИФРАКЦИЯ СВЕТА Тема урока: «Тайны поэзии Н.Гумилева»
Тема урока: «Тайны поэзии Н.Гумилева» Презентация на тему Лингвистический проект
Презентация на тему Лингвистический проект Цифровые автоматы, кодирование сигнала
Цифровые автоматы, кодирование сигнала Самодержавие Алексея Михайловича Тишайшего
Самодержавие Алексея Михайловича Тишайшего Презентация на тему Рулевое управление автомобиля
Презентация на тему Рулевое управление автомобиля Евгений Замятин. Роман-антиутопия "Мы“ как предупреждение потомкам
Евгений Замятин. Роман-антиутопия "Мы“ как предупреждение потомкам Модель управления имущественными комплексами вузов и вопросы распоряжения имуществом
Модель управления имущественными комплексами вузов и вопросы распоряжения имуществом Техника построения эллипсов во фронтальной плоскости проекций
Техника построения эллипсов во фронтальной плоскости проекций Нательные кресты XI – конца XIX вв. в экспозиции музея им. 1000-летия Брянска
Нательные кресты XI – конца XIX вв. в экспозиции музея им. 1000-летия Брянска Запатентован первый кассовый аппарат (1879)
Запатентован первый кассовый аппарат (1879) Система права
Система права Тест по рыбе
Тест по рыбе