Содержание
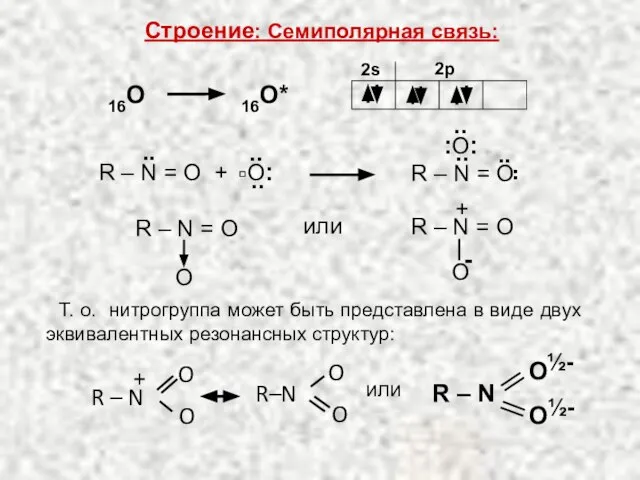
- 2. 16O* 16O 2s 2p или R – N = O O + R – N =
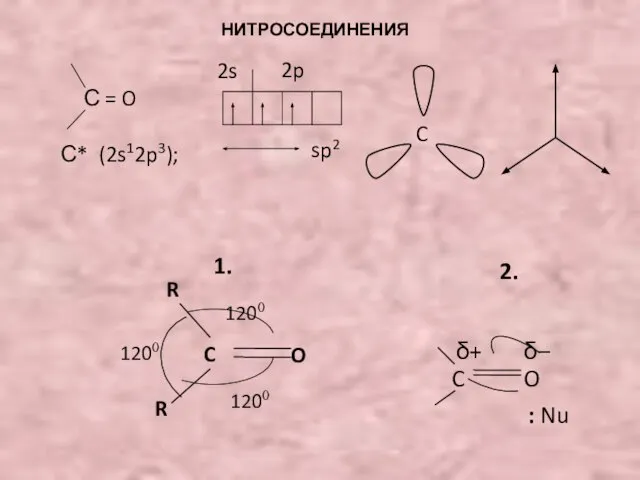
- 3. НИТРОСОЕДИНЕНИЯ. Т. кип. (CH3NO2) = 101˚C Т. кип. (CH3COCH3) = 56˚C Нитросоединения термодинамически неустойчивы: CH3NO2 1/2
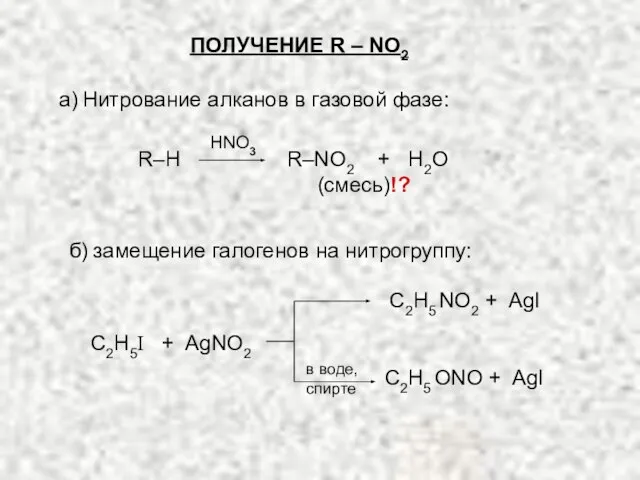
- 4. ПОЛУЧЕНИЕ R – NO2 (смесь)!? R–H R–NO2 + H2O С2Н5I + AgNO2 С2Н5 NO2 + AgI
- 5. ХИМИЧЕСКИЕ СВОЙСТВА НИТРОСОЕДИНЕНИЙ 1. Восстановление до аминов (для Ar – NH2). 2. Очень важны реакции по
- 6. OH- CH2–N O O O O CH2=N O O CH2–N - .. H α H+ H+
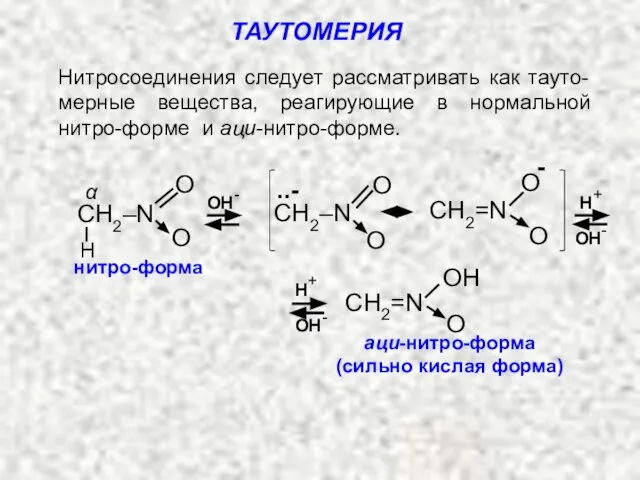
- 7. В растворе нормальные первичные и вторичные нитроалканы находятся в равновесии с аци-нитро-формой. Равновесие между обеими формами
- 8. б). При разложении натриевой соли аци-нитросоединения избытком холодной минераль-ной кислоты (раствор соли вливают в кислоту) образуются
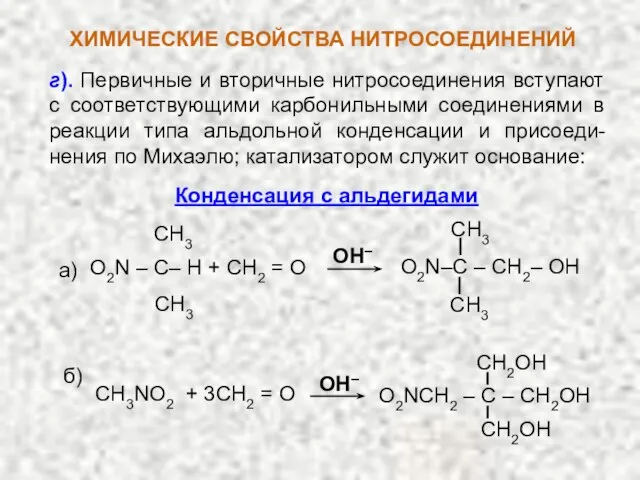
- 9. г). Первичные и вторичные нитросоединения вступают с соответствующими карбонильными соединениями в реакции типа альдольной конденсации и
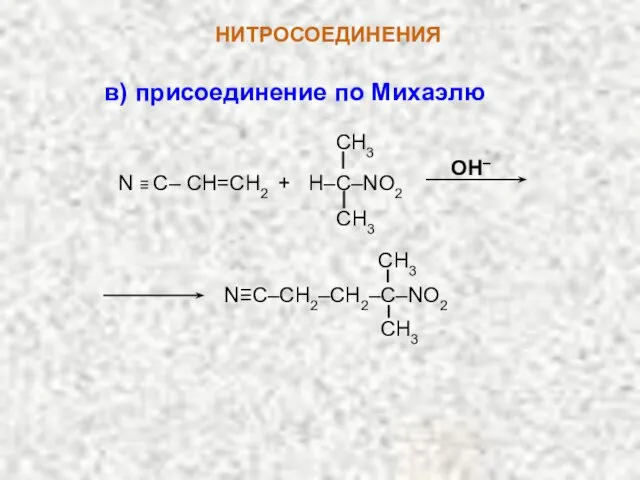
- 10. НИТРОСОЕДИНЕНИЯ OH– N ≡ C– CH=СН2 + H–C–NO2 CH3 CH3 N≡C–CH2–CH2–C–NO2 CH3 CH3 в) присоединение по
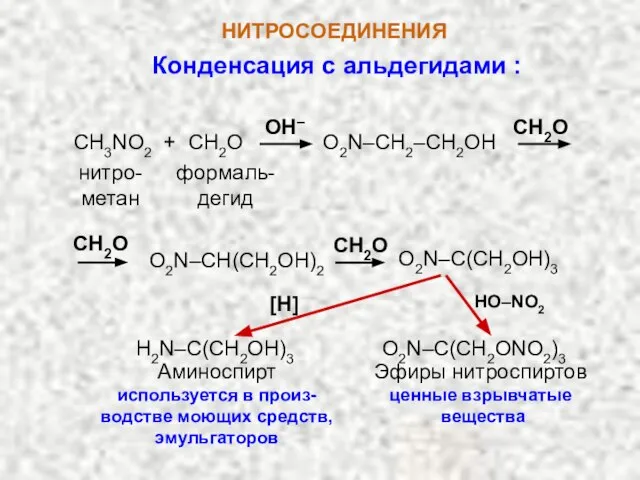
- 11. НИТРОСОЕДИНЕНИЯ Конденсация с альдегидами : CH3NO2 + CH2O O2N–CH2–CH2OH CH2O нитро-метан формаль- дегид O2N–CH(CH2OH)2 O2N–C(CH2OH)3 CH2O
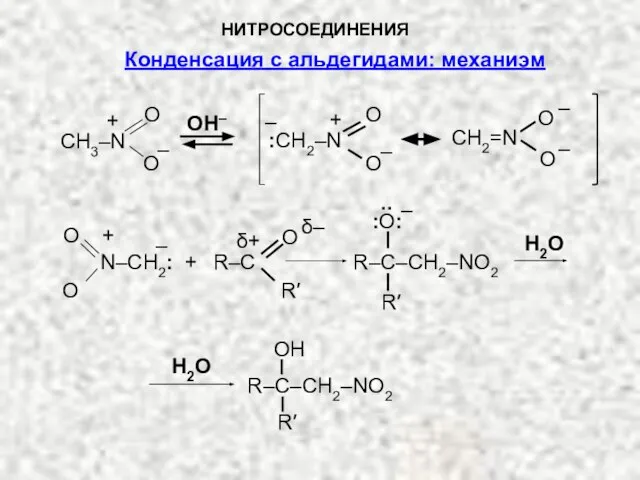
- 12. НИТРОСОЕДИНЕНИЯ CH3–N O O + – OH– O O – CH2=N – O O – :CH2–N
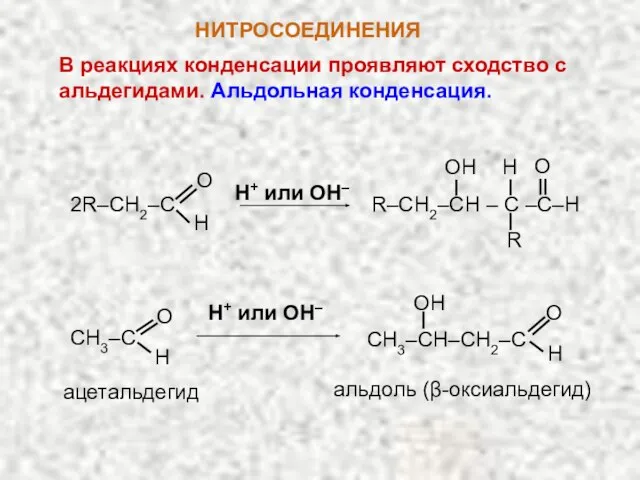
- 13. НИТРОСОЕДИНЕНИЯ В реакциях конденсации проявляют сходство с альдегидами. Альдольная конденсация. 2R–CH2–C O H R–CH2–CH – C
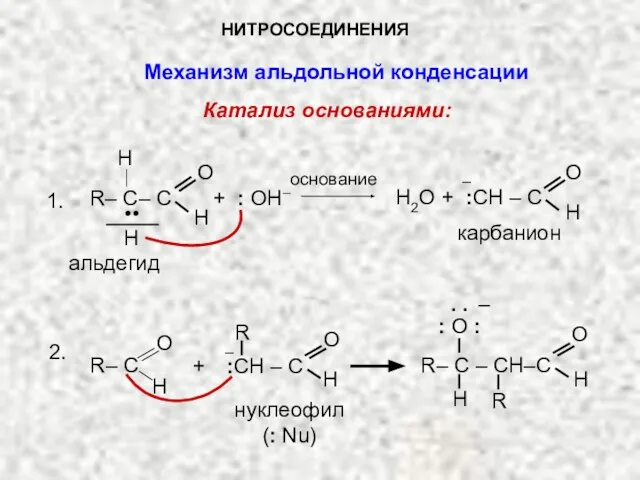
- 14. НИТРОСОЕДИНЕНИЯ Механизм альдольной конденсации Катализ основаниями: основание R– C– C O H .. + : OH–
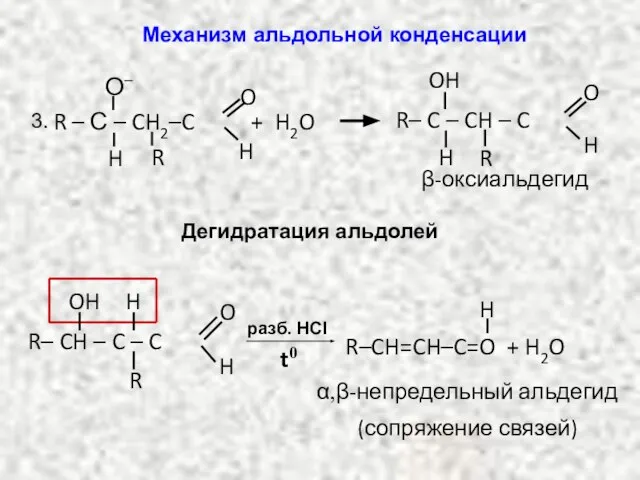
- 15. β-оксиальдегид R – С – CH2–C O H H О– R + H2O R– C –
- 16. НИТРОСОЕДИНЕНИЯ
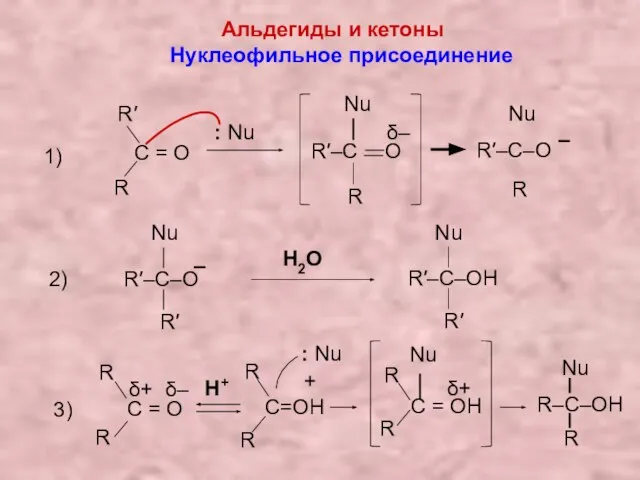
- 17. Альдегиды и кетоны Нуклеофильное присоединение 1) C = О R R′ R′–C O δ– – R′–C–O
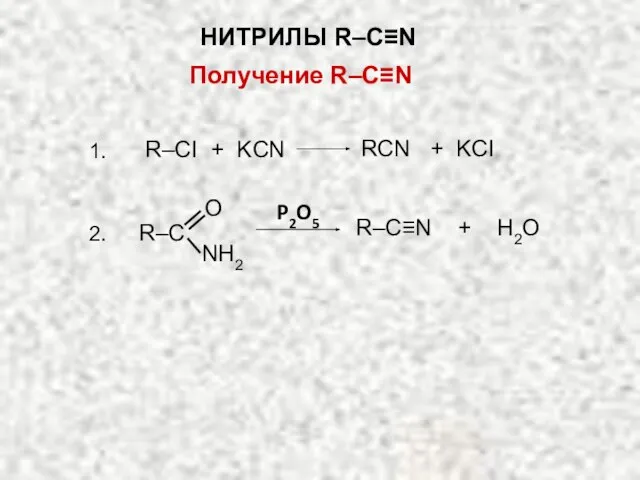
- 18. Получение R–C≡N R–CI + KCN RCN + KCI 1. O R–C NH2 P2O5 R–C≡N + H2O
- 19. 2. Востановливаются водородом до первичных аминов H2 / Ni R–NH2 R–C ≡ N Свойства R–C≡N Т
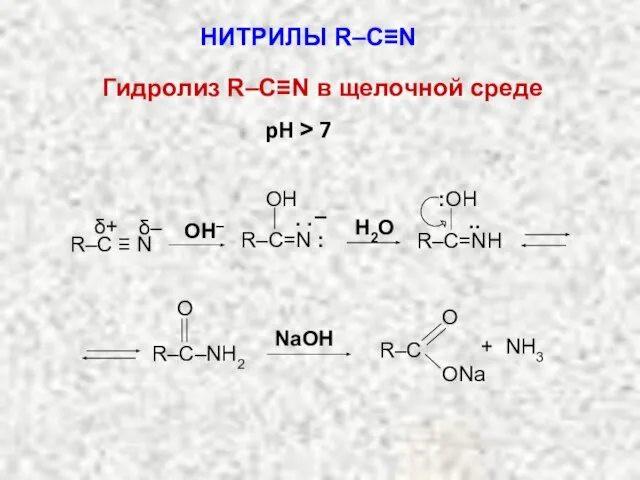
- 20. НИТРИЛЫ R–C≡N Гидролиз R–C≡N в щелочной среде R–C=N : OH . . – R–C=NН .. :OH
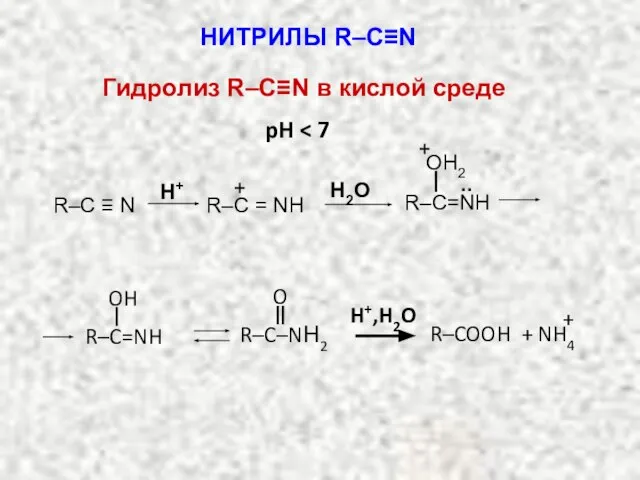
- 21. pH H2O R–C ≡ N H+ R–C = NН + R–C=NН .. OH2 + R–C=NH OH
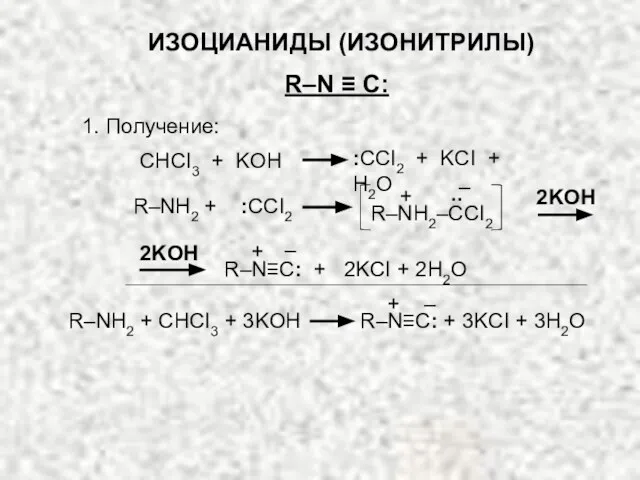
- 22. ИЗОЦИАНИДЫ (ИЗОНИТРИЛЫ) R–N ≡ C: 1. Получение: R–N≡C: + 2KCI + 2H2O 2KOH + – CHCI3
- 23. Свойства R–N≡C 1. Изонитрилы кипят при несколько меньшей температуре, чем R–C≡N 2. Гидролизуются только в кислой
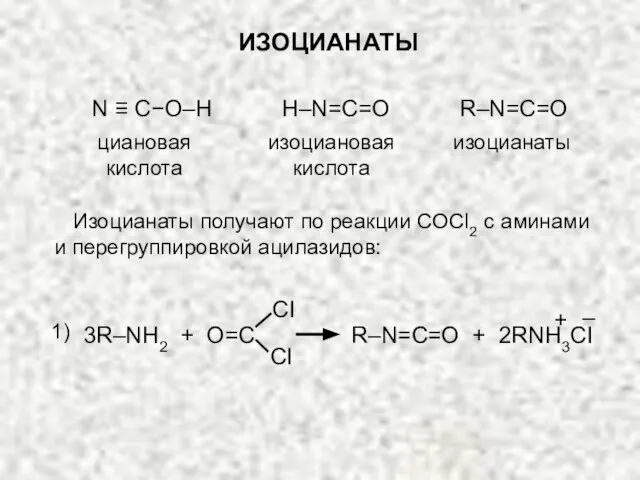
- 24. ИЗОЦИАНАТЫ циановая кислота N ≡ C−O–H H–N=C=O изоциановая кислота изоцианаты R–N=C=O Изоцианаты получают по реакции COCl2
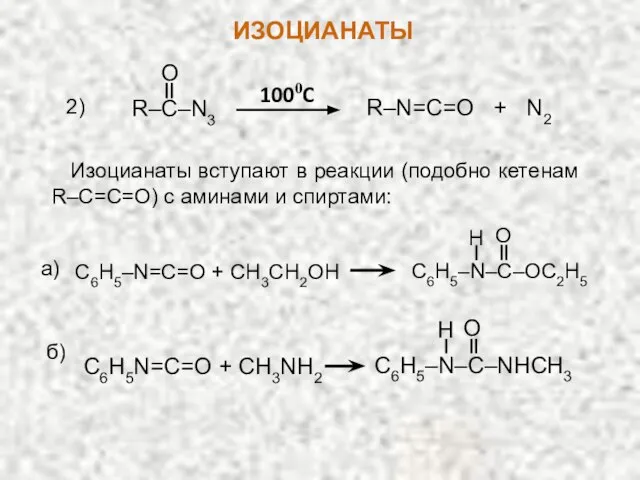
- 25. R–C–N3 O R–N=C=O + N2 1000C 2) Изоцианаты вступают в реакции (подобно кетенам R–С=C=O) с аминами
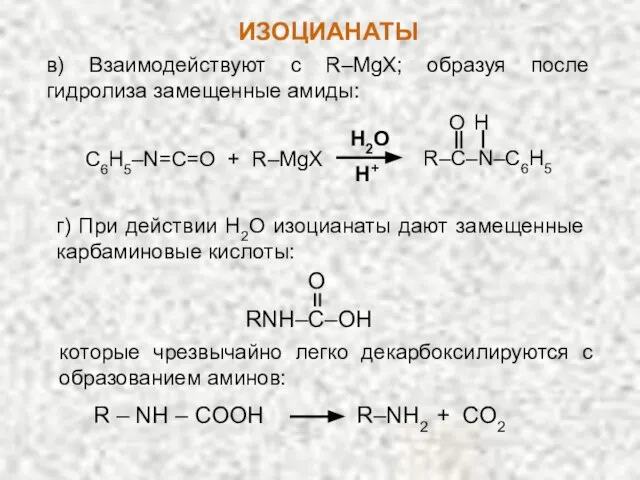
- 26. в) Взаимодействуют с R–MgX; образуя после гидролиза замещенные амиды: C6H5–N=C=O + R–MgX R–C–N–C6H5 H O H2O
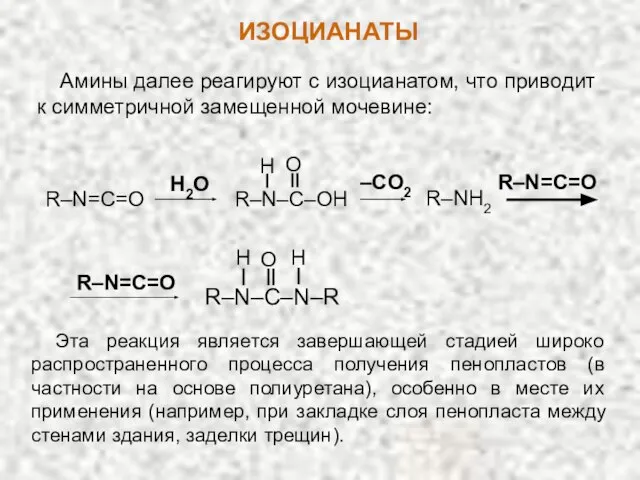
- 27. Амины далее реагируют с изоцианатом, что приводит к симметричной замещенной мочевине: R–NH2 R–N–C–OH H O R–N=C=O
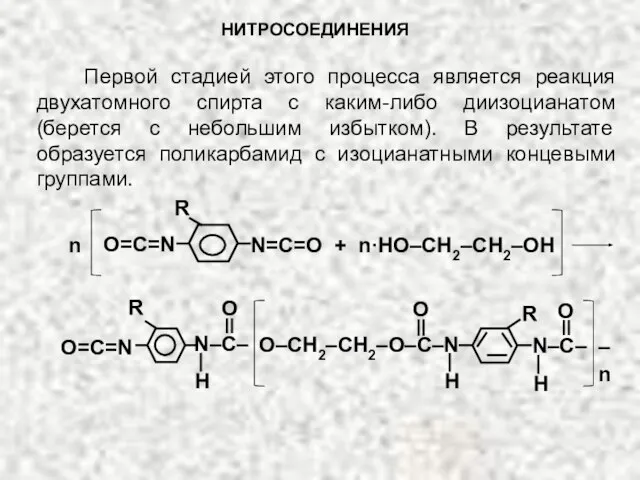
- 28. НИТРОСОЕДИНЕНИЯ Первой стадией этого процесса является реакция двухатомного спирта с каким-либо диизоцианатом (берется с небольшим избытком).
- 30. Скачать презентацию






 Выход предприятия на Оптовый Рынок Электроэнергии и Мощности (ОРЭМ)
Выход предприятия на Оптовый Рынок Электроэнергии и Мощности (ОРЭМ) Мобильное рабочее место. Приложение для мобильной регистрации клиентов
Мобильное рабочее место. Приложение для мобильной регистрации клиентов Проблемы формирования информационного общества
Проблемы формирования информационного общества 05 - Правоотношения
05 - Правоотношения Генетика человека Элективный курс для учащихся 9 класса
Генетика человека Элективный курс для учащихся 9 класса Сколько стоит интернет-магазин? На чём можно сэкономить.
Сколько стоит интернет-магазин? На чём можно сэкономить. Нормативные модели ППР - функции
Нормативные модели ППР - функции ТЕМА ОДИНОЧЕСТВА В ЛИРИКЕ М.Ю. ЛЕРМОНТОВА
ТЕМА ОДИНОЧЕСТВА В ЛИРИКЕ М.Ю. ЛЕРМОНТОВА Русская природа в музыке и поэзии
Русская природа в музыке и поэзии Презентация на тему Красная книга России
Презентация на тему Красная книга России  Использование метода круговой тренировки для повышения функциональных способностей боксеров
Использование метода круговой тренировки для повышения функциональных способностей боксеров Презентация на тему Реализм
Презентация на тему Реализм Фильм Выход через сувенирную лавку
Фильм Выход через сувенирную лавку Третичный сектор хозяйства
Третичный сектор хозяйства Искусство кино
Искусство кино Толерантность и мы.
Толерантность и мы. Музей Победы и Центр международной торговли
Музей Победы и Центр международной торговли Ориентация спутника в трехмерном пространстве
Ориентация спутника в трехмерном пространстве 4 заседание Совета по Устойчивому Развитию РКАстана, 5 декабря 2007 года Корпоративная социальная ответственность в контексте ус
4 заседание Совета по Устойчивому Развитию РКАстана, 5 декабря 2007 года Корпоративная социальная ответственность в контексте ус Єдиний державний реєстр юридичних осіб, фізичних осіб підприємців та громадських формувань
Єдиний державний реєстр юридичних осіб, фізичних осіб підприємців та громадських формувань 1968 - 2018 ж Ақжар орта мектебінің түлектеріне 50 жыл. Фотоальбом
1968 - 2018 ж Ақжар орта мектебінің түлектеріне 50 жыл. Фотоальбом Презентация на тему Детская одаренность
Презентация на тему Детская одаренность  График квадратичной функции Занятие в 9 классе Продолжительность 40 минут Учитель математики Лещенко Любовь Владимировна в
График квадратичной функции Занятие в 9 классе Продолжительность 40 минут Учитель математики Лещенко Любовь Владимировна в Технические требования. Лист4
Технические требования. Лист4 ФЕДЕРАЛЬНАЯ АНТИМОНОПОЛЬНАЯ СЛУЖБА Москва, 2006 г. Новое правовое поле и новые полномочия ФАС России.
ФЕДЕРАЛЬНАЯ АНТИМОНОПОЛЬНАЯ СЛУЖБА Москва, 2006 г. Новое правовое поле и новые полномочия ФАС России. Презентация на тему Культура поведения и общения
Презентация на тему Культура поведения и общения Презентация на тему Климат России 8 класс
Презентация на тему Климат России 8 класс Старанний і дружний наш 1-Б клас
Старанний і дружний наш 1-Б клас