Содержание
- 2. Количество вещества – такое количество вещества, которое содержит 6 . 1023 частиц (т.е. число Авогадро NA=
- 3. Молярная масса – масса одного моля вещества (обозначают М, рассчитывается в г/моль) численно равна относительной молекулярной
- 4. Молярный объем – объем одного моля вещества. Обозначают Vm . В соответствии со следствием закона Авогадро
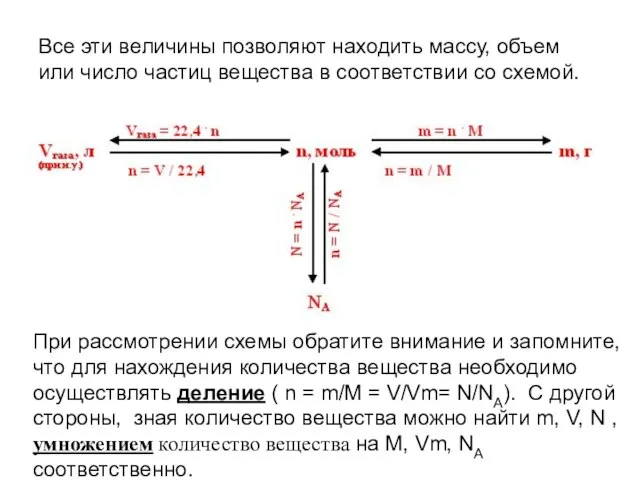
- 5. Все эти величины позволяют находить массу, объем или число частиц вещества в соответствии со схемой. При
- 6. Следующая величина, которая заслуживает внимания это массовая доля. Массовая доля. Обозначается w. Рассчитывается в долях или
- 7. Кроме того для смесей газов или растворов часто используется понятие молярная концентрация, которая рассчитывается по формуле:
- 8. Плотность. Плотность любого вещества рассчитывается по формуле ρ = m/V, измеряется обычно в г/мл или в
- 9. Кроме того, для газов вводиться понятие относительной плотности ( D), которая показывает во сколько раз один
- 10. Плотность газов в задачах по органической химии часто используется для нахождения молярной массы газа: М =
- 11. Одно из очень важных следствий закона Авогадро заключается в том, что: объемы газов при химических реакциях
- 12. Ну и последнее про что хотелось бы сказать – это выход продукта реакции. Как бы нам
- 14. Скачать презентацию










 ООО «ЭкоЛайф 69»
ООО «ЭкоЛайф 69» Борьба Руси с иноземным нашествием в XIII в.
Борьба Руси с иноземным нашествием в XIII в. Формы и методы развития исследовательских способностей
Формы и методы развития исследовательских способностей Подбор, обучение и мониторинг персонала Call центров.
Подбор, обучение и мониторинг персонала Call центров. Наследственное право РФ
Наследственное право РФ Приготовление пресного сдобного теста и изделий из него
Приготовление пресного сдобного теста и изделий из него Парковая зона театра им. Натальи Сац
Парковая зона театра им. Натальи Сац правда и вымыслы об акулах
правда и вымыслы об акулах 1. ПР №1 - Тема -1ч. Развитие психики и сознания
1. ПР №1 - Тема -1ч. Развитие психики и сознания Презентация на тему Личные финансы
Презентация на тему Личные финансы Маленькая фея: новинки
Маленькая фея: новинки Настенная живопись
Настенная живопись Комплексное обеспечение процессов в сфере складской логистики, производства и ритейла
Комплексное обеспечение процессов в сфере складской логистики, производства и ритейла Санаторий Марциальные воды в Карелии. Лечение, отдых, встречи
Санаторий Марциальные воды в Карелии. Лечение, отдых, встречи Алгоритм психологической организации группы. Лекция 1
Алгоритм психологической организации группы. Лекция 1 МЕНЕДЖМЕНТ
МЕНЕДЖМЕНТ Современные принципы государственной политики в области МСБ: налоговое регулирование, доступ к финансам
Современные принципы государственной политики в области МСБ: налоговое регулирование, доступ к финансам О финансировании медицинских организаций в системе ОМС в 2011 году и перспективах перехода на одноканальное финансирование в 2011-201
О финансировании медицинских организаций в системе ОМС в 2011 году и перспективах перехода на одноканальное финансирование в 2011-201 Выборы президента школы
Выборы президента школы Оценка информированности учащихся ГБОУ СОШ № 499 по проблемам, связанным с потреблением наркотиков
Оценка информированности учащихся ГБОУ СОШ № 499 по проблемам, связанным с потреблением наркотиков Н.Д. Голев
Н.Д. Голев Продажа маральников и земельных участков
Продажа маральников и земельных участков Автономный контроллер освещения
Автономный контроллер освещения Система управления предприятием Облик-ERP.Конфигурация Оперативное управление предприятием.
Система управления предприятием Облик-ERP.Конфигурация Оперативное управление предприятием. Эмоции эмпатии и вины
Эмоции эмпатии и вины Особенности формирования производственного плана в лесной отрасли
Особенности формирования производственного плана в лесной отрасли Презентация на тему Биологическое действие радиоактивных излучений
Презентация на тему Биологическое действие радиоактивных излучений Школа молодого политика Лидер
Школа молодого политика Лидер