Содержание
- 2. Кислоты- электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков HCL H++CL- H2SO4 3H++PO43-
- 3. Классификация кислот
- 4. Типичные реакции кислот Кислота + основание = соль + вода H2SO4 +2 NaOH = Na2SO4 +
- 5. ПРОВЕРЬ СЕБЯ 1.Формула кислоты это: а) NaOH в) CuCL2 б) HCL г) SO3 2. Лакмус в
- 7. Скачать презентацию
Слайд 2Кислоты-
электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков
HCL
Кислоты- электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков HCL

H++CL-
H2SO4 3H++PO43-
Слайд 3Классификация кислот
Классификация кислот

Слайд 4Типичные реакции кислот
Кислота + основание = соль + вода
H2SO4 +2 NaOH
Типичные реакции кислот
Кислота + основание = соль + вода
H2SO4 +2 NaOH

= Na2SO4 + 2H2O
2H+ +2OH- = 2H2O
Кислота + оксид металла = соль + вода
CuO + 2 HCL = CuCL2 + H2O
CuO + 2H+ = H2O + Cu2+
Кислота + металл = водород + соль
2HCL +Zn = ZnCL2 + H2
2H+ + Zn0 =Zn2+ +H2
Условия: - в ряду напряжений металл должен стоять до водорода
- в результате реакции должна получиться растворимая соль
Кислота + соль = новая кислота + новая соль
Условия: - в результате реакции должны получиться газ, осадок
или вода.
BaCL2 + H2SO4 = BaSO4 + 2HCL
Ba2+ + SO42- = BaSO4
2H+ +2OH- = 2H2O
Кислота + оксид металла = соль + вода
CuO + 2 HCL = CuCL2 + H2O
CuO + 2H+ = H2O + Cu2+
Кислота + металл = водород + соль
2HCL +Zn = ZnCL2 + H2
2H+ + Zn0 =Zn2+ +H2
Условия: - в ряду напряжений металл должен стоять до водорода
- в результате реакции должна получиться растворимая соль
Кислота + соль = новая кислота + новая соль
Условия: - в результате реакции должны получиться газ, осадок
или вода.
BaCL2 + H2SO4 = BaSO4 + 2HCL
Ba2+ + SO42- = BaSO4
Слайд 5ПРОВЕРЬ СЕБЯ
1.Формула кислоты это:
а) NaOH в) CuCL2
б) HCL г) SO3
2.
ПРОВЕРЬ СЕБЯ
1.Формула кислоты это:
а) NaOH в) CuCL2
б) HCL г) SO3
2.

Лакмус в растворе, полученном при взаимодействии оксида серы (IV) с водой:
а) синий в) фиолетовый
б) красный г) малиновый
3. С раствором серной кислоты взаимодействует:
а) оксид магния в) оксид фосфора
б) оксид углерода г) сера
4. Соляная кислота не взаимодействует с металлом:
а) алюминием в) серебром
б) железом г) цинком
5. Пара ионов, которая может одновременно находится в растворе:
а) H+ и SiO3 в) Н+ и SO42-
б) Cu 2+ и ОН- г) Ag+ и CL-
6. Пара веществ взаимодействующих друг с другом:
а) H2SO4 u SiO2 в) Сu u H3PO
б) CuO u Na2O г) НСL u NaOH
а) синий в) фиолетовый
б) красный г) малиновый
3. С раствором серной кислоты взаимодействует:
а) оксид магния в) оксид фосфора
б) оксид углерода г) сера
4. Соляная кислота не взаимодействует с металлом:
а) алюминием в) серебром
б) железом г) цинком
5. Пара ионов, которая может одновременно находится в растворе:
а) H+ и SiO3 в) Н+ и SO42-
б) Cu 2+ и ОН- г) Ag+ и CL-
6. Пара веществ взаимодействующих друг с другом:
а) H2SO4 u SiO2 в) Сu u H3PO
б) CuO u Na2O г) НСL u NaOH
- Предыдущая
ЧИСТАЯ ВОДА ДЛЯ ВСЕХ (–1) · 3 =
(–1) · 3 = Осмотр общего имущества в многоквартирном доме
Осмотр общего имущества в многоквартирном доме EV3 Самосвал
EV3 Самосвал Инвестиционный фонд МАП «Инновационный лифт»
Инвестиционный фонд МАП «Инновационный лифт» Нам нужны союзники!
Нам нужны союзники! Дисциплина: Международные перевозки грузов РАЗДЕЛ 3. Обеспечивающий комплекс организации международной перевозки грузов Тема 3
Дисциплина: Международные перевозки грузов РАЗДЕЛ 3. Обеспечивающий комплекс организации международной перевозки грузов Тема 3 Мое зазеркалье
Мое зазеркалье Московский колледж бизнес-технологий. Эксплуатация беспилотных авиационных систем
Московский колледж бизнес-технологий. Эксплуатация беспилотных авиационных систем Презентация Microsoft PowerPoint (3)
Презентация Microsoft PowerPoint (3) Презентация на тему Иудаизм презентация 4 класс
Презентация на тему Иудаизм презентация 4 класс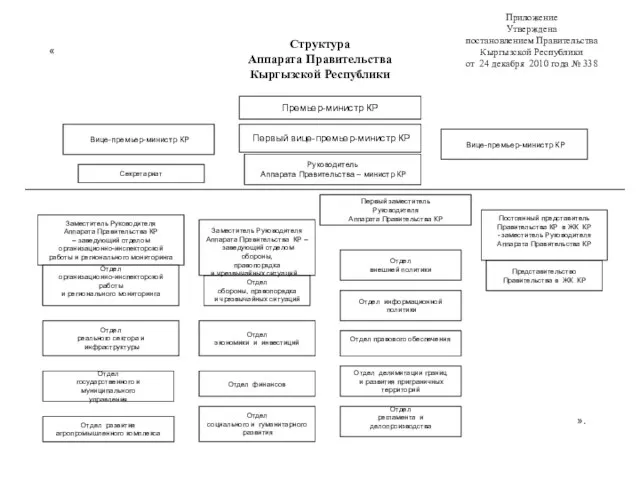 Структура Аппарата Правительства Кыргызской Республики
Структура Аппарата Правительства Кыргызской Республики Автоматизированная информационная система «Государственный заказ»
Автоматизированная информационная система «Государственный заказ» Формирование экологической культуры обучающихся колледжа через реализацию социально-образовательых проектов
Формирование экологической культуры обучающихся колледжа через реализацию социально-образовательых проектов Тема урока «Право на труд. Трудовые правоотношения»
Тема урока «Право на труд. Трудовые правоотношения» Класс 1-1 3주 후 시험문제 읽기 Чтение
Класс 1-1 3주 후 시험문제 읽기 Чтение Обобщающий урок - игра по теме: «Я знаю край родной».
Обобщающий урок - игра по теме: «Я знаю край родной». Тяжелая атлетика в России и за рубежом
Тяжелая атлетика в России и за рубежом Разработка мероприятия Цифровой текстиль. Синтетические ткани
Разработка мероприятия Цифровой текстиль. Синтетические ткани Лекция_6 ЭТД ФТД.ppt
Лекция_6 ЭТД ФТД.ppt Презентация на тему Сочинение по картине Левитана «Весна. Большая вода» 4 класс
Презентация на тему Сочинение по картине Левитана «Весна. Большая вода» 4 класс Методы мониторинга репутациив социальных медиа
Методы мониторинга репутациив социальных медиа Областной конкурспервичных профсоюзныхорганизаций.
Областной конкурспервичных профсоюзныхорганизаций. Контроль квалификации сварщиков. Система аттестации сварочного производства
Контроль квалификации сварщиков. Система аттестации сварочного производства Уголовное законодательство Республики Казахстан на страже воинского правопорядка (занятие 1)
Уголовное законодательство Республики Казахстан на страже воинского правопорядка (занятие 1) 36736
36736 Презентация на тему Разгром империи Наполеона. Венский конгресс (8 класс)
Презентация на тему Разгром империи Наполеона. Венский конгресс (8 класс) Электрическая лампа накаливания
Электрическая лампа накаливания 20161206_avstraliya-i-okeaniya
20161206_avstraliya-i-okeaniya