Содержание
- 2. Характеристика металлов главной подгруппы I группы Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb,
- 3. Строение атомов щелочных металлов Все щелочные металлы имеют один s-электрон на внешнем электронном слое, который при
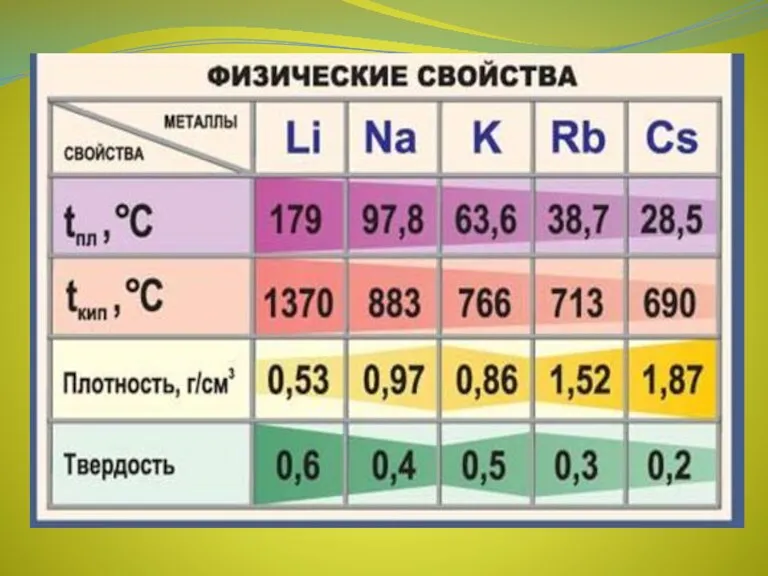
- 4. Физические свойства Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их
- 6. Получение щелочных металлов 1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще
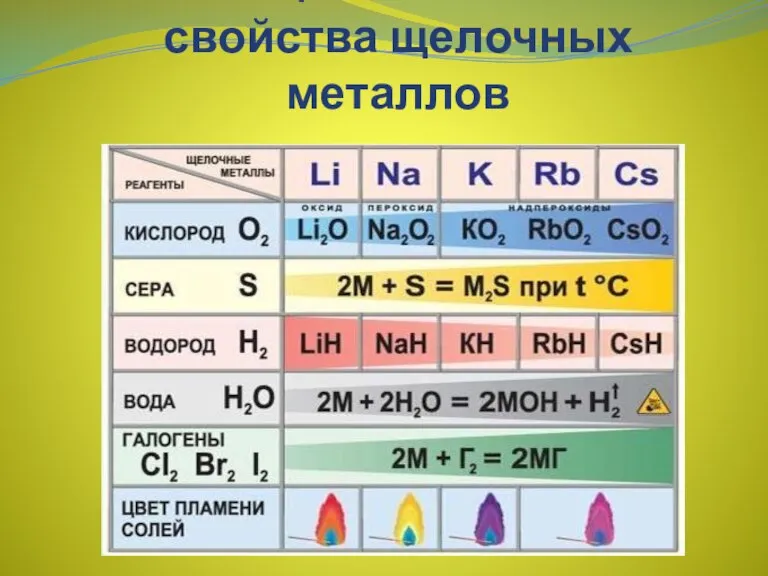
- 7. Химические свойства Реакции с неметаллами (образуются бинарные соединения): 4Li + O2 2Li2O(оксид лития) 2Na + O2
- 8. Активно взаимодействуют с водой: 2Na + 2H2O 2NaOH + H2 2Li + 2H2O 2LiOH + H2
- 9. Качественная реакция на катионы щелочных металлов - окрашивание пламени в следующие цвета: Li+ - карминово-красный Na+
- 10. Обобщим химические свойства щелочных металлов
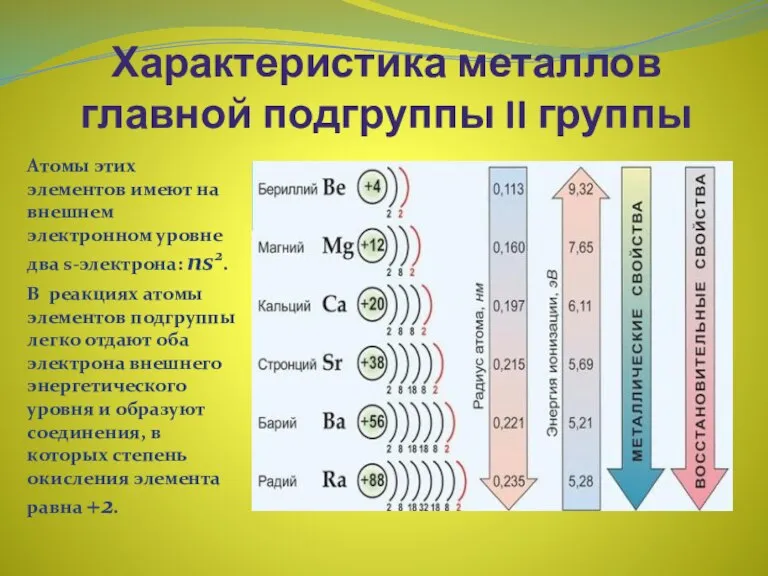
- 11. Характеристика металлов главной подгруппы II группы Атомы этих элементов имеют на внешнем электронном уровне два s-электрона:
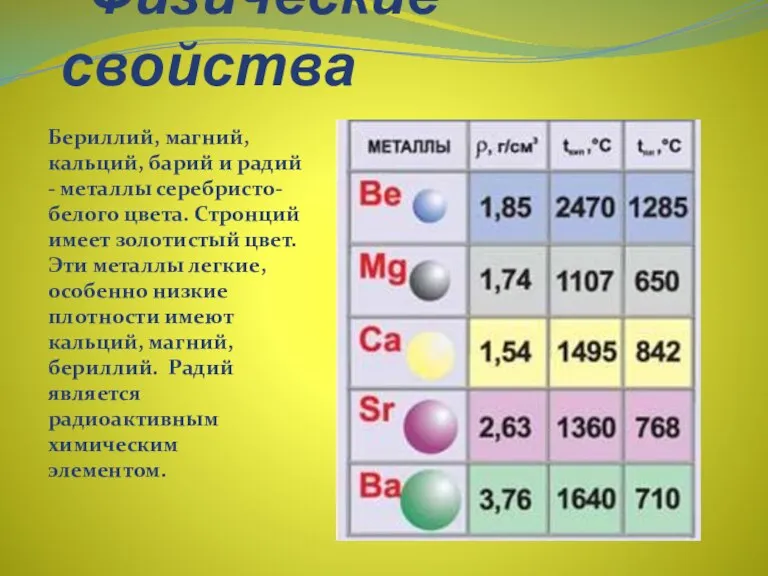
- 12. Физические свойства Бериллий, магний, кальций, барий и радий - металлы серебристо-белого цвета. Стронций имеет золотистый цвет.
- 13. Получение щелочноземельных металлов Электролизом расплавов их хлоридов или термическим восстановлением их соединений: BeF2 + Mg =
- 14. Химические свойства Щелочноземельные элементы - химически активные металлы. Они являются сильными восстановителями. Из металлов этой подгруппы
- 15. Взаимодействие с простыми веществами Все легко взаимодействуют с кислородом и серой, образуя оксиды и сульфаты: 2Be
- 16. Взаимодействие с кислотами Все взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода: Be +
- 17. Взаимодействие со щелочами Бериллий взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода:
- 18. Алюминий 13Al [Ne] 3s23p1 Алюминий находится в главной п/группе III группы периодической системы. На внешнем энергетическом
- 19. Физические свойства Металл серебристо-белого цвета, легкий, плотность 2,7 г/см³, температура плавления у технического 658 °C, у
- 20. Химические свойства С простыми веществами: 1) С кислородом: 4Al0 + 3O2 → 2Al+32O3 2) С галогенами:
- 21. Со сложными веществами: 4) С водой (после удаления защитной оксидной пленки): 2Al0 + 6H2O ® 2Al+3(OH)3
- 22. Получение алюминия
- 23. Применение алюминия — в электротехнике — для производства легких сплавов (дюралюмин, силумин) в самолето- и автомобилестроении
- 24. Задания для закрепления знаний: Осуществить цепочку превращений: Аl → АlСl3 → Аl(ОН)3 → Аl2 О3 →
- 25. Найди соответствие 1. Активные металлы 2. Металлы средней активности 3. Благородные металлы А) Au, Ag, Pt
- 26. Вставьте пропущенное слово: Наиболее выраженные металлические свойства проявляет: ? алюминий ? натрий ? магний ? бериллий
- 27. Калий взаимодействует с водой с образованием.... и .... ? соли ? водорода ? щелочи ? оксида
- 28. Решите задачи: Задача № 1 При обработке 8г смеси магния и оксида магния соляной кислотой выделилось
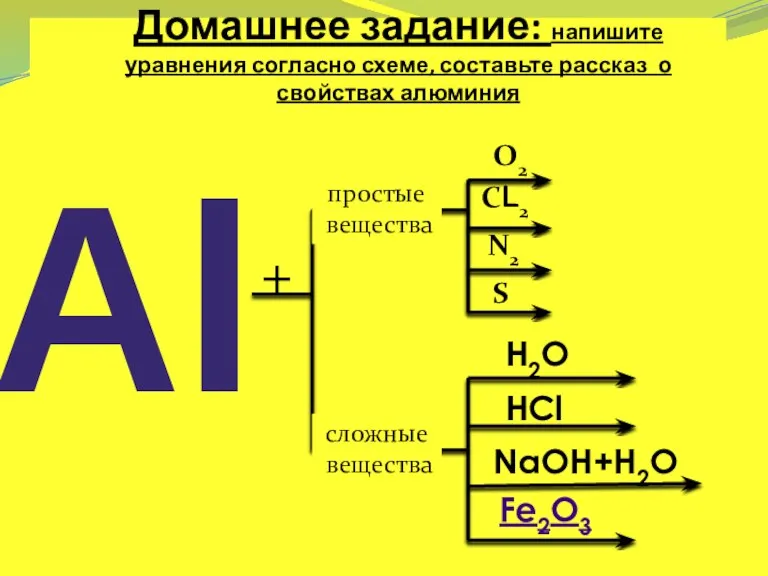
- 29. Домашнее задание: напишите уравнения согласно схеме, составьте рассказ о свойствах алюминия Al + простые вещества сложные
- 31. Скачать презентацию












![Алюминий 13Al [Ne] 3s23p1 Алюминий находится в главной п/группе III группы периодической](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/335655/slide-17.jpg)










 Вниманию субъектов предпринимательства!
Вниманию субъектов предпринимательства! Презентация на тему Химический алфавит
Презентация на тему Химический алфавит  Аминокислоты
Аминокислоты Демографическая ситуация в Еврейской автономной области: современные тенденции и прогноз
Демографическая ситуация в Еврейской автономной области: современные тенденции и прогноз Управление затратами и контроллинг
Управление затратами и контроллинг  Основные виды обстоятельств
Основные виды обстоятельств Презентация на тему Эволюция денег Арбузова
Презентация на тему Эволюция денег Арбузова Реализм в западноевропейской живописи 19 века
Реализм в западноевропейской живописи 19 века Организация и проведение специальной оценки условий труда
Организация и проведение специальной оценки условий труда Проблемы современной педагогики и образования
Проблемы современной педагогики и образования В голубом царстве, подводном государстве
В голубом царстве, подводном государстве ПСИХИКА ЖИВОТНЫХ И ЧЕЛОВЕКА
ПСИХИКА ЖИВОТНЫХ И ЧЕЛОВЕКА 111327
111327 Афинский Акрополь
Афинский Акрополь Оригами в интерьере
Оригами в интерьере Защита прав потребителя
Защита прав потребителя «Жестокое обращение с детьми». Психологическое насилие Психологическое насилие – длительное, постоянное или периодическое возде
«Жестокое обращение с детьми». Психологическое насилие Психологическое насилие – длительное, постоянное или периодическое возде Презентация на тему Обмен белков, жиров и углеводов
Презентация на тему Обмен белков, жиров и углеводов  Беседа о толерантности
Беседа о толерантности Основное понятие происхождение: признаки, функции, формы
Основное понятие происхождение: признаки, функции, формы Русская художественная культура в первой половине 19 века
Русская художественная культура в первой половине 19 века Электронные свойства поверхности
Электронные свойства поверхности  Графическое изображение изделий из металла и искусственных материалов
Графическое изображение изделий из металла и искусственных материалов Научно-исследовательская работа СЗГМУ им. И.И. Мечникова
Научно-исследовательская работа СЗГМУ им. И.И. Мечникова Презентация на тему Методы исследования
Презентация на тему Методы исследования Военная форма ВС РФ
Военная форма ВС РФ Презентация на тему Достопримечательности Ставрополя
Презентация на тему Достопримечательности Ставрополя Межличностные конфликты, их конструктивное разрешение
Межличностные конфликты, их конструктивное разрешение