Содержание
- 2. Загадка Очень древний я металл, Счёт столетьям потерял. Был нескромным я не в меру, Тысячи лет
- 3. «Третий лишний». Задание: Решите анаграммы и исключите лишнее. леруогд иксолодр ддрооов золеже углерод кислород водород железо
- 4. Охарактеризуйте Fe как химический элемент, составив предложения со словами и словосочетаниями: Порядковый номер, номер периода ,
- 5. Задание Закончите электронно - буквенную формулу и нарисуйте графическую формулу строения атома железа: Железо(№ 131835)
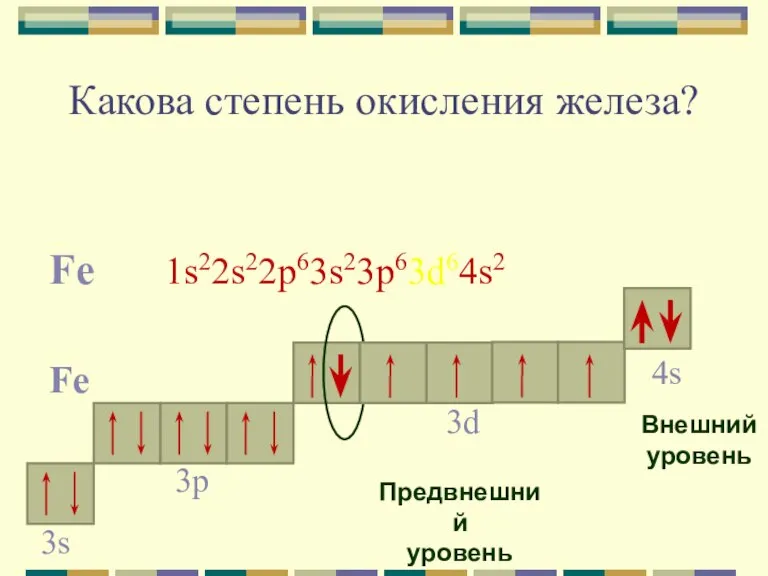
- 6. Какова степень окисления железа? Fe 1s22s22p63s23p63d64s2 Fe 4s Внешний уровень 3d Предвнешний уровень 3p 3s
- 7. Для железа характерны две основные степени окисления: +2, +3. Fe0 - 2e- = Fe+2 Fe0 -
- 8. Задание: Рассмотрите образец металла (№ 131836). Опишите физические свойства металла (№ 131797).. Используя текст учебник, заполните
- 9. Выберите и запишите цифры только тех свойств, которые не относятся к физическим свойствам железа: Серебристо-белый металл
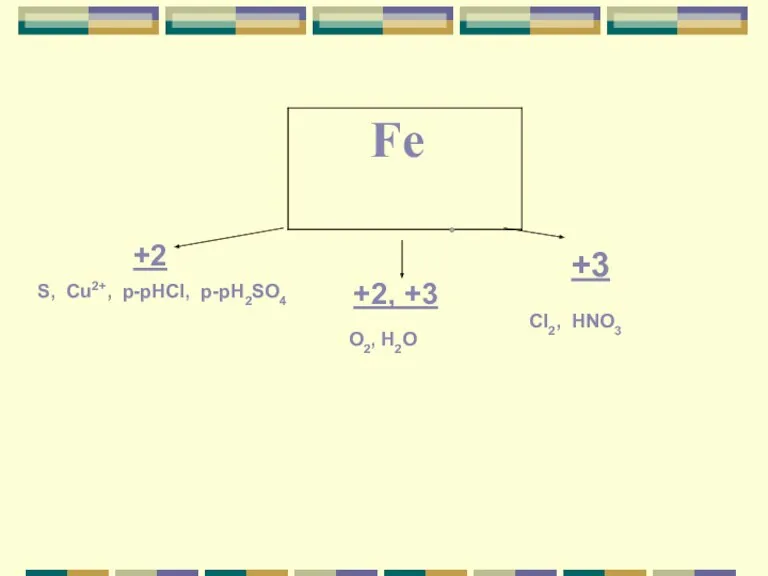
- 10. +2 +2, +3 +3 S, Cu2+, p-рHCI, p-рH2SO4 O2, H2O CI2, HNO3
- 11. Химические свойства железа Взаимодействие железа с хлором Видеофрагмент (№ 54490): 2Fe + 3Cl2 = 2FeCl3
- 12. Химические свойства железа Взаимодействие железа сВзаимодействие железа с Взаимодействие железа с кислородом: Видеофрагмент (№ 131824) Fe
- 13. : Какие из реакций соответствуют схеме Fe+2 → Fe+3 FeCI2 + CI2 = FeCI3 FeCI3 +
- 14. Задание: Расставить коэффициенты в уравнениях 1 и 3 методом электронного баланса, определить окислитель и восстановитель в
- 15. Нахождение в природе В земной коре 5,1% железа, 4 место после кислорода, кремния и алюминия. По
- 16. Нахождение в природе Метеоритное железо(№ 131727) Запишите не менее 4 -х формул соединений железа, встречающихся в
- 17. Природные соединения железа Fe FeS Пирит (железный или серный колчедан) FeCO3 Сидерит Fe2O3*3H2O Лимонит (бурый железняк)
- 18. Генетические связи Fe - ОТ ЖЕЛЕЗА ДО ОКСИДА ЖЕЛЕЗА (- ОТ ЖЕЛЕЗА ДО ОКСИДА ЖЕЛЕЗА (II-
- 19. ПРИМЕНЕНИЕ(№ 207382) Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для изготовления трансформаторов, электромоторов
- 20. Домашнее задание § 14, с. 76 -78 № 5 с. 82 - всем № 6 с.
- 21. Используемая литература: 1. Горковенко М. Ю. Химия. 9 класс. Поурочные разработки к учебнику О. С. Габриеляна
- 23. Скачать презентацию

















 ЧЕЛОВЕК ЛИЧНОСТЬ ГРАЖДАНИН
ЧЕЛОВЕК ЛИЧНОСТЬ ГРАЖДАНИН НАШ ГЕРБ. НАШ ФЛАГ!
НАШ ГЕРБ. НАШ ФЛАГ! Презентация на тему Невербальное общение
Презентация на тему Невербальное общение  Лапта
Лапта Флористика цветов
Флористика цветов Место муниципального права в российском праве Работу выполнила студентки группы Ю104 Соловьенко Карина и Буйнова Людмила
Место муниципального права в российском праве Работу выполнила студентки группы Ю104 Соловьенко Карина и Буйнова Людмила Зима. И.З. Суриков
Зима. И.З. Суриков Derecho inmobiliario (Limitaciones de dominio)
Derecho inmobiliario (Limitaciones de dominio) Семинар 3. Знакомство с языками программирования
Семинар 3. Знакомство с языками программирования Портрет слова
Портрет слова Техника выполнения стартов и поворотов
Техника выполнения стартов и поворотов Греко-персидские войны
Греко-персидские войны Отечественная война 1812 года и Дмитровский край 200 лет
Отечественная война 1812 года и Дмитровский край 200 лет Тест "Города России"
Тест "Города России" Потребление воды и минеральных ресурсов
Потребление воды и минеральных ресурсов Презентация на тему Семья и школа
Презентация на тему Семья и школа Табак - враг
Табак - враг Новогодняя викторина
Новогодняя викторина Микроволны от лаборатории до производства
Микроволны от лаборатории до производства АверьяновДО_3тур_Дзержинское
АверьяновДО_3тур_Дзержинское Презентация на тему Физиология гепато-билиарной системы
Презентация на тему Физиология гепато-билиарной системы  2022-08-22-hw-0-e0a5a6d6929cbccd3b7908a660a9ef04
2022-08-22-hw-0-e0a5a6d6929cbccd3b7908a660a9ef04 Опишите картинку
Опишите картинку ІНРЕГУЛЮВАННЯ РИНКУ
ІНРЕГУЛЮВАННЯ РИНКУ Российский рынок SaaS видео/веб конференций и вебинаров в 2011 году
Российский рынок SaaS видео/веб конференций и вебинаров в 2011 году Порядок действий при подаче требования в арбитраж
Порядок действий при подаче требования в арбитраж 1С:Предприятие 8. Управление автотранспортом Проф Презентация отраслевого решения
1С:Предприятие 8. Управление автотранспортом Проф Презентация отраслевого решения Feedback one punch
Feedback one punch