Слайд 2
Спиртами называются соединения, содержащие одну или несколько
гидроксильных групп. По их числу

спирты подразделяются на одноатомные,
двухатомные, трехатомные и т.д.
Длины связей и валентные углы в метиловом спирте приведены ниже.
Строение метилового спирта .
Валентные углы в 109о и 110о указывают на sp3-гибридизацию атома углерода,
две неподеленные пары электронов кислорода расположены на sp3-гибридных
орбиталях.
Слайд 3НОМЕНКЛАТУРА
Для спиртов существует несколько способов их названия. В современной
номенклатуре ИЮПАК для

названия спирта к названию углеводорода
добавляют окончание "ол". Самую длинную цепь, содержащую
функциональную ОН-группу, нумеруют с того конца, к которому ближе всего
находится гидроксильная группа, а заместители обозначаются в префиксе,
например:
Слайд 4В этой номенклатуре положение заместителя в алкильной группе
обозначается буквами греческого алфавита.
В

другой номенклатуре, называемой карбинольной, простейший спирт
CH3OH называется карбинол, остальные - как его производные.
Эта номенклатура удобна для самых простых спиртов, т.к. в ней легко
различаются первичные, вторичные и третичные спирты.
Слайд 5Метанол
Метано́л (метиловый спирт, древесный спирт, карбинол, метилгидрат,
гидроксид метила) — CH3OH, простейший одноатомный
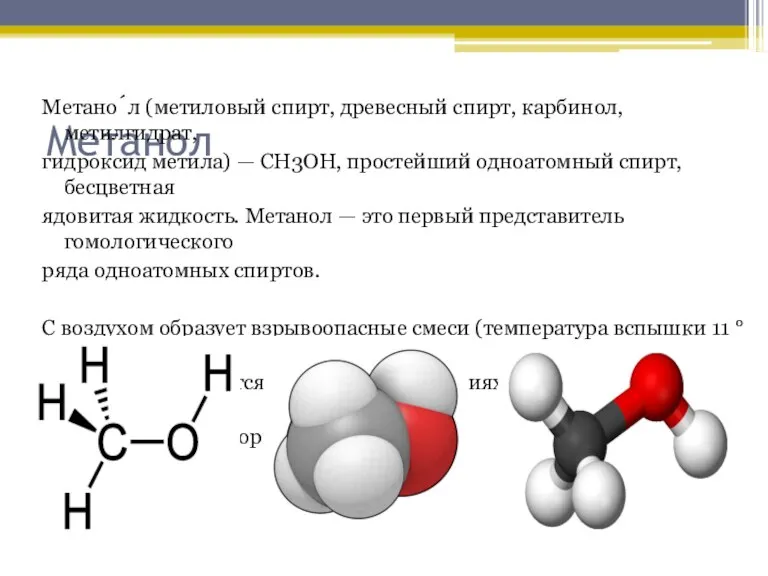
спирт, бесцветная
ядовитая жидкость. Метанол — это первый представитель гомологического
ряда одноатомных спиртов.
С воздухом образует взрывоопасные смеси (температура вспышки 11 °C).
Метанол смешивается в любых соотношениях с водой и большинством
органических растворителей.
Слайд 6Все спирты легче воды (плотность ниже единицы). Температура кипения
спиртов нормального строения повышается

с увеличением молекулярной
массы. Спирты нормального строения кипят при более высокой
температуре, чем спирты с изостроением.
В воде хорошо растворяются метиловый, этиловый и пропиловый спирты. С
увеличением молекулярной массы растворимость спиртов снижается.
Низшие спирты легче воспламеняются и горят бесцветным пламенем.
Спирты с большой молекулярной массой коптят при горении.
Температура кипения спиртов выше, чем галогеналкилов и углеводородов с
тем же числом углеродных атомов. Это объясняется тем, что молекулы
спирта, как и воды, являются ассоциированными жидкостями за счет
водородных связей, возникающих между молекулами:
. . . : H—O : . . . H—O : . . . H—O : . . .
| | |
R R R
Слайд 7Водородная связь оказывает большое влияние на физические
свойства спиртов.
Химические свойства. Основные химические
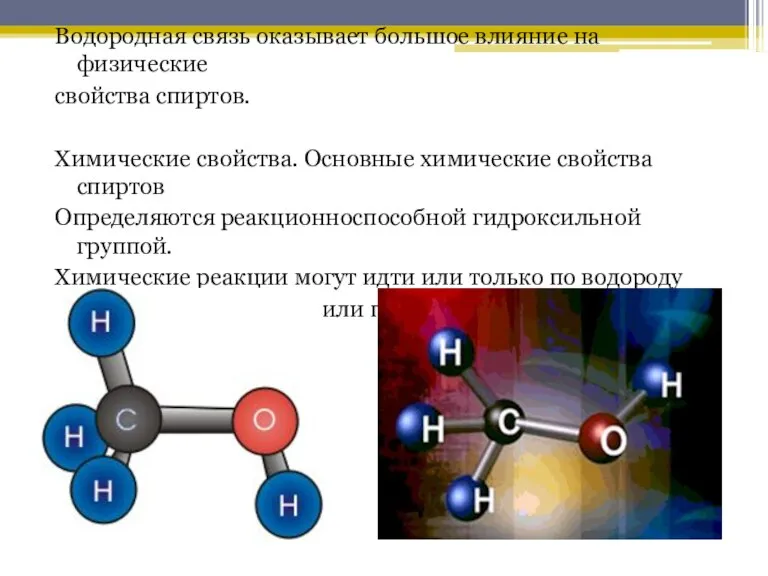
свойства спиртов
Определяются реакционноспособной гидроксильной группой.
Химические реакции могут идти или только по водороду
гидроксильной группы, или протекать с участием всей группы.
Слайд 8Здравоохранение
Метанол — яд, действующий на нервную и сосудистую системы. Токсическое
действие метанола обусловлено

так называемым «летальным синтезом» —
метаболическим окислением в организме до очень ядовитого
формальдегида. Приём внутрь 5—10 мл метанола приводит к тяжёлому
отравлению (одно из последствий — слепота), а 30 мл и более — к смерти.
Предельно допустимая концентрация метанола в воздухе равна 5
миллиграмм на кубический метр (то есть в 2 раза ниже, чем у этанола и
изопропилового спирта — 10).
Особая опасность метанола связана с тем, что по запаху и вкусу он
неотличим от этилового спирта, из-за чего и происходят случаи употребления метанола внутрь.
Этиловый спирт, этанол, винный спирт, C2H5OH; бесцветная подвижная жидкость с характерным запахом и жгучим вкусом.
По объему производства занимает одно из первых мест среди органических продуктов. До начала 30-х гг. 20 в. его получали исключительно сбраживанием пищевого углеводсодержащего сырья, главным образом зерна (рожь, ячмень, кукуруза, овес, просо), картофеля.







 Презентация на тему Боги Древнего Египта
Презентация на тему Боги Древнего Египта  Повторение. Четырёхугольники
Повторение. Четырёхугольники МОУ Тацинская СОШ №3
МОУ Тацинская СОШ №3 Презентация
Презентация Цветовое оформление интерьера
Цветовое оформление интерьера Понятие , признаки и форма государства. Лекция 1
Понятие , признаки и форма государства. Лекция 1 Typical English Houses
Typical English Houses СПО: осознание необходимости Алексей Новодворский, ALT Linux
СПО: осознание необходимости Алексей Новодворский, ALT Linux Методика обучения
Методика обучения Сессия стратегического планирования
Сессия стратегического планирования Презентация на тему Борьба организма с инфекцией Иммунитет
Презентация на тему Борьба организма с инфекцией Иммунитет 1 Место и роль Рекламной Сети Яндекса в линейке его рекламных продуктов Евгений Ломизе Управление аудиторией и реклама в Интернете
1 Место и роль Рекламной Сети Яндекса в линейке его рекламных продуктов Евгений Ломизе Управление аудиторией и реклама в Интернете КАЗАНСКИЙ АВИАЦИОННО- ТЕХНИЧЕСКИЙ КОЛЛЕДЖ им П.В. ДЕМЕНТЬЕВА
КАЗАНСКИЙ АВИАЦИОННО- ТЕХНИЧЕСКИЙ КОЛЛЕДЖ им П.В. ДЕМЕНТЬЕВА Храмы Саратова 3 класс
Храмы Саратова 3 класс Диагностика, коррекция, прогнозирование предметной обученности.
Диагностика, коррекция, прогнозирование предметной обученности. Алгоритмизация_Л1
Алгоритмизация_Л1 Красная книга Алькеевского района. Птицы
Красная книга Алькеевского района. Птицы Обзор-анонс Все для женщин (10,11,12. 2019)
Обзор-анонс Все для женщин (10,11,12. 2019) Презентация на тему Нанотехнологии в химии
Презентация на тему Нанотехнологии в химии Гимнастика
Гимнастика Public Opinion Media Chapter
Public Opinion Media Chapter  Бианки "Первая охота" (1 класс)
Бианки "Первая охота" (1 класс) Диагностика состояния фонематического слуха и фонематического восприятия
Диагностика состояния фонематического слуха и фонематического восприятия Гетероциклы
Гетероциклы Young and Beautiful
Young and Beautiful Перикл
Перикл Где логика. Пословицы и поговорки
Где логика. Пословицы и поговорки Франция
Франция