Содержание
- 2. Al2O3 - 2 x 3·(-2) + 2·x = 0 - 6 + 2·x = 0 2·x
- 3. Сu О + 2 HCl → CuCl2 + H2O +2 -2 +1 -1 +2 -1 +1
- 4. CuO + CO → Cu + CO2 +2 -2 +2 -2 0 +4 -2 Химические реакции,
- 5. По изменению степеней окисления химических элементов химические реакции делят на две группы: Окислительно-восстановительные Не окислительно -
- 6. Составление уравнений окислительно - восстановительных реакций методом электронного баланса
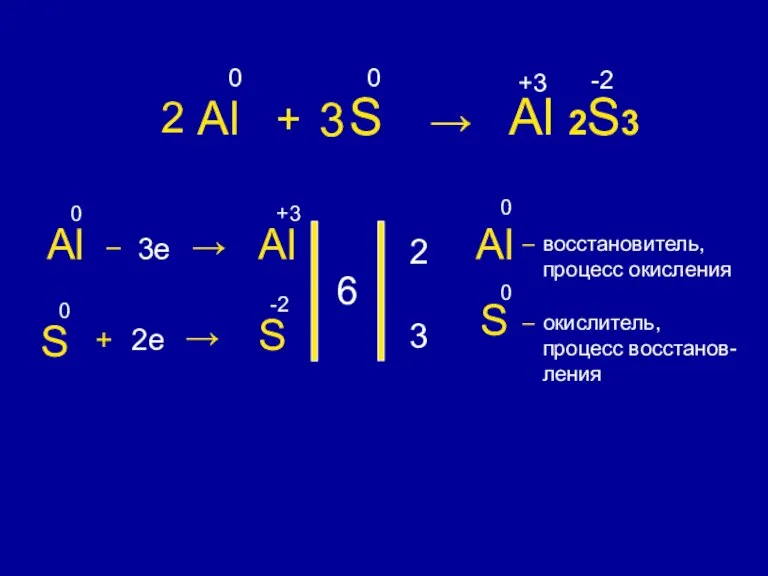
- 7. Al + S → Al 2S3 0 0 +3 -2 Al 0 – 3e → Al
- 8. Восстановитель – элемент, который отдает электроны. Окислитель – элемент, который принимает электроны. S – 2e →
- 9. Процесс окисления – это процесс отдачи электронов. Процесс восстановления – это процесс присоединения электронов. S –
- 10. Значение окислительно- восстановительных реакций
- 11. Лесные пожары C + O2 → CO2
- 12. фотосинтез О2 О2 О2 О2 CO2 + H2O → C6H12O6 + O2
- 13. Коррозия металлов Fe +H2O +O2 → Fe(OH)3
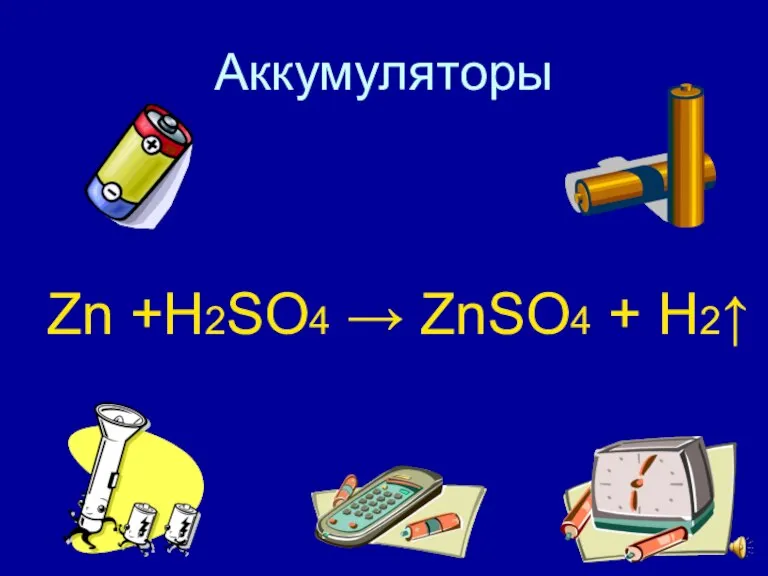
- 14. Аккумуляторы Zn +H2SO4 → ZnSO4 + H2↑
- 15. Извержение вулканов S + O2 → SO2
- 16. Сгорание топлива
- 17. Брожение глюкозы Бродильный цех C6H12O6 → C2H5OH + CO2
- 18. Взрывчатые вещества P + KClO3 → P2O5 + KCl
- 19. Салют Fe + O2 → Fe2O3
- 21. Скачать презентацию
















 Жакулина Ирина Валентиновна, учитель начальных классов МОУ-ООШ 23 г.Чапаевска Самарской области, рук.ТГ «Начальная школа» професси
Жакулина Ирина Валентиновна, учитель начальных классов МОУ-ООШ 23 г.Чапаевска Самарской области, рук.ТГ «Начальная школа» професси Экологическое право
Экологическое право Банда GTA - кошмар российских дорог
Банда GTA - кошмар российских дорог Овощи-микс. Хлебцы от Fazer
Овощи-микс. Хлебцы от Fazer Recoupement plans
Recoupement plans Система продажи пассажирских железнодорожных перевозок в СВВТ
Система продажи пассажирских железнодорожных перевозок в СВВТ Химический состав губной помады
Химический состав губной помады Презентация на тему Презентация учителя-дефектолога
Презентация на тему Презентация учителя-дефектолога Презентация на тему Андропов
Презентация на тему Андропов  Сочинение по картине О. Кипренского "Портрет Натальи Викторовны Кочубей"
Сочинение по картине О. Кипренского "Портрет Натальи Викторовны Кочубей" Итоги 2010
Итоги 2010 В гостях у Сороки - Вороны
В гостях у Сороки - Вороны Контроллер машиниста. Назначение, устройство
Контроллер машиниста. Назначение, устройство Экономическое обоснование использования современных средств индивидуальной защиты
Экономическое обоснование использования современных средств индивидуальной защиты Понятия и виды государственной службы
Понятия и виды государственной службы Профессиональное прогнозирование личности с помощью психодиагностических методик
Профессиональное прогнозирование личности с помощью психодиагностических методик Конфликты. Субъекты конфликтов
Конфликты. Субъекты конфликтов Координация бизнеса. Часть 2
Координация бизнеса. Часть 2 Юридическая компания Талион
Юридическая компания Талион Презентация на тему Методология и методы научного исследования
Презентация на тему Методология и методы научного исследования  The House of Parliament and Westminster Abbey
The House of Parliament and Westminster Abbey 20170623_zhivi_rodnaya_rechushka
20170623_zhivi_rodnaya_rechushka Роль цвета в портрете
Роль цвета в портрете Равный доступ детей к качественному образованию: от интеграции – к инклюзии (из опыта работы)
Равный доступ детей к качественному образованию: от интеграции – к инклюзии (из опыта работы) Практика американского семейного врача
Практика американского семейного врача BENVENUTI IN
BENVENUTI IN С чего начать свое дело: бизнес-план (пошаговая инструкция: как составить бизнес-план)
С чего начать свое дело: бизнес-план (пошаговая инструкция: как составить бизнес-план) Понятие и классификация прав и свобод человека. Международные стандарты в области прав и свобод человека
Понятие и классификация прав и свобод человека. Международные стандарты в области прав и свобод человека