Содержание
- 2. Оксид алюминия Al2O3 Рубин Рубин Сапфир Корунд (глинозем) – по твердости не уступает алмазу Чистый корунд
- 3. Оксид алюминия Al2O3 + оксид кремния SiO2 Глина – это мельчайшие кристаллы минерала каолинита Состав: оксид
- 4. ОКСИДЫ – сложные вещества, молекулы которых состоят из атомов двух элементов, один из которых – кислород,
- 5. ОКСИДЫ – сложные вещества, молекулы которых состоят из атомов двух элементов, один из которых – кислород,
- 6. ОКСИДЫ – сложные вещества, молекулы которых состоят из атомов двух элементов, один из которых – кислород,
- 7. Составь формулы и назови Na O Са O Al O Na2O Al2O3 СаO
- 8. Определи валентность SO2 Fe2O3 N2O
- 9. Найди соответствие 1. SO3 2. P2O5 3. CaO 4. P2O3 5. SO2 6. CO 6. оксид
- 10. Физические свойства оксидов Агрегатное состояние газообразное жидкое твердое
- 11. Физические свойства оксидов Цвет Чёрный Белый Красный Зеленый Бесцветный
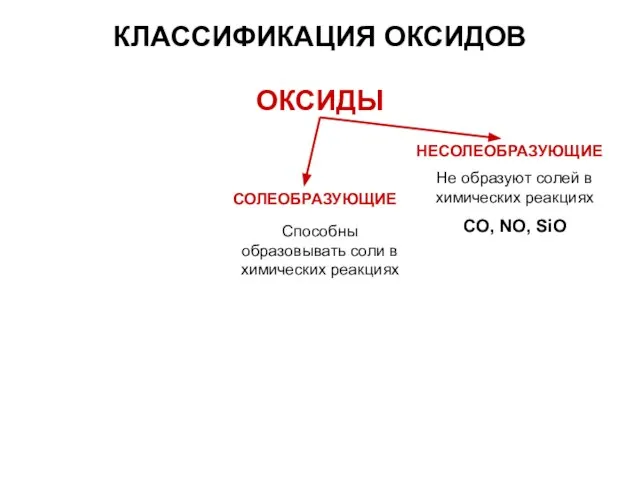
- 12. КЛАССИФИКАЦИЯ ОКСИДОВ ОКСИДЫ СОЛЕОБРАЗУЮЩИЕ НЕСОЛЕОБРАЗУЮЩИЕ Не образуют солей в химических реакциях CO, NO, SiO Способны образовывать
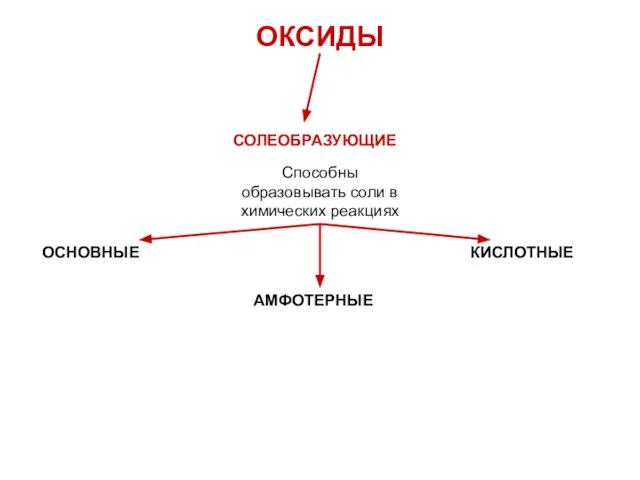
- 13. ОКСИДЫ СОЛЕОБРАЗУЮЩИЕ Способны образовывать соли в химических реакциях ОСНОВНЫЕ КИСЛОТНЫЕ АМФОТЕРНЫЕ
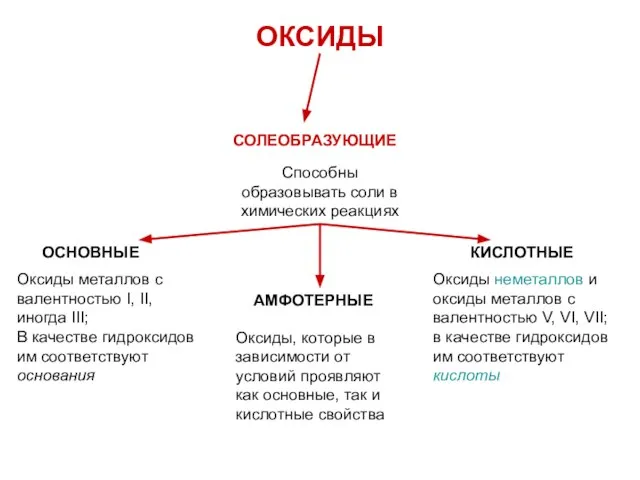
- 14. ОКСИДЫ СОЛЕОБРАЗУЮЩИЕ Способны образовывать соли в химических реакциях ОСНОВНЫЕ КИСЛОТНЫЕ АМФОТЕРНЫЕ Оксиды металлов с валентностью I,
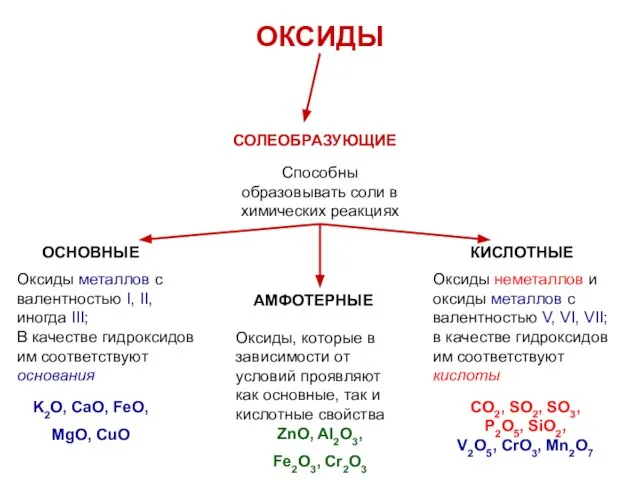
- 15. ОКСИДЫ СОЛЕОБРАЗУЮЩИЕ Способны образовывать соли в химических реакциях ОСНОВНЫЕ КИСЛОТНЫЕ АМФОТЕРНЫЕ Оксиды металлов с валентностью I,
- 16. ПОЛУЧЕНИЕ ОКСИДОВ 1. ВЗАИМОДЕЙСТВИЕМ ПРОСТЫХ ВЕЩЕСТВ С КИСЛОРОДОМ Mg + O2 = Ca + O2 =
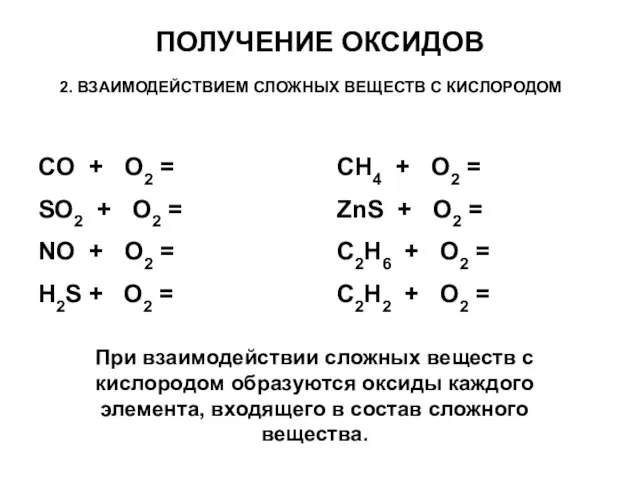
- 17. ПОЛУЧЕНИЕ ОКСИДОВ 2. ВЗАИМОДЕЙСТВИЕМ СЛОЖНЫХ ВЕЩЕСТВ С КИСЛОРОДОМ CO + O2 = SO2 + O2 =
- 18. Оксид углерода(IV) СO2 Углекислый газ
- 19. Угарный газ Угарный газ бесцветен и не имеет запаха, поэтому отравление угарным газом чаще всего происходит
- 20. уникальный растворитель В организме человека она занимает около 65% Без воды нет жизни на Земле А
- 22. Скачать презентацию














 Подарочный сертификат на комплекс услуг медицинского центра Bioniclinic
Подарочный сертификат на комплекс услуг медицинского центра Bioniclinic Путешествие в страну Внутренний мир человека
Путешествие в страну Внутренний мир человека Высшие сахара.
Высшие сахара. Вышивка тамбурным швом
Вышивка тамбурным швом Персональный стиль
Персональный стиль Электромагнитные волны 11 класс
Электромагнитные волны 11 класс Prevention of waste
Prevention of waste Презентация на тему РАСТЕНИЯ- ЗЕЛЁНАЯ ОДЕЖДА ЗЕМЛИ
Презентация на тему РАСТЕНИЯ- ЗЕЛЁНАЯ ОДЕЖДА ЗЕМЛИ  Рисование фигур одним росчерком
Рисование фигур одним росчерком Процесс разработки ПО
Процесс разработки ПО КНДР
КНДР Темы обсуждения Эффективность обучения, и чем она отличается от результативности Традиционные формы корпоративного обучения
Темы обсуждения Эффективность обучения, и чем она отличается от результативности Традиционные формы корпоративного обучения "Мы рисуем улицу"
"Мы рисуем улицу" Монополия
Монополия  Материаловедение -5 класс
Материаловедение -5 класс ceee2d1a6089239879a53404b2515b09
ceee2d1a6089239879a53404b2515b09 Проект производства работ по монтажу
Проект производства работ по монтажу Стратегическое планирование
Стратегическое планирование Единый Государственный экзамен
Единый Государственный экзамен Украинцы в Саратовской области
Украинцы в Саратовской области Scouting in the World
Scouting in the World lightning
lightning  Урок физики «Закон всемирного тяготения. Искусственные спутники Земли». 10 класс. Игнатова Е.С. Учитель физики МОУ СОШ № 16 г.Кропот
Урок физики «Закон всемирного тяготения. Искусственные спутники Земли». 10 класс. Игнатова Е.С. Учитель физики МОУ СОШ № 16 г.Кропот Stuart Lawson. Senior advisor
Stuart Lawson. Senior advisor Лингвокультурология как научная и учебная дисциплина
Лингвокультурология как научная и учебная дисциплина Актуальность социально-психологического климата диктуется запросами практики, обусловленные усилившимся в наши дни коллективны
Актуальность социально-психологического климата диктуется запросами практики, обусловленные усилившимся в наши дни коллективны Непрерывное образование в системе «колледж-ВУЗ»инновационно-образовательныйпроект
Непрерывное образование в системе «колледж-ВУЗ»инновационно-образовательныйпроект Твои права
Твои права