Содержание
- 2. Основные понятия и законы химии
- 3. Содержание Основные понятия химии…………………………………. 3 Состав веществ. Изменение веществ………………… 8 Основные законы химии......................................... 24 Обозначения, названия
- 4. Основные понятия химии.
- 5. Химия – это наука о составе, строении, свойствах и превращениях веществ. Вещество – один из видов
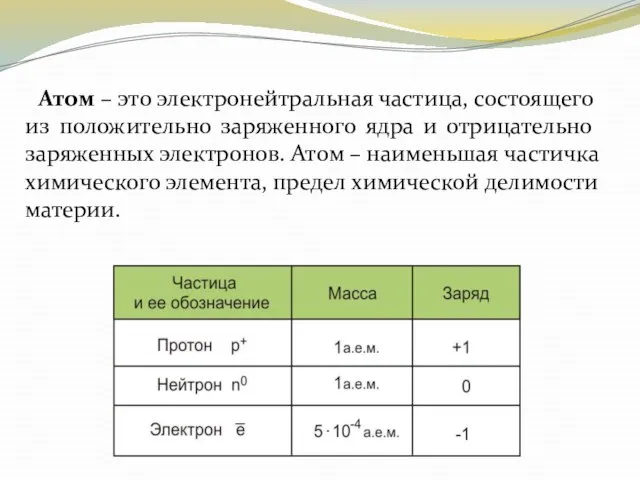
- 6. Атом – это электронейтральная частица, состоящего из положительно заряженного ядра и отрицательно заряженных электронов. Атом –
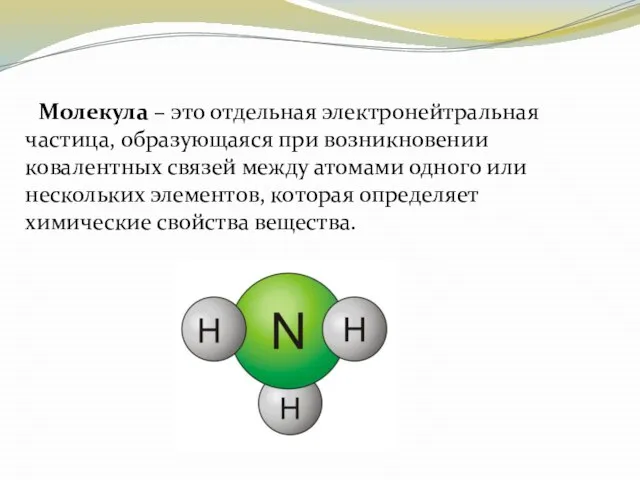
- 7. Молекула – это отдельная электронейтральная частица, образующаяся при возникновении ковалентных связей между атомами одного или нескольких
- 8. Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Вещества, образованные одним химическим элементом, называют
- 9. Состав веществ. Изменение веществ.
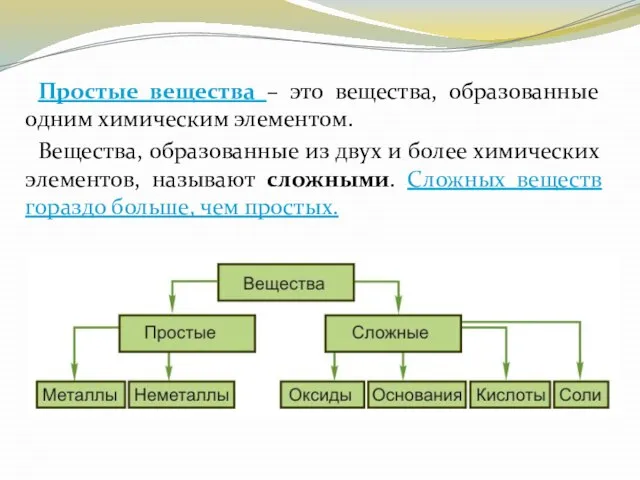
- 10. Простые вещества – это вещества, образованные одним химическим элементом. Вещества, образованные из двух и более химических
- 11. Различают в качественный и количественный состав веществ. Качественный состав – это совокупность химических элементов и (или)
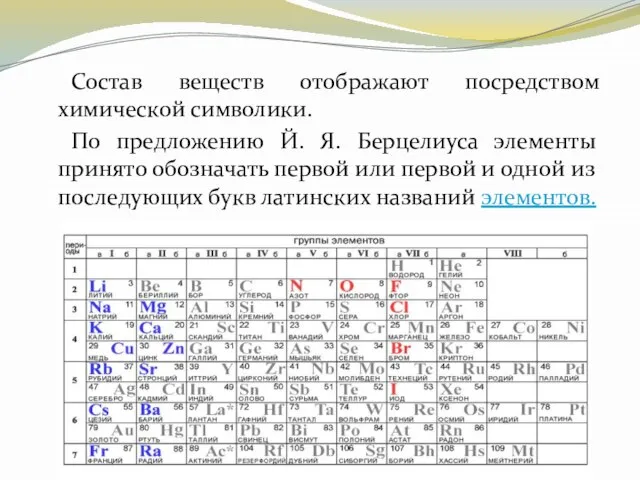
- 12. Состав веществ отображают посредством химической символики. По предложению Й. Я. Берцелиуса элементы принято обозначать первой или
- 13. Химический знак (символ) – несет значительную информацию. Он обозначает название элемента, один его атом, один моль
- 14. Химическая формула – это способ отображения химического состава вещества. Она обозначает название вещества, одну молекулу его,
- 15. Формулы вещества составляют на основании еще одного важнейшего понятия в химии – валентности. Валентность – это
- 16. Широко используются несколько видов химических формул: Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых
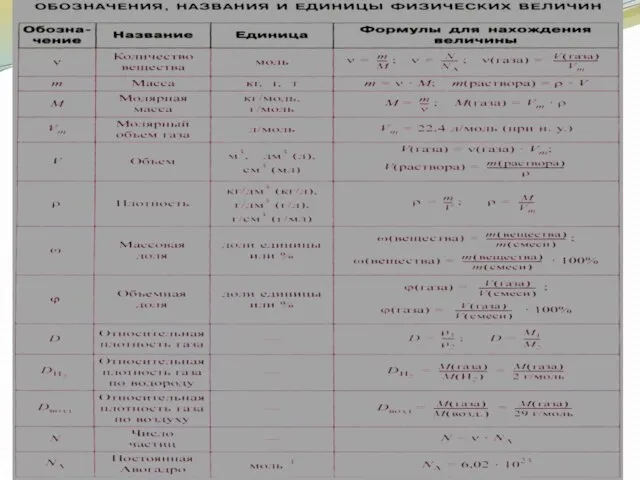
- 17. Относительная атомная масса ( ) химического элемента – это величина, показывающая отношение средней массы атома природной
- 18. Относительная атомная масса – одна из основных характеристик химического элемента. Относительная молекулярная масса ( ) равна
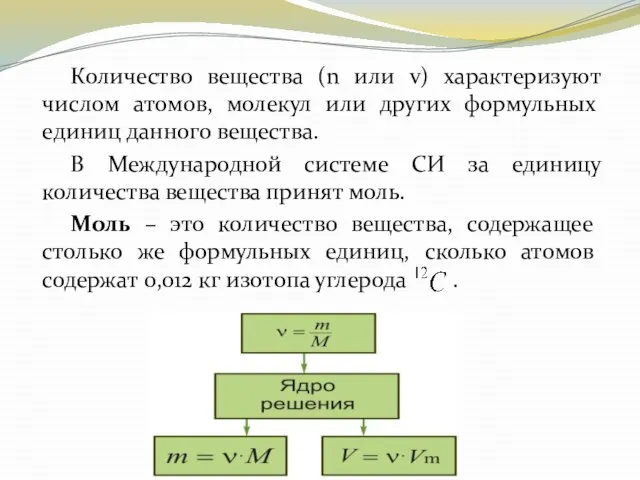
- 19. Количество вещества (n или v) характеризуют числом атомов, молекул или других формульных единиц данного вещества. В
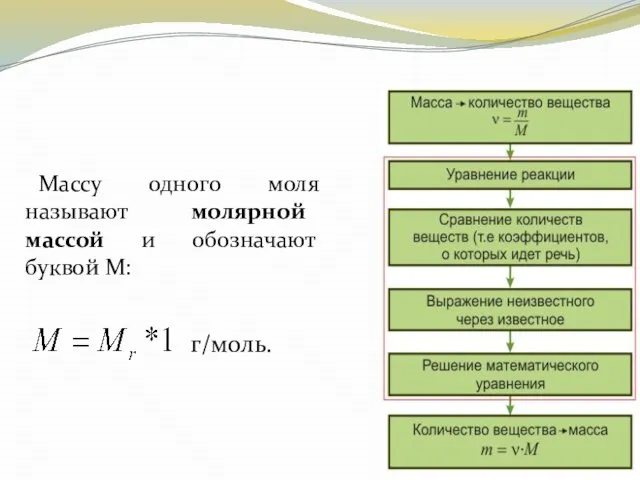
- 21. Массу одного моля называют молярной массой и обозначают буквой М:
- 23. Молярная масса может быть выражена через число молекул (или атомов) в одном моле вещества ( )
- 24. Из этого выражения можно определить число молекул или атомов, содержащихся в одном месте любого вещества, которое
- 25. Основные законы химии
- 26. Закон сохранения массы. Был открыт М. В. Ломоносовым и сформулирован А. Лавуазье: Масса веществ, вступивших в
- 27. Стехиометрия – раздел химии, в котором рассматриваются массовые и объемные соотношения между реагирующими веществами, вывод химических
- 28. Закон постоянства состава вещества. Сформулирован Ж.-Л. Прустом в 1799 г.: Всякое чистое вещество независимо от способа
- 29. Современная формулировка закона постоянства состава вещества таков: Состав соединений молекулярной структуры является постоянным независимо от способа
- 30. Вещества постоянного состава называют дальтонидами в честь английского физика и химика Дж. Дальтона, а вещества переменного
- 31. Закон Авогадро. Сформулирован А. Авогадро в результате проведения многочисленных экспериментов: В равных объемах различных газов при
- 32. Из закона Авогадро вытекают 2 следствия: Один моль любого газа при одинаковых условиях занимает один и
- 33. Массы двух разных газов, занимающих одинаковый объем при одинаковых условиях, относятся между собой как их молярные
- 34. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). или где p – давление; V – объем газа; m
- 35. Основные законы химии
- 36. Найдите относительные молекулярные массы веществ, состав которых описывается формулами: Рассчитайте относительные молекулярные массы медного купороса и
- 37. Сколько молекул содержится в 32 г сернистого газа ? Какова масса молекул аммиака ? Какова масса
- 39. Скачать презентацию





























 Откуда берётся и куда девается мусор
Откуда берётся и куда девается мусор Иллюстрации к повести Куприна «Гранатовый браслет». Кадры из фильма.
Иллюстрации к повести Куприна «Гранатовый браслет». Кадры из фильма. Духовная жизнь страны
Духовная жизнь страны Защити себя сама
Защити себя сама Начальная школа XXI века «Окружающий мир» авт. Н.Ф. Виноградова 1 класс.
Начальная школа XXI века «Окружающий мир» авт. Н.Ф. Виноградова 1 класс. Научно-технические журналы строительного комплекса – славная история,трудное настоящее,неопределенное будущее
Научно-технические журналы строительного комплекса – славная история,трудное настоящее,неопределенное будущее Зарубежная литература эпохи Просвещения
Зарубежная литература эпохи Просвещения Обращение в Европейский суд по правам человека: критерии приемлемости жалобы, правила обращения
Обращение в Европейский суд по правам человека: критерии приемлемости жалобы, правила обращения Школьная площадка МБОУ Марининской СОШ № 16
Школьная площадка МБОУ Марининской СОШ № 16 Моральные требования, предъявляемые к юридической профессии
Моральные требования, предъявляемые к юридической профессии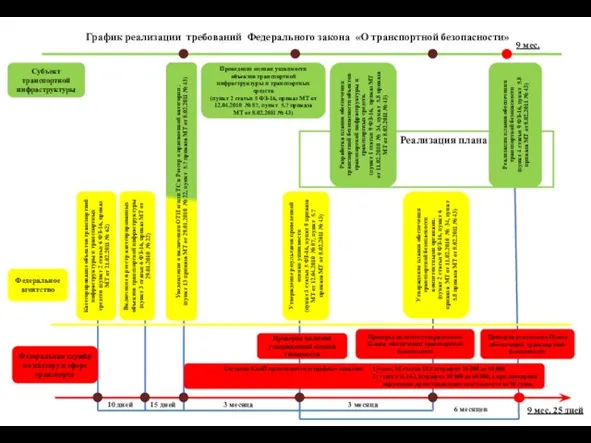 Реализация плана
Реализация плана Аттестация педагогических работников государственных и муниципальных образовательных учреждений Санкт-Петербург
Аттестация педагогических работников государственных и муниципальных образовательных учреждений Санкт-Петербург Виды дорожно-транспортных проишевствий
Виды дорожно-транспортных проишевствий Преимущества МС для ИС
Преимущества МС для ИС Операции по управлению персоналом
Операции по управлению персоналом Презентация на тему А.С. Пушкин
Презентация на тему А.С. Пушкин  История развития туризма и гостеприимства
История развития туризма и гостеприимства Развитие инновационной экономики. Инвестирование в высокотехнологичные проекты на раннем этапе развития
Развитие инновационной экономики. Инвестирование в высокотехнологичные проекты на раннем этапе развития Растениеводство
Растениеводство Укрепление системы органов внутренних дел во второй половине 1960-х - 1980-е гг
Укрепление системы органов внутренних дел во второй половине 1960-х - 1980-е гг Урок литературного чтения
Урок литературного чтения Творческий путь Федора Ивановича Тютчева
Творческий путь Федора Ивановича Тютчева Стихи и загадки про цифры
Стихи и загадки про цифры Турбулентные газопромыватели. (Лекция 13)
Турбулентные газопромыватели. (Лекция 13) Электронной Библиотеке - Электронный Абонемент
Электронной Библиотеке - Электронный Абонемент Словари
Словари Василий Васильевич Кандинский (16 декабря 1866 -13 декабря 1944 )
Василий Васильевич Кандинский (16 декабря 1866 -13 декабря 1944 ) Избавляемся от статического электричества
Избавляемся от статического электричества