Содержание
- 2. Цели урока: Обучающие: изучить строение основных соединений серы; изучить распространение соединений серы в природе, применение основных
- 3. Основные соединения серы: Н2S – сероводород; SO2 - серный газ; SO3 -сернистый ангидрид; Н2SO3 - сернистая
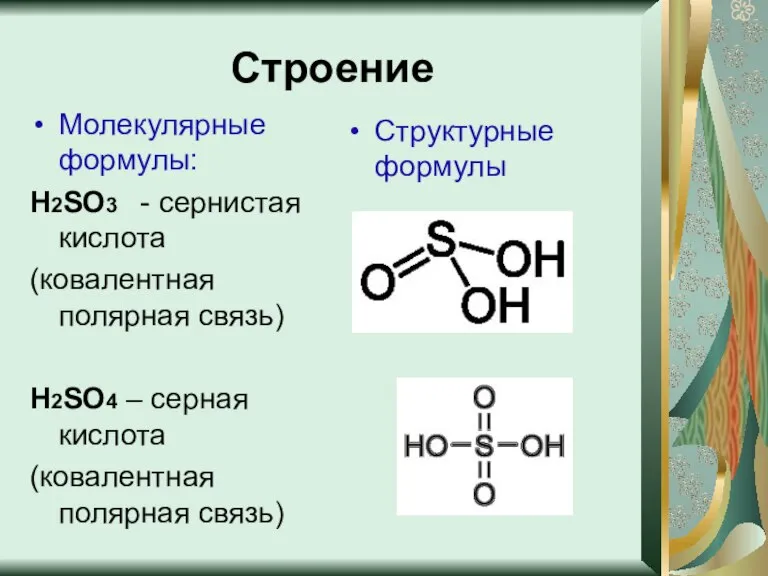
- 4. Строение Молекулярные формулы: Н2SO3 - сернистая кислота (ковалентная полярная связь) Н2SO4 – серная кислота (ковалентная полярная
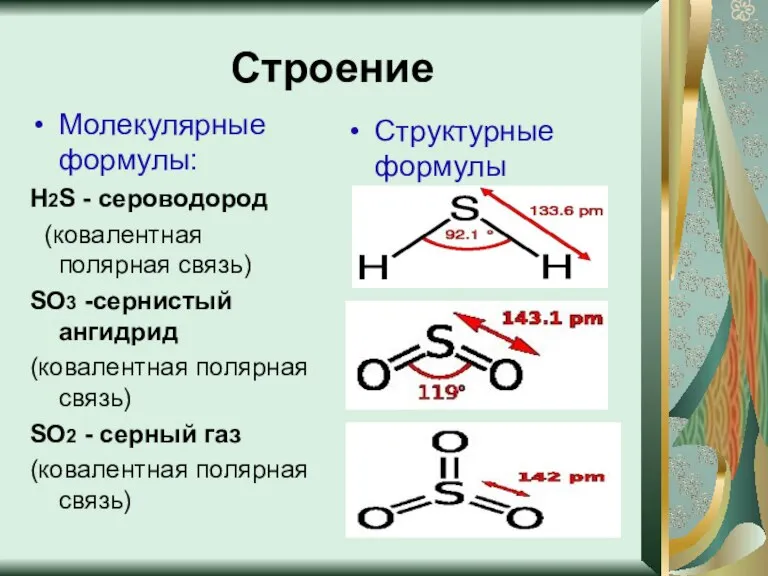
- 5. Строение Молекулярные формулы: Н2S - сероводород (ковалентная полярная связь) SO3 -сернистый ангидрид (ковалентная полярная связь) SO2
- 6. Гидросульфиды NaHS- гидросульфид натрия Ba(HS)2- гидросульфид бария Сульфиды Na2S – сульфид натрия ZnS – сульфид цинка
- 7. Серная кислоты – H2SO4 Плотность серной кислоты – 1,84 г /см3, Концентрированная серная кислота – это
- 9. СЕРОВОДОРОД Бесцветный газ с резким запахом тухлых яиц Термически неустойчив, плохо растворим в воде. Лучше, чем
- 10. Сернистый газ SO2 – сернистый газ. Очень токсичен. В нормальных условиях представляет собой бесцветный газ с
- 11. H2S является очень слабой кислотой: H2S → HS− + H+ Сероводород — сильный восстановитель. На воздухе
- 12. SO3 — типичный кислотный оксид, ангидрид серной кислоты 1. Кислотно-основные: При взаимодействии с водой образует серную
- 14. Нахождение соединений серы в природе Самородная сера Сульфидная сера Сульфатная сера Киноварь HgS PbS Галенит CuFeS2
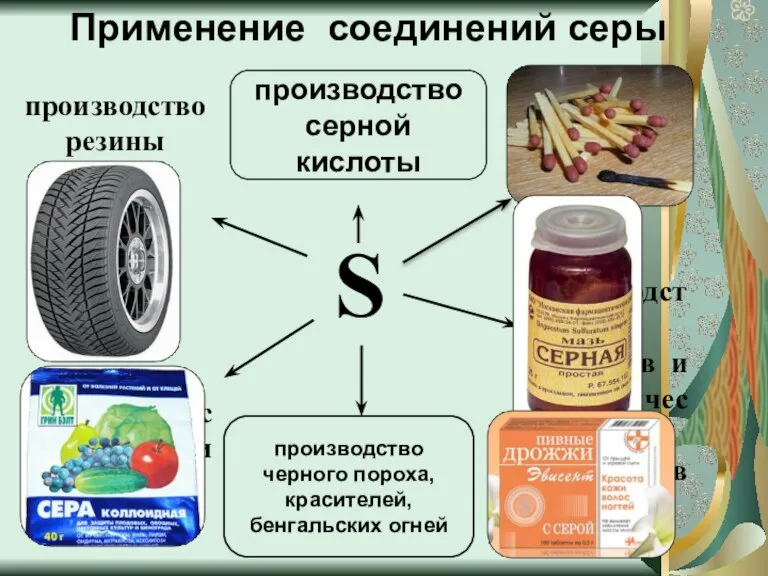
- 15. Применение соединений серы S производство лекарств и косметических препаратов для борьбы с вредителями растений производство резины
- 17. Скачать презентацию











 Опасные места
Опасные места 20140317_merzlikinaip_doc
20140317_merzlikinaip_doc ВИЧ и СПИД
ВИЧ и СПИД Анатомия
Анатомия Электронный документооборот как инструмент борьбы с бюрократией
Электронный документооборот как инструмент борьбы с бюрократией Винсент Виллем ван Гог
Винсент Виллем ван Гог Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие
Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие Преобразования фигур в пространстве
Преобразования фигур в пространстве Предельные одноосновные карбоновые кислоты. Сложные эфиры
Предельные одноосновные карбоновые кислоты. Сложные эфиры Дизайн. Коллаборация. Цифровые технологии. Кейс №3 Перерождение одного изделия в другое
Дизайн. Коллаборация. Цифровые технологии. Кейс №3 Перерождение одного изделия в другое Презентация на тему ДЕЙСТВИЕ ТАБАКА НА ОРГАНИЗМ ЧЕЛОВЕКА
Презентация на тему ДЕЙСТВИЕ ТАБАКА НА ОРГАНИЗМ ЧЕЛОВЕКА  Where is the dog?
Where is the dog? . 1)Прочитать числа: 509, 6001, 90050, 7000850127, 620022. Назвать в каждом из чисел цифру в разряде десятков, сотен. Какие из чисел меньше 1000? 2)Найти
. 1)Прочитать числа: 509, 6001, 90050, 7000850127, 620022. Назвать в каждом из чисел цифру в разряде десятков, сотен. Какие из чисел меньше 1000? 2)Найти ООО ГарантСтройХаус
ООО ГарантСтройХаус Пончики Пончкофф (фотографии)
Пончики Пончкофф (фотографии) Определение культуры. Типы культур
Определение культуры. Типы культур Искусства бумагокручения
Искусства бумагокручения Технологический процесс ручной дуговой сварки листовых конструкций из стали (ст-3пс)
Технологический процесс ручной дуговой сварки листовых конструкций из стали (ст-3пс) МЫ СКОРО УЙДЁМ СО ШКОЛЬНОГО ДВОРА…
МЫ СКОРО УЙДЁМ СО ШКОЛЬНОГО ДВОРА… Эффективные приёмы запоминания учебного материала
Эффективные приёмы запоминания учебного материала Административно-правовой статус
Административно-правовой статус Развитие личности младшего школьника средствами учебного диалога
Развитие личности младшего школьника средствами учебного диалога БЭК-ОФИС СОЗДАНИЕ, РАЗВИТИЕ, АВТОМАТИЗАЦИЯ
БЭК-ОФИС СОЗДАНИЕ, РАЗВИТИЕ, АВТОМАТИЗАЦИЯ Внеурочная работа по математике
Внеурочная работа по математике Слайды
Слайды ГОГОЛЬ: знакомый и незнакомый
ГОГОЛЬ: знакомый и незнакомый The Cable News Network
The Cable News Network Сила. Основы методики ее воспитания
Сила. Основы методики ее воспитания