Содержание
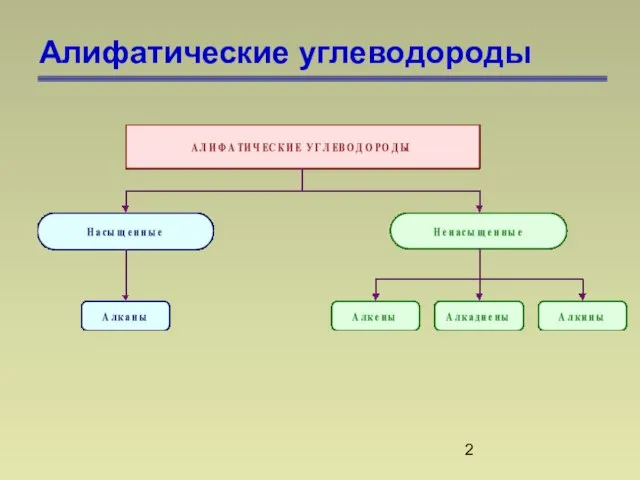
- 2. Алифатические углеводороды
- 3. Алканы Алканами называются насыщенные углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных между собой
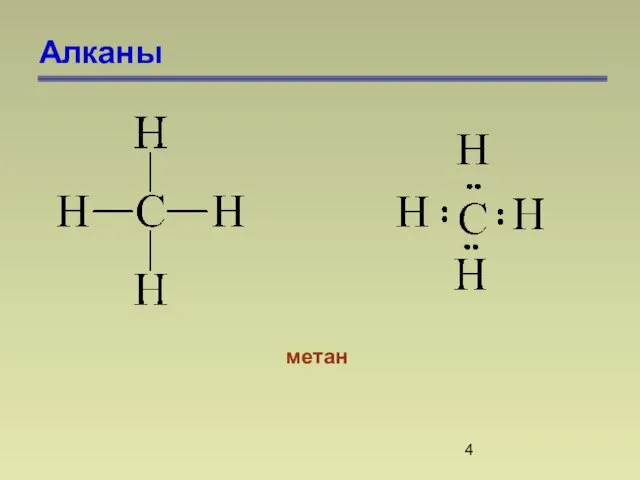
- 4. Алканы метан
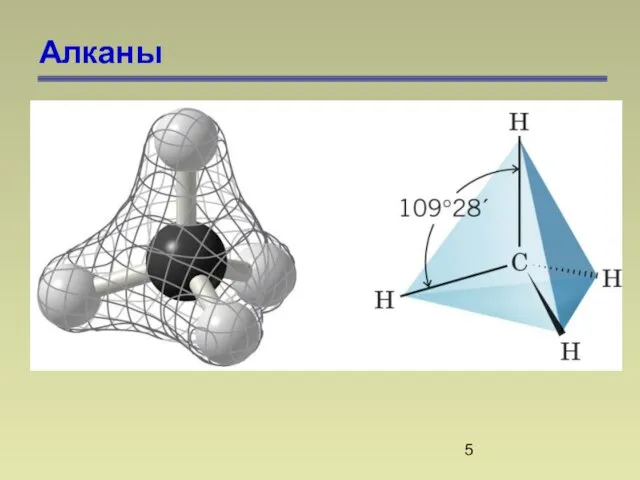
- 5. Алканы
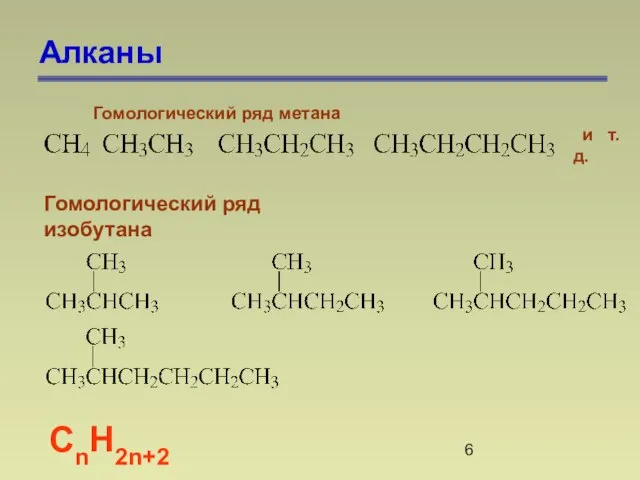
- 6. Алканы СnН2n+2
- 7. Алканы. Номенклатура. Названия нормальных алканов по заместительной номенклатуре
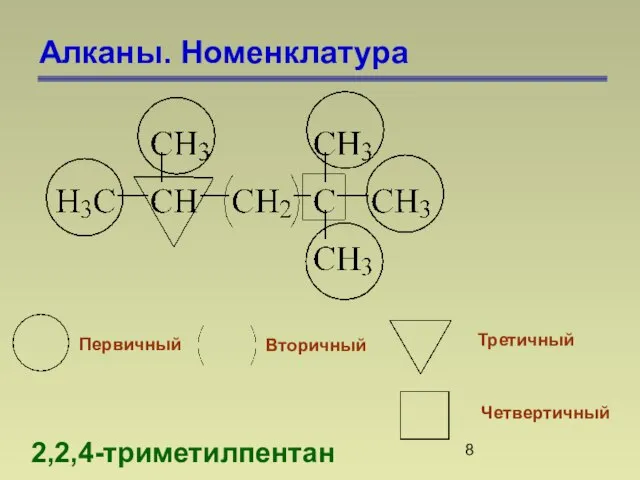
- 8. Алканы. Номенклатура 2,2,4-триметилпентан Первичный Вторичный Третичный Четвертичный
- 9. Алканы. Номенклатура
- 10. Алканы. Номенклатура 1) определяют самую длинную цепь атомов углерода. Число атомов углерода в этой цепи служит
- 11. Алканы. Номенклатура 4) при наличии двух и более заместителей нумерацию цепи производят так, чтобы заместители получили
- 12. Алканы. Номенклатура 3,5-диметил-3-этилоктан
- 13. Алканы. Номенклатура 2,3,4-триметилпентан
- 14. Алканы. Номенклатура 2,3,6-триметилгептан
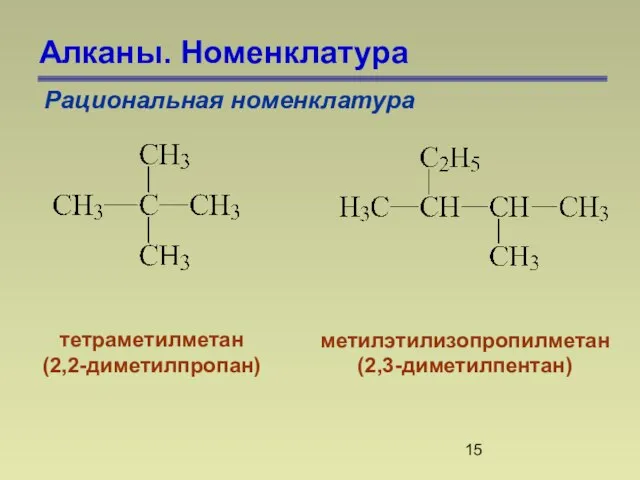
- 15. Алканы. Номенклатура Рациональная номенклатура тетраметилметан (2,2-диметилпропан) метилэтилизопропилметан (2,3-диметилпентан)
- 16. Алканы. Номенклатура Структурная изомерия
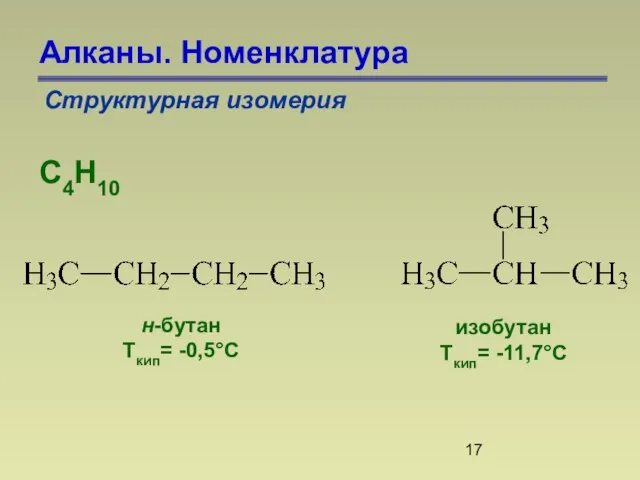
- 17. Алканы. Номенклатура Структурная изомерия С4Н10 н-бутан Ткип= -0,5°С изобутан Ткип= -11,7°С
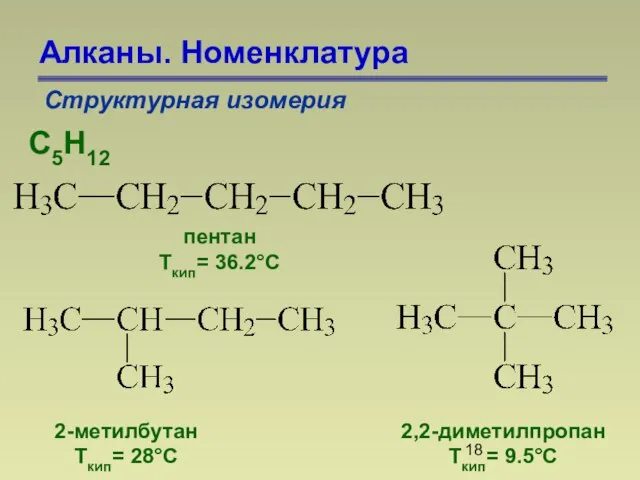
- 18. Алканы. Номенклатура Структурная изомерия С5Н12 пентан Ткип= 36.2°С 2-метилбутан Ткип= 28°С 2,2-диметилпропан Ткип= 9.5°С
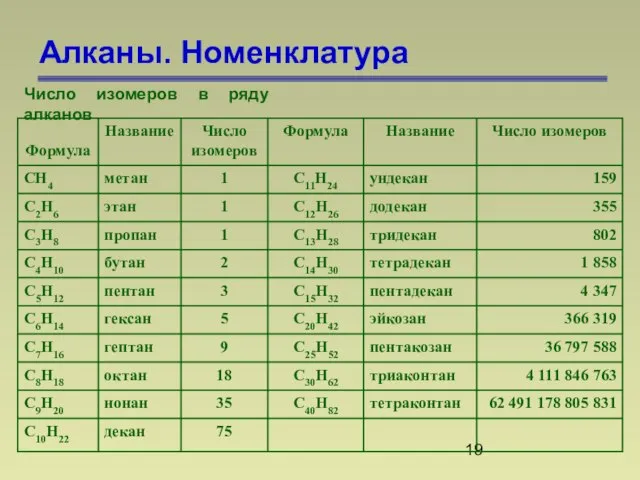
- 19. Алканы. Номенклатура Число изомеров в ряду алканов
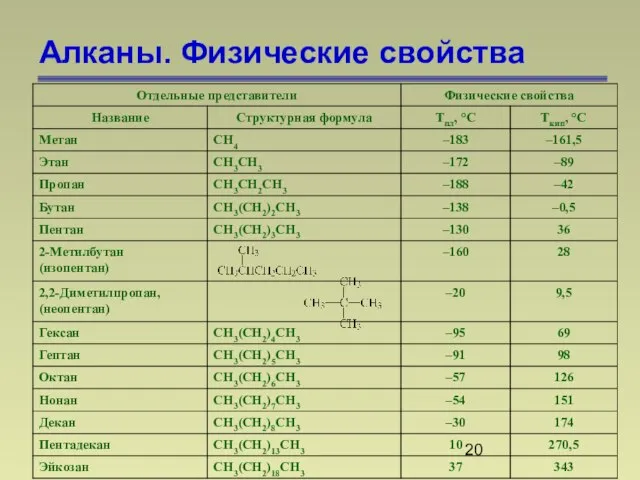
- 20. Алканы. Физические свойства
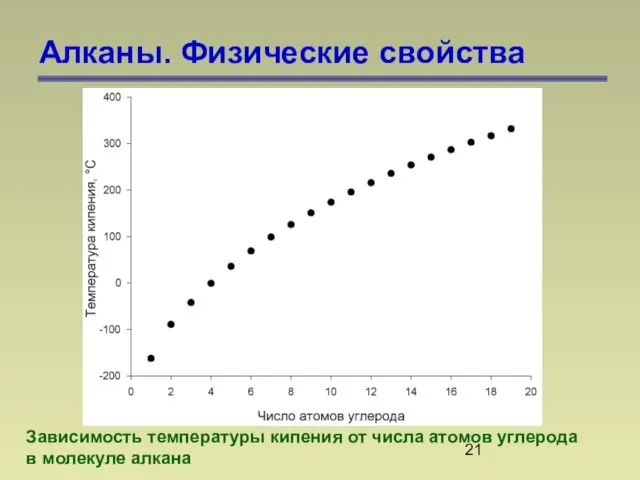
- 21. Алканы. Физические свойства Зависимость температуры кипения от числа атомов углерода в молекуле алкана
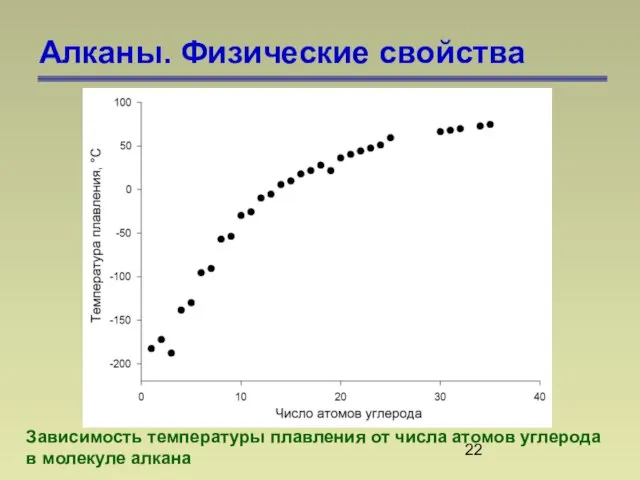
- 22. Алканы. Физические свойства Зависимость температуры плавления от числа атомов углерода в молекуле алкана
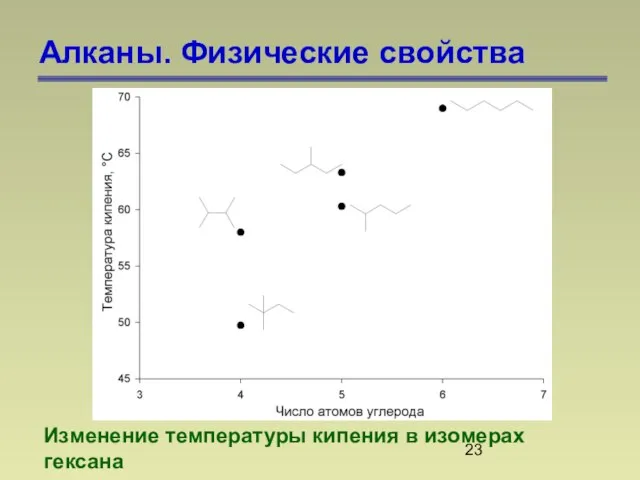
- 23. Алканы. Физические свойства Изменение температуры кипения в изомерах гексана
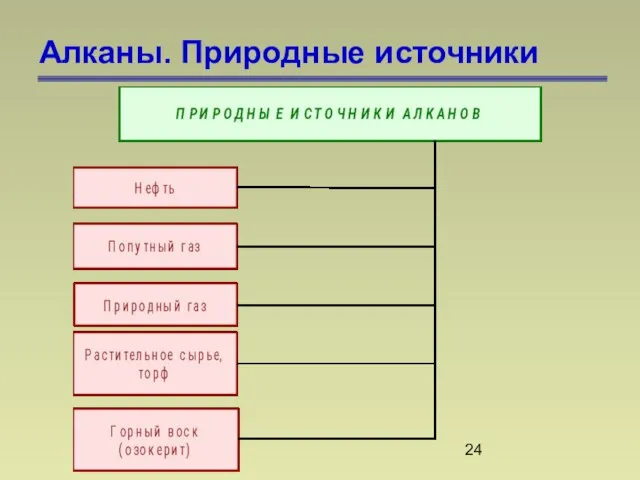
- 24. Алканы. Природные источники
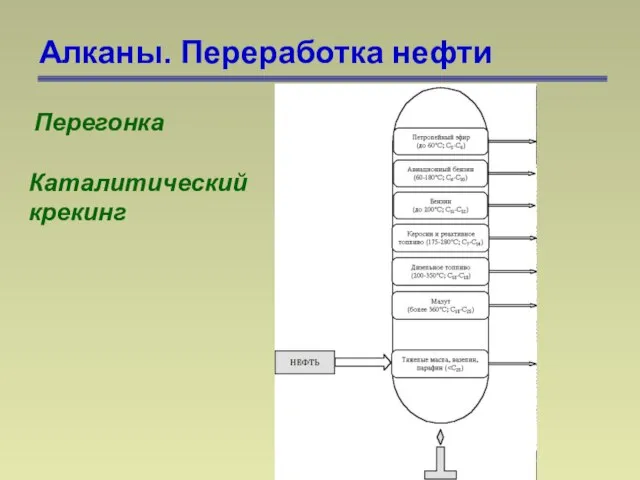
- 25. Алканы. Переработка нефти Перегонка Каталитический крекинг
- 26. Алканы. Способы получения Газофикация угля (Бертло, 1869) Сжижение угля
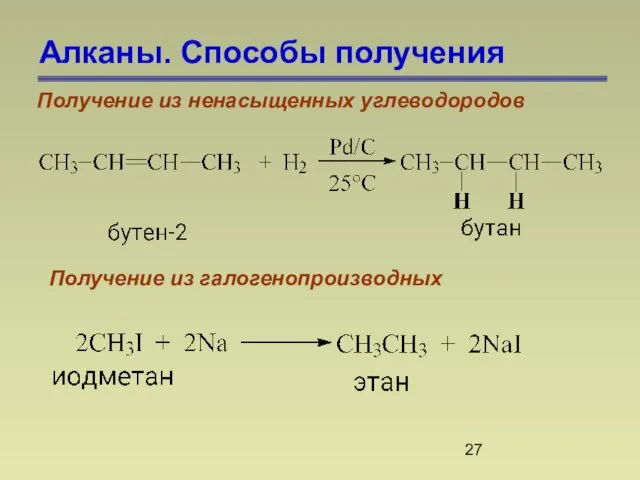
- 27. Алканы. Способы получения Получение из ненасыщенных углеводородов Получение из галогенопроизводных
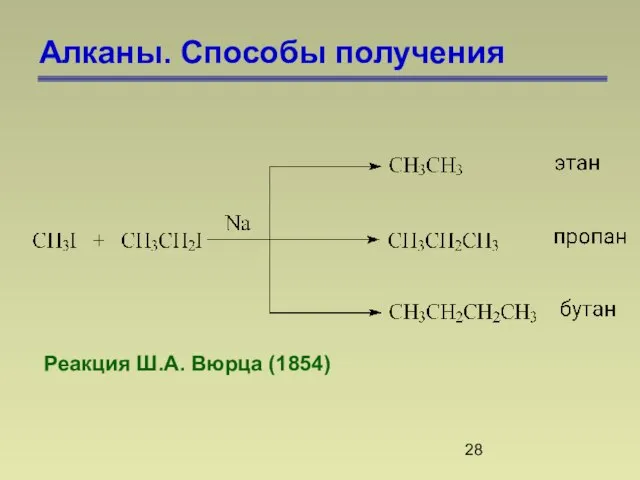
- 28. Алканы. Способы получения Реакция Ш.А. Вюрца (1854)
- 29. Алканы. Способы получения Восстановление галогеналканов
- 30. Алканы. Способы получения Получение из солей карбоновых кислот Электролиз солей щелочных металлов и карбоновых кислот (реакция
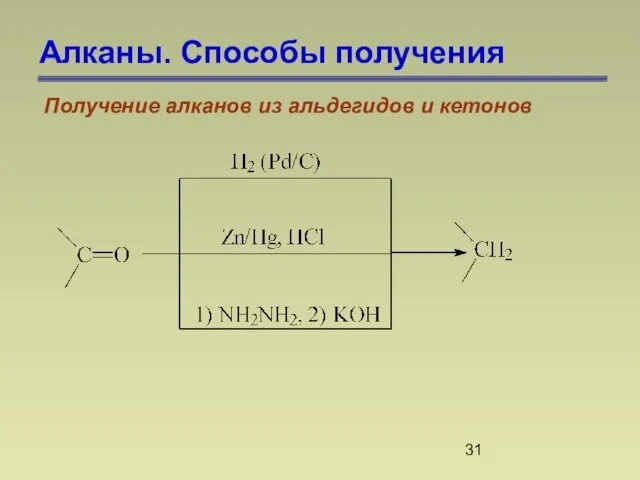
- 31. Алканы. Способы получения Получение алканов из альдегидов и кетонов
- 32. Алканы. Способы получения Гидролиз карбидов металлов 1) Карбиды, при гидролизе, которых образуется метан. (Карбиды алюминия и
- 33. Алканы. Химические свойства Галогенирование
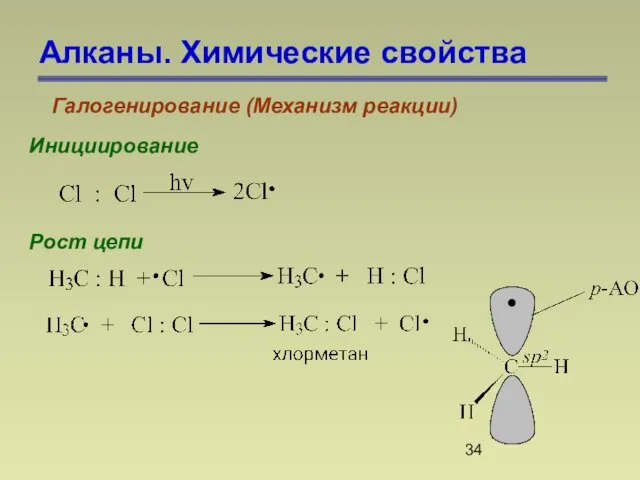
- 34. Алканы. Химические свойства Галогенирование (Механизм реакции) Инициирование Рост цепи
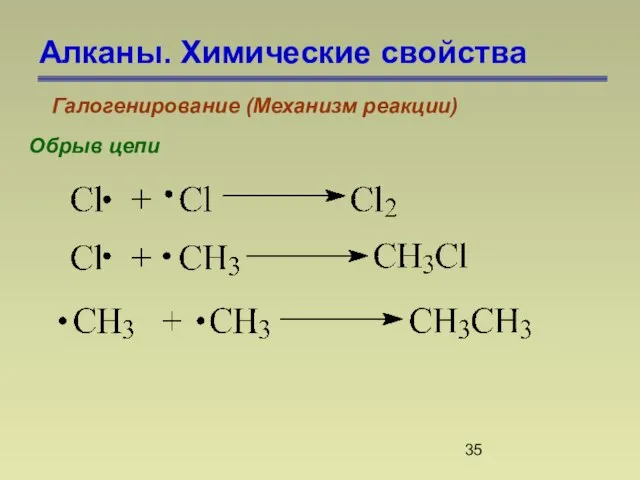
- 35. Алканы. Химические свойства Галогенирование (Механизм реакции) Обрыв цепи
- 36. Алканы. Химические свойства Галогенирование (Механизм реакции) 1.Галогенирование начинается только под действием инициатора радикальных реакций (УФ-свет, радикальные
- 37. Алканы. Химические свойства Галогенирование (Механизм реакции) 4. Реакционная способность водорода у третичного атома углерода выше, чем
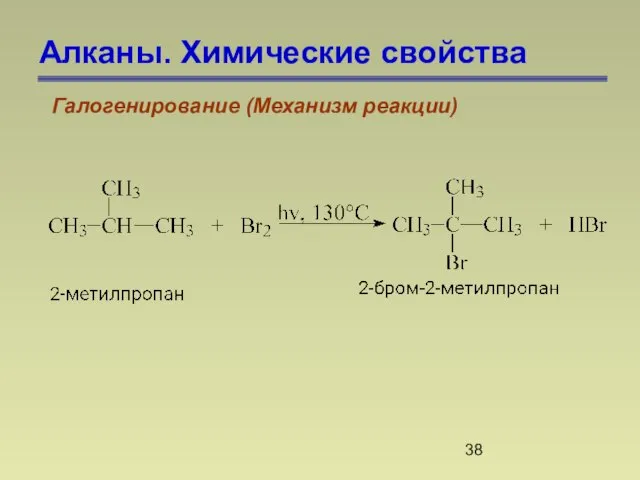
- 38. Алканы. Химические свойства Галогенирование (Механизм реакции)
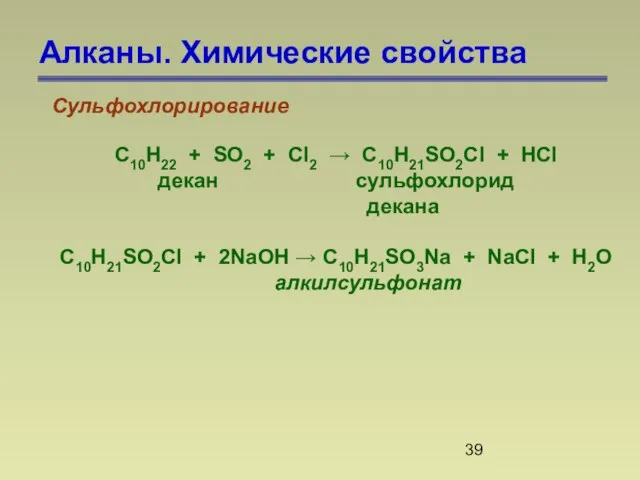
- 39. Алканы. Химические свойства Сульфохлорирование С10H22 + SO2 + Cl2 → C10H21SO2Cl + HCl декан сульфохлорид декана
- 40. Алканы. Химические свойства Нитрование Реакция М.И. Коновалова
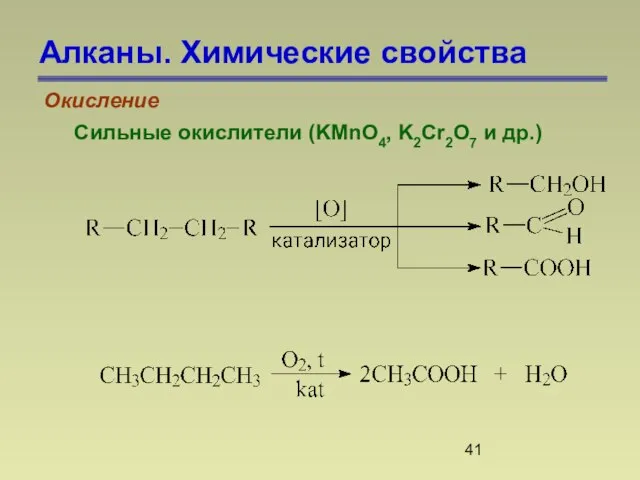
- 41. Алканы. Химические свойства Окисление Сильные окислители (KMnO4, K2Cr2O7 и др.)
- 42. Алканы. Химические свойства Окисление CH4 + H2O → CO + 3H2 CH4 + ½O2 → CO
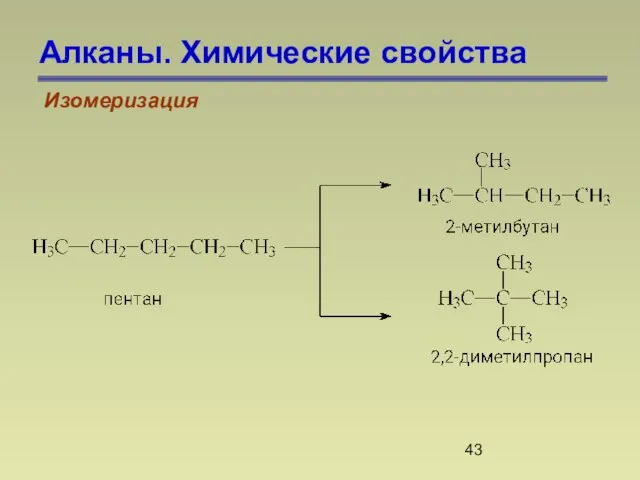
- 43. Алканы. Химические свойства Изомеризация
- 44. Алканы. Химические свойства Термическое разложение (Крекинг) В.Г. Шухов (1891) Температура – 470—650°С; Давление – 7 МПа
- 45. Алканы. Химические свойства Каталитический крекинг Катализаторы – АlСl3, Сr2О3, алюмосиликаты; Температура – 470—500°С; Давление 0,01—0,1 МПа
- 47. Скачать презентацию



















 Компьютер и здоровье глаз
Компьютер и здоровье глаз Пейзаж.Времена года
Пейзаж.Времена года Организационное и информационное обеспечение фандрейзинга
Организационное и информационное обеспечение фандрейзинга Сложноподчиненное предложение. Повторение и обобщение изученного.
Сложноподчиненное предложение. Повторение и обобщение изученного. История радио и мобильной связи
История радио и мобильной связи А как ты знаешь физику?
А как ты знаешь физику? Презентация на тему Нефтяная промышленность
Презентация на тему Нефтяная промышленность  Изобразительное искусство барокко
Изобразительное искусство барокко Как начать бизнес в интернете?
Как начать бизнес в интернете? Sony Ericsson: Из VGA в HD
Sony Ericsson: Из VGA в HD Символика Краснодарского края
Символика Краснодарского края Для умных женщин Одна супружеская пара поехала в выходные на озеро порыбачить.
Для умных женщин Одна супружеская пара поехала в выходные на озеро порыбачить. Бюджет для граждан по Решению Совета депутатов МО Александровский район от 23.12.2020
Бюджет для граждан по Решению Совета депутатов МО Александровский район от 23.12.2020 Children's behavior and its influence on their future acts
Children's behavior and its influence on their future acts РАНХиГС_очно_27.09.2022_Акцнт, реф, защ, техн ОС
РАНХиГС_очно_27.09.2022_Акцнт, реф, защ, техн ОС Слова-паразиты, или экология речи
Слова-паразиты, или экология речи Иммунная система и канцерогенез
Иммунная система и канцерогенез  Подарки AI Journey. Предложения. Сберклауд
Подарки AI Journey. Предложения. Сберклауд Философские теории неврозов
Философские теории неврозов Реализация и изучение игры «Жизнь» в среде электронных таблиц (MS Ecxel)
Реализация и изучение игры «Жизнь» в среде электронных таблиц (MS Ecxel) Деструктивность учащегося и образовательной среды: точки соприкосновения
Деструктивность учащегося и образовательной среды: точки соприкосновения БАЛАНС-2W: ПОДГОТОВКА СПРАВКИ 2-НДФЛ
БАЛАНС-2W: ПОДГОТОВКА СПРАВКИ 2-НДФЛ Подготовка граждан к военной службе
Подготовка граждан к военной службе Ультразвуковые накладные расходомеры Flexim
Ультразвуковые накладные расходомеры Flexim Презентация для заказных проектов
Презентация для заказных проектов Поступление на государственную службу
Поступление на государственную службу Оценка достижений учащихся в разновозрастной группе
Оценка достижений учащихся в разновозрастной группе Grand Canyon National Park
Grand Canyon National Park