Содержание
- 3. Д. И. Менделеев Историческая справка Периодический закон Структура периодической системы Периоды Группы и подгруппы ПП/П/з и
- 4. Для того, чтобы узнать символ химического элемента, его атомный номер и массу, мы можем воспользоваться периодической
- 5. Менделеев Дмитрий Иванович Русский ученый-энциклопедист. Родился 27 января (8 февраля) 1834 в Тобольске. Менделеев был членом
- 6. Историческая справка. По мере развития химии как отрасли науки и открытия многих новых элементов ряд ученых
- 7. Д.В. Деберейнер Д.А. Ньюлендс
- 8. За основу классификации химических элементов Менделеев принял массу атомов элементов. Располагая известные на то время элементы
- 9. Графическим отображением периодического закона является периодическая система химических элементов. В периодической системе все элементы составляют 7
- 10. Периоды (горизонтальные ряды) пронумерованы - от 1 до 7. Номер периода соответствует числу электронных слоев в
- 11. В периодической таблице элементы распределяются по группам (колонки). Группы обозначаются римскими цифрами - от I до
- 12. Элементы с похожими свойствами в вертикальных столбцах этой таблицы образуют подгруппы. Подгруппы с элементами второго и
- 14. Периодическая таблица химических элементов является незаменимым помощником для химика. Все элементы, как естественные, так и полученные
- 15. Характеристика элемента включает: 1- Положение в п/c: Атомный номер, массовое число Номер периода Номер группы Главная
- 17. Скачать презентацию
Слайд 3Д. И. Менделеев
Историческая справка
Периодический закон
Структура периодической системы
Периоды
Группы и подгруппы
ПП/П/з и строение атома
Характеристика
Д. И. Менделеев
Историческая справка
Периодический закон
Структура периодической системы
Периоды
Группы и подгруппы
ПП/П/з и строение атома
Характеристика

Слайд 4 Для того, чтобы узнать символ химического элемента, его атомный номер и
Для того, чтобы узнать символ химического элемента, его атомный номер и

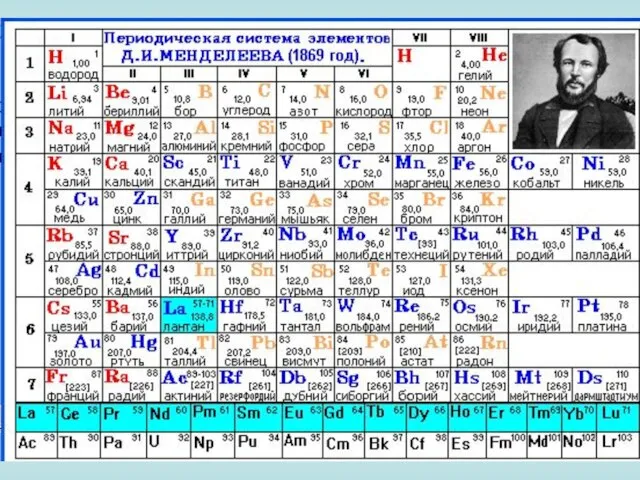
В периодической таблице химические элементы расположены в порядке возрастания их атомной массы, и их свойства периодически повторяются. Сначала - каждый восьмой элемент имеет схожие свойства, затем - каждый восемнадцатый элемент, и наконец - каждый тридцать второй.
Периодичность свойств химических элементов впервые заметил русский химик Дмитрий Иванович Менделеев (1834-1909).
В его честь периодическую таблицу химических элементов назвали таблицей Менделеева.
Слайд 5Менделеев Дмитрий Иванович
Русский ученый-энциклопедист. Родился 27 января (8 февраля) 1834 в
Менделеев Дмитрий Иванович
Русский ученый-энциклопедист. Родился 27 января (8 февраля) 1834 в

Умер Менделеев в Петербурге 20 января (2 февраля) 1907.
Слайд 6Историческая справка.
По мере развития химии как отрасли науки и открытия многих
Историческая справка.
По мере развития химии как отрасли науки и открытия многих

В 1865 году Д. А. Ньюлендс расположил элементы в порядке возрастания их атомной массы.
В 1829 году немецкий ученый Д. В. Деберейнер, профессор химии, технологии и фармакологии университета Йены, попытался расположить элементы, группируя их в так называемые триады, или тройки.
Например, он сгруппировал вместе:
Li, Na, K;
Ca, Sr, Ba;
P, As, S;
Cl, Br, J.
В 1869 году русский химик Дмитрий Иванович Менделеев предложил таблицу, включающую все элементы, известные к тому времени. Эта таблица, с некоторыми изменениями, используется и по сей день как периодическая таблица элементов.
Классификацией химических элементов занимался также и Ю. Л. Мейер, профессор химии технического университета в Карлсруэ. Он опубликовал свою периодическую таблицу элементов в 1870 году.
Слайд 7Д.В. Деберейнер
Д.А. Ньюлендс
Д.В. Деберейнер
Д.А. Ньюлендс

Слайд 8За основу классификации химических элементов Менделеев принял массу атомов элементов. Располагая известные
За основу классификации химических элементов Менделеев принял массу атомов элементов. Располагая известные

Сейчас основной характеристикой, определяющей принадлежность атома к тому или иному элементу, является заряд ядра атома, который соответствует порядковому номеру элемента в периодической системе. Поэтому современная формулировка периодического закона такова:
Свойства простых веществ, а также формы и свойства соединений химических элементов находятся в периодической зависимости от заряда ядер атомов элементов или от порядкового номера элементов.
Слайд 9 Графическим отображением периодического закона является периодическая система химических элементов.
В периодической системе
Графическим отображением периодического закона является периодическая система химических элементов.
В периодической системе

Слайд 10Периоды (горизонтальные ряды) пронумерованы - от 1 до 7. Номер периода соответствует

Каждый период начинается с очень активного металла и заканчивается неметаллом - благородным газом.
Давайте посмотрим на третий период. Он начинается с натрия - активного металла, затем идут магний и алюминий, далее находится кремний - металлоид. А заканчивается этот период четырьмя неметаллами: фосфором, серой, хлором и аргоном.
В периодах, например во втором, в ряду от лития до неона по мере возрастания зарядов ядер свойства элементов изменяются в совершенно определенном направлении. Валентность по кислороду от лития к азоту у каждого последующего элемента увеличивается на единицу, а валентность по водороду от углерода к фтору, наоборот, уменьшается на единицу. Металлические свойства от лития к фтору постепенно ослабевают, а неметаллические - усиливаются.
Слайд 11В периодической таблице элементы распределяются по группам (колонки).
Группы обозначаются римскими цифрами -
В периодической таблице элементы распределяются по группам (колонки).
Группы обозначаются римскими цифрами -

Каждая группа делится на две подгруппы: главную (А группа) и побочную (Б группа).
Названия групп происходят от названий первых элементов в колонках - например, группа бериллия, группа бора. Исключение составляет первая группа, которая называется группа лития, хотя начинается с водорода. Водород был помещен в первую группу, т. к. он имеет один валентный электрон, хотя его свойства сильно отличаются от свойств других элементов первой группы.
Химические элементы, находящиеся в одной группе, имеют одинаковое число валентных электронов. Следовательно, они обладают сходными химическими свойствами. Они обычно имеют одинаковую валентность и образуют соединения схожего типа.
У химических элементов главных подгрупп число валентных электронов равно номеру группы.
Химические элементы побочных подгрупп отличаются очень сложным расположением электронов по электронным слоям.
Все элементы, находящиеся в первой группе периодической системы, имеют по одному валентному электрону.
Слайд 12Элементы с похожими свойствами в вертикальных столбцах этой таблицы образуют подгруппы. Подгруппы
Элементы с похожими свойствами в вертикальных столбцах этой таблицы образуют подгруппы. Подгруппы
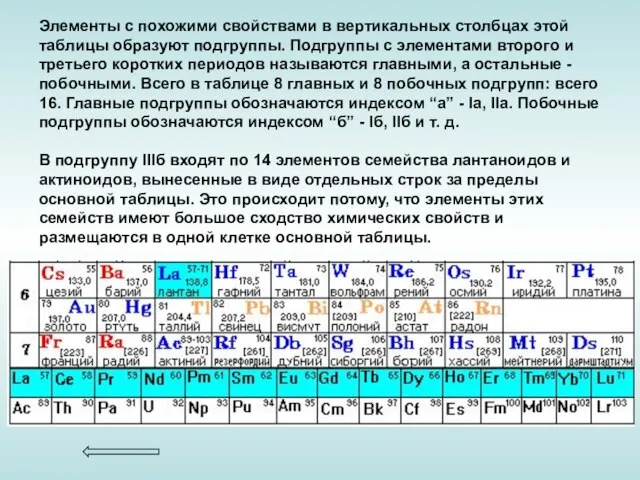
В подгруппу IIIб входят по 14 элементов семейства лантаноидов и актиноидов, вынесенные в виде отдельных строк за пределы основной таблицы. Это происходит потому, что элементы этих семейств имеют большое сходство химических свойств и размещаются в одной клетке основной таблицы.
Слайд 14Периодическая таблица химических элементов является незаменимым помощником для химика.
Все элементы, как естественные,
Периодическая таблица химических элементов является незаменимым помощником для химика.
Все элементы, как естественные,

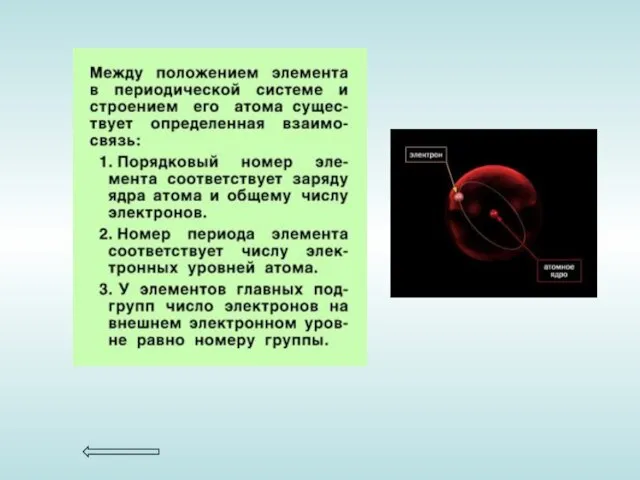
Атомный номер элемента соответствует числу протонов в его ядре и, следовательно, числу электронов.
Массовое число - это общее число протонов и нейтронов в ядре данного изотопа.
Число валентных электронов для элементов главных подгрупп (подгрупп А) равно номеру группы этих элементов.
Слайд 15Характеристика элемента включает:
1- Положение в п/c:
Атомный номер, массовое число
Номер периода
Номер группы
Главная или
Характеристика элемента включает:
1- Положение в п/c:
Атомный номер, массовое число
Номер периода
Номер группы
Главная или

2- Строение атома:
Число электронов, протонов, нейтронов
Распределение электронов по уровням
Электронная формула
3- Прогноз свойств:
Металл или неметалл
Предполагаемые формулы и свойства соединений
 Русский культурный ренессанс конец 19 - начало 20 в.
Русский культурный ренессанс конец 19 - начало 20 в. Философия глобальных проблем человечества
Философия глобальных проблем человечества Проблеми підготовки майбутніх учителів до викладання питань стійкого розвитку на хіміко-біологічному факультеті Тернопільськог
Проблеми підготовки майбутніх учителів до викладання питань стійкого розвитку на хіміко-біологічному факультеті Тернопільськог Гуманитарное конфигурирование в развивающихся системах Людмила Голубкова 17-е заседание русского отделения INCOSE 25 ноября 2009
Гуманитарное конфигурирование в развивающихся системах Людмила Голубкова 17-е заседание русского отделения INCOSE 25 ноября 2009 Хохлома. Павлово-посадский платок
Хохлома. Павлово-посадский платок Презентация на тему Альдегиды, свойства, получение, применение
Презентация на тему Альдегиды, свойства, получение, применение Способы представления графической информации
Способы представления графической информации Изготовление выкроек (5 класс) - презентация по Технологии
Изготовление выкроек (5 класс) - презентация по Технологии Пошив наволочки
Пошив наволочки Муниципальнаяобщеобразовательная средняя школа № 17
Муниципальнаяобщеобразовательная средняя школа № 17 Газодинамический метод нанесения покрытий, как альтернатива гальваническому методу
Газодинамический метод нанесения покрытий, как альтернатива гальваническому методу Анализ рассказа Чехова Толстый и тонкий
Анализ рассказа Чехова Толстый и тонкий  Правила по русскому языку 1-2 класс
Правила по русскому языку 1-2 класс Медиаинформационная грамотность - новая грамотность XXI века
Медиаинформационная грамотность - новая грамотность XXI века Учебный модуль
Учебный модуль Образ Богородицы
Образ Богородицы Грибы
Грибы Специальные предложения для исполнителей и музыкальных групп по размещению на Интернет-радио
Специальные предложения для исполнителей и музыкальных групп по размещению на Интернет-радио Профессии в моей семье
Профессии в моей семье Farmasi. Бизнес семинар Время действовать
Farmasi. Бизнес семинар Время действовать Южный океан
Южный океан  Прямые линии и организация пространства
Прямые линии и организация пространства Урок-игра для учащихся 6 классов
Урок-игра для учащихся 6 классов Воскресный завтрак для всей семьи
Воскресный завтрак для всей семьи Кулебяка с рыбой
Кулебяка с рыбой ООО «Глория» | www.slavagloria.ru
ООО «Глория» | www.slavagloria.ru Виды художественного оформления зданий. Особенности линейного построения .Основы линейной перспективы. Тема 1.2
Виды художественного оформления зданий. Особенности линейного построения .Основы линейной перспективы. Тема 1.2 Валютная система
Валютная система