Содержание
- 2. Единственный путь, ведущий к знанию, - это деятельность Б. Шоу
- 3. Птицы еще в яйце изучают географию. Как пролететь из Европы в Африку, как из Америки вернуться
- 4. Что Вы знаете или думаете, что знаете о серной кислоте?
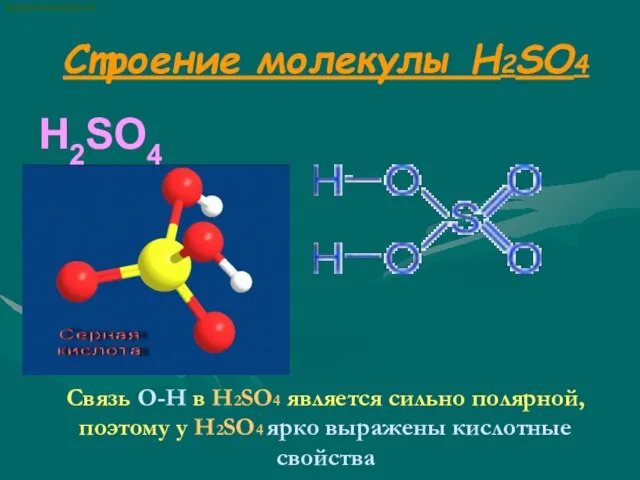
- 5. Строение молекулы H2SO4 H2SO4 Связь О-Н в H2SO4 является сильно полярной, поэтому у H2SO4 ярко выражены
- 6. Физические свойства Тяжелая маслянистая жидкость ("купоросное масло"); p = 1,84 г/см3; Нелетучая, хорошо растворима в воде
- 7. Лабораторный опыт № 7 Исследование химических свойств раствора серной кислоты ВНИМАНИЕ ! При работе с кислотой
- 8. В пробирках в виде растворов представлены вещества: NaCl, NaBr, NaI, NaF, H2SO4, Na2CO3, Na2SO4, NaOH Предложите
- 9. Если эти утверждения верны на Ваш взгляд, то напротив них поставьте знак «+», а если нет,
- 10. Химические свойства H2SO4 - сильная двухосновная кислота H2SO4 ⬄ H+ + HSO4- ⬄2H+ + SO42- 1)
- 11. 3) с основаниями: H2SO4 + 2NaOH => Na2SO4 + 2H2O H+ + OH- => H2O H2SO4
- 12. ВАСИЛИЙ КАДЕВИЧ 2008 5) концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt)
- 13. 6) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь
- 14. 6) Гигроскопичность серной кислоты Концентрированная серная кислота жадно набирает воду отовсюду, образуя гидраты, и способна для
- 15. Концентрированная серная кислота энергично обугливает сахарозу
- 17. Помните! При приготовлении раствора кислоту вливать малыми порциями в воду, а не наоборот!
- 18. Производство серной кислоты 1-я стадия. Печь для обжига колчедана. 4FeS2 + 11O2 => 2Fe2O3 + 8SO2
- 19. ВАСИЛИЙ КАДЕВИЧ 2008 Применение H2SO4 В производстве пластмассы В производстве синтетического волокна В средствах защиты растений
- 21. СОЛИ СЕРНОЙ КИСЛОТЫ CaSO4• 2H2O - гипс CaSO4• 0,5H2O - алебастр CuSO4• 5H2O – медный купорос
- 22. … А знаете, товарищи, - объявил он, - эти статуи кто-то облил уксусной кислотой. Кислота разъела
- 23. Мирабилит в заливе начинает кристаллизоваться в половине ноября, а к половине марта кристаллизация прекращается и начинается
- 24. Домашнее задание Составьте инструкцию по правилам обращения с серной кислотой • для лаборанта кабинета химии; •
- 26. Скачать презентацию





















 Технологическое предпринимательство для школьников: от изобретения к бизнесу! Занятие 2
Технологическое предпринимательство для школьников: от изобретения к бизнесу! Занятие 2 Романская архитектура
Романская архитектура Выборы Лидера совета старшеклассников
Выборы Лидера совета старшеклассников Роботы в древней греции
Роботы в древней греции Функция
Функция Поисковое продвижение: как увеличить его эффективность?
Поисковое продвижение: как увеличить его эффективность? Рекламные решения
Рекламные решения Мегалитическая архитектура 8 класс
Мегалитическая архитектура 8 класс Планета дорог
Планета дорог Забота о ближнем - призвание христианина
Забота о ближнем - призвание христианина МОДЕЛИ ПЕДАГОГИЧЕСКОГО ОБЩЕНИЯ
МОДЕЛИ ПЕДАГОГИЧЕСКОГО ОБЩЕНИЯ Презентация на тему Правила поведения при пожаре
Презентация на тему Правила поведения при пожаре  Викторина по произведению А.С. Пушкина "Капитанская дочка"
Викторина по произведению А.С. Пушкина "Капитанская дочка" Конструирование и моделирование одежды
Конструирование и моделирование одежды Медиабезопасность
Медиабезопасность Агатэ Элерс, отдел Международного сотрудничества Услуги и опыт Немецкого Энергетического Агентства в реализации СО- и МЧР-проект
Агатэ Элерс, отдел Международного сотрудничества Услуги и опыт Немецкого Энергетического Агентства в реализации СО- и МЧР-проект ВСЕМ! ВСЕМ! ВСЕМ! 7 ФЕВРАЛЯ, В 17 ЧАСОВ ГИМНАЗИЯ № 3 ЖДЁТ СВОИХ ВЫПУСКНИКОВ
ВСЕМ! ВСЕМ! ВСЕМ! 7 ФЕВРАЛЯ, В 17 ЧАСОВ ГИМНАЗИЯ № 3 ЖДЁТ СВОИХ ВЫПУСКНИКОВ  Что нас окружает ?
Что нас окружает ? НИД кафедры ЭиУ в 2020/21 уч. году Проблемы, задачи, пути развития
НИД кафедры ЭиУ в 2020/21 уч. году Проблемы, задачи, пути развития Британские художники
Британские художники Год театра в России. Научно-практическая конференция
Год театра в России. Научно-практическая конференция Презентация3
Презентация3 Винтовые лестницы
Винтовые лестницы Экспорт нефти и нормативно-правовое регулирование
Экспорт нефти и нормативно-правовое регулирование Александрова Айталина Ивановна
Александрова Айталина Ивановна Готовность первоклассника к школе
Готовность первоклассника к школе Отклонение в поведении ребенка как социально-педагогическая проблема
Отклонение в поведении ребенка как социально-педагогическая проблема Презентация на тему Миграции населения России (8 класс)
Презентация на тему Миграции населения России (8 класс)