Содержание
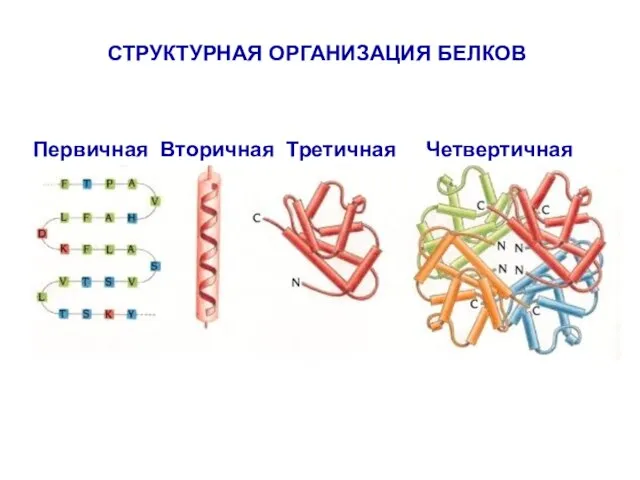
- 2. СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ Первичная Вторичная Третичная Четвертичная
- 3. Белки представляют собой высокомолекулярные биополимеры, построенные из аминокислотных остатков. Практически все белки построены из 22 аминокислот.
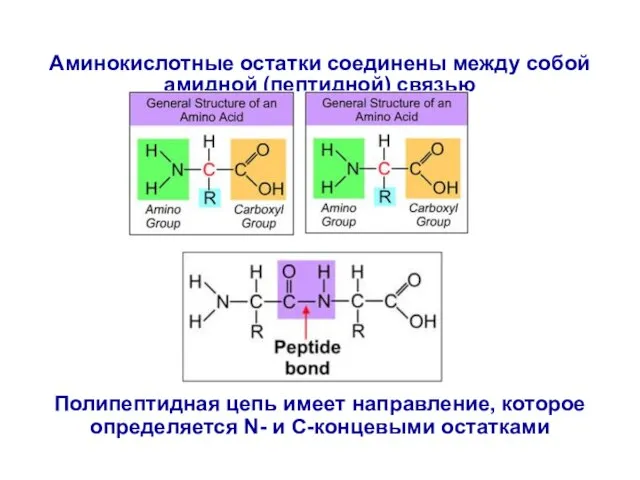
- 4. Аминокислотные остатки соединены между собой амидной (пептидной) связью Полипептидная цепь имеет направление, которое определяется N- и
- 5. ПРИМЕРЫ ПОСТТРАНСЛЯЦИОННЫХ МОДИФИКАЦИЙ БЕЛКОВ Lys: метилирование, ацетилирование Arg: метилирование, дезаминирование His: метилирование Glu: карбоксилирование Asp: образование
- 6. ОСНОВНЫЕ ЭТАПЫ ОПРЕДЕЛЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКА ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОГО СОСТАВА (АМИНОКИСЛОТНЫЙ АНАЛИЗ) ОПРЕДЕЛЕНИЕ N-
- 7. ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ МАСС-СПЕКТРОМЕТРИЯ ЭЛЕКТРОФОРЕЗ 3. ГЕЛЬ-ФИЛЬТРАЦИЯ 4. УЛЬТРАЦЕНТРИФУГИРОВАНИЕ
- 8. Принцип аминокислотного анализа Гидролиз в 5,7н HCl при 1100C в вакууме в течение 24-96 часов
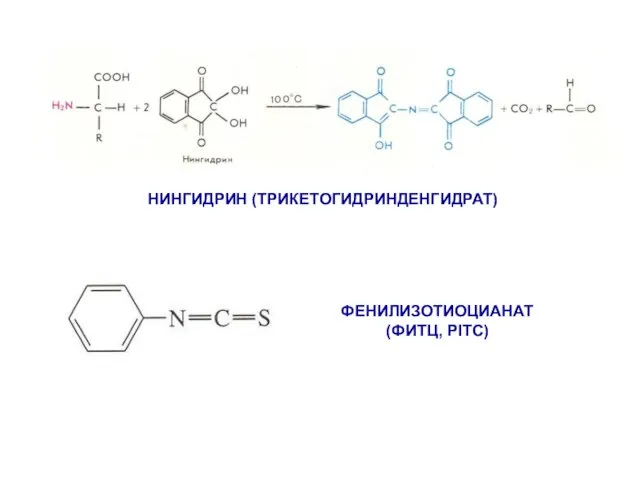
- 9. ФЕНИЛИЗОТИОЦИАНАТ (ФИТЦ, PITC) НИНГИДРИН (ТРИКЕТОГИДРИНДЕНГИДРАТ)
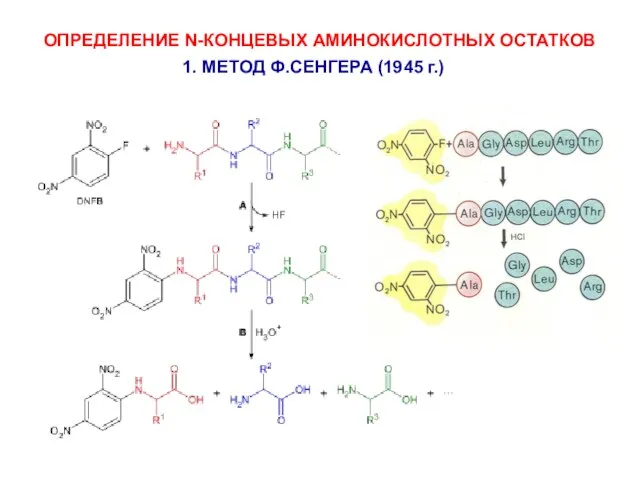
- 10. ОПРЕДЕЛЕНИЕ N-КОНЦЕВЫХ АМИНОКИСЛОТНЫХ ОСТАТКОВ 1. МЕТОД Ф.СЕНГЕРА (1945 г.)
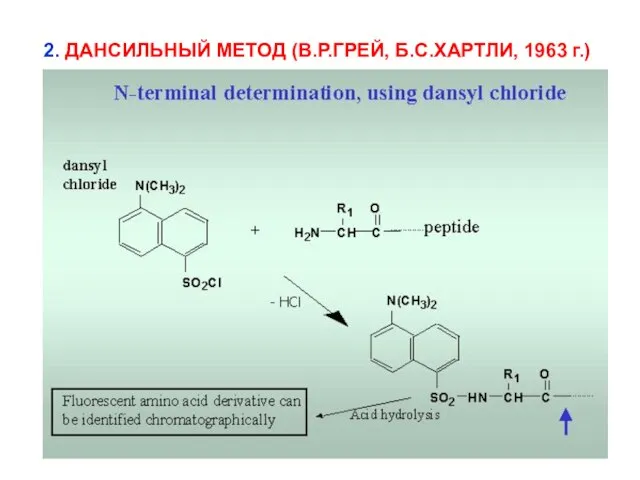
- 11. 2. ДАНСИЛЬНЫЙ МЕТОД (В.Р.ГРЕЙ, Б.С.ХАРТЛИ, 1963 г.)
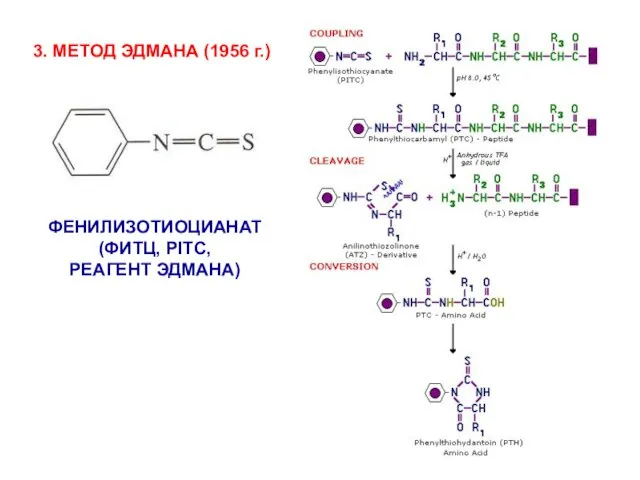
- 12. 3. МЕТОД ЭДМАНА (1956 г.) ФЕНИЛИЗОТИОЦИАНАТ (ФИТЦ, PITC, РЕАГЕНТ ЭДМАНА)
- 13. 4. ФЕРМЕНТАТИВНЫЙ ГИДРОЛИЗ АМИНОПЕПТИДАЗАМИ ЛЕЙЦИНАМИНОПЕПТИДАЗА (С НАИБОЛЬШЕЙ СКОРОСТЬЮ ГИДРОЛИЗУЕТ СВЯЗИ Leu, Ile, Val) АМИНОПЕПТИДАЗА М (ГИДРОЛИЗУЕТ
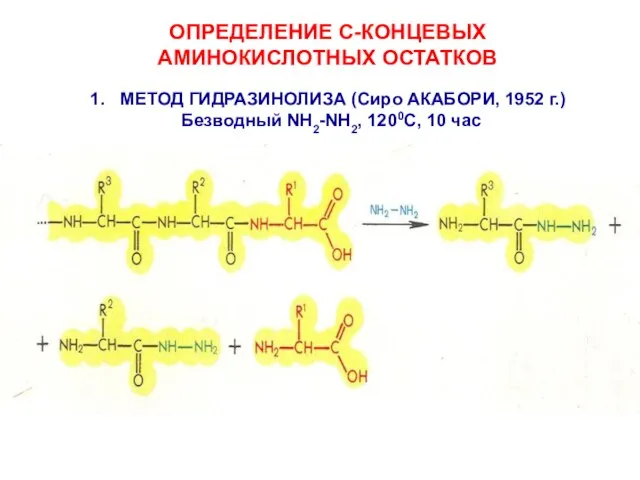
- 14. ОПРЕДЕЛЕНИЕ С-КОНЦЕВЫХ АМИНОКИСЛОТНЫХ ОСТАТКОВ МЕТОД ГИДРАЗИНОЛИЗА (Сиро АКАБОРИ, 1952 г.) Безводный NH2-NH2, 1200C, 10 час
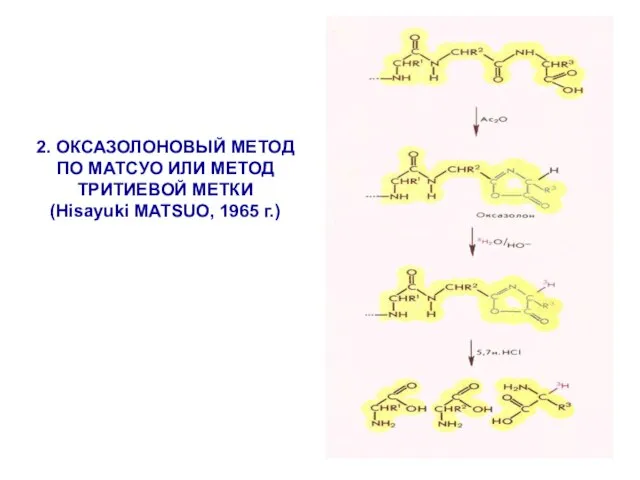
- 15. 2. ОКСАЗОЛОНОВЫЙ МЕТОД ПО МАТСУО ИЛИ МЕТОД ТРИТИЕВОЙ МЕТКИ (Hisayuki MATSUO, 1965 г.)
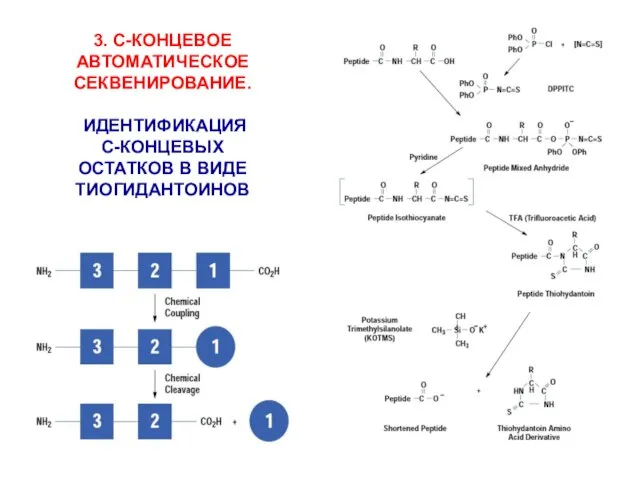
- 16. 3. С-КОНЦЕВОЕ АВТОМАТИЧЕСКОЕ СЕКВЕНИРОВАНИЕ. ИДЕНТИФИКАЦИЯ С-КОНЦЕВЫХ ОСТАТКОВ В ВИДЕ ТИОГИДАНТОИНОВ
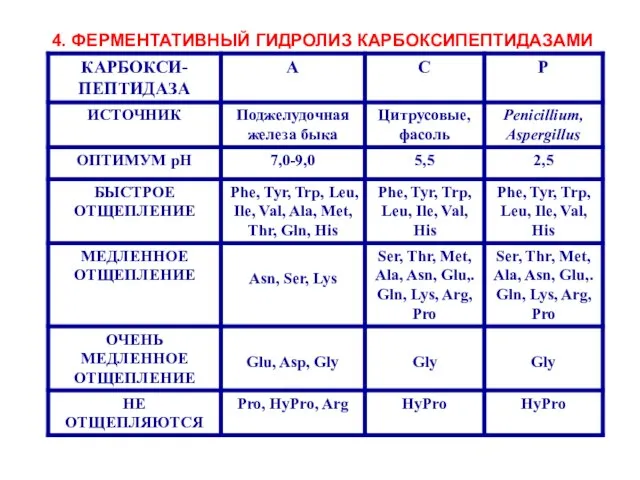
- 17. 4. ФЕРМЕНТАТИВНЫЙ ГИДРОЛИЗ КАРБОКСИПЕПТИДАЗАМИ
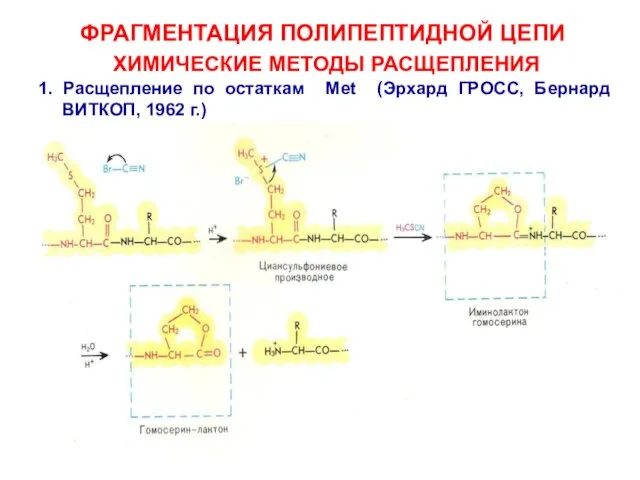
- 18. ФРАГМЕНТАЦИЯ ПОЛИПЕПТИДНОЙ ЦЕПИ ХИМИЧЕСКИЕ МЕТОДЫ РАСЩЕПЛЕНИЯ 1. Расщепление по остаткам Met (Эрхард ГРОСС, Бернард ВИТКОП, 1962
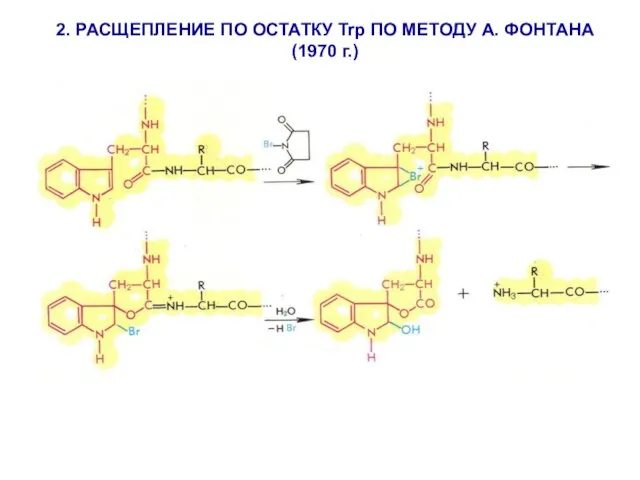
- 19. 2. РАСЩЕПЛЕНИЕ ПО ОСТАТКУ Trp ПО МЕТОДУ А. ФОНТАНА (1970 г.)
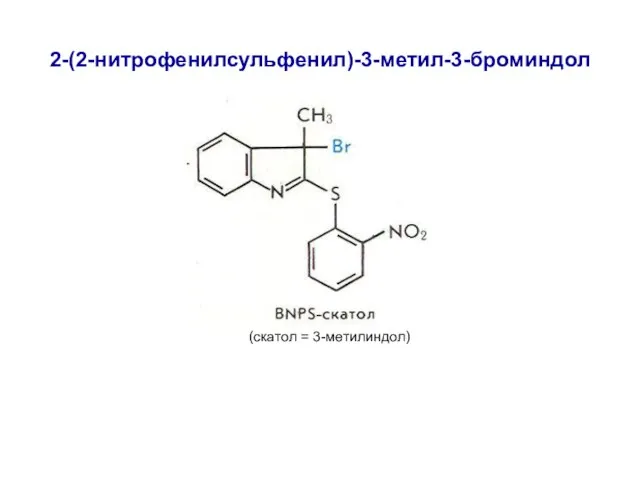
- 20. 2-(2-нитрофенилсульфенил)-3-метил-3-броминдол (скатол = 3-метилиндол)
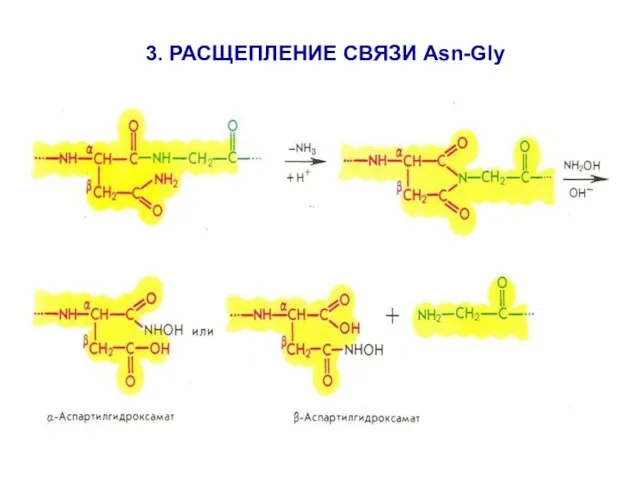
- 21. 3. РАСЩЕПЛЕНИЕ СВЯЗИ Asn-Gly
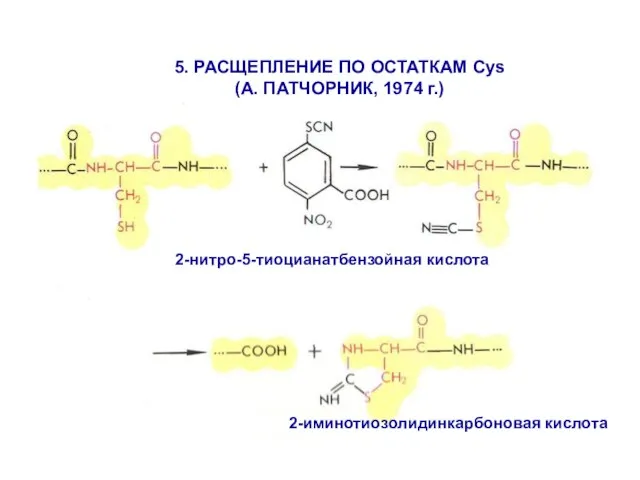
- 22. 2-иминотиозолидинкарбоновая кислота 5. РАСЩЕПЛЕНИЕ ПО ОСТАТКАМ Cys (А. ПАТЧОРНИК, 1974 г.) 2-нитро-5-тиоцианатбензойная кислота
- 23. ФЕРМЕНТАТИВНЫЕ МЕТОДЫ ФРАГМЕНТАЦИИ ПОЛИПЕПТИДНОЙ ЦЕПИ ВЫСОКАЯ СПЕЦИФИЧНОСТЬ 1. Трипсин pH 7,0-9,0 Lys—X Arg—X Lys—Pro Arg—Pro Протеаза
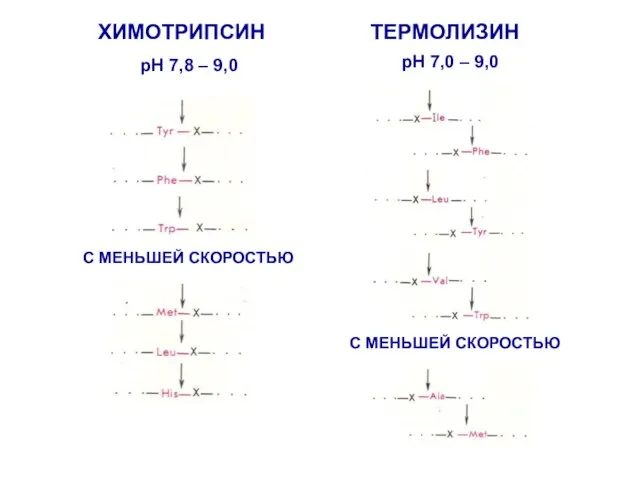
- 24. ХИМОТРИПСИН ТЕРМОЛИЗИН pH 7,8 – 9,0 С МЕНЬШЕЙ СКОРОСТЬЮ pH 7,0 – 9,0 С МЕНЬШЕЙ СКОРОСТЬЮ
- 25. ЛИЗИН-СПЕЦИФИЧЕСКАЯ ПРОТЕАЗА ИЗ Armillaria mellea pH 8,0 ЭНДОПРОТЕИНАЗА Lys-C ИЗ Lysobacter ensymogenes КЛОСТРИПАИН ИЗ Clostridium histolyticum
- 27. Скачать презентацию








 Клубника, лимоны и цветы в коллаборации Кэти Перри и Таши Алакоз
Клубника, лимоны и цветы в коллаборации Кэти Перри и Таши Алакоз Схема работы с гостем
Схема работы с гостем Высокое Возрождение и гуманизм в Европе
Высокое Возрождение и гуманизм в Европе Квадратные уравнения
Квадратные уравнения Vnitřní stavba pevných látek
Vnitřní stavba pevných látek Краевая целевая программа «Обеспечение жильем молодых семей в Пермском крае на 2007-2010 годы»
Краевая целевая программа «Обеспечение жильем молодых семей в Пермском крае на 2007-2010 годы» Презентация на тему Физиологическая регуляция проницаемости эндотелия
Презентация на тему Физиологическая регуляция проницаемости эндотелия  Тирсо де Малино
Тирсо де Малино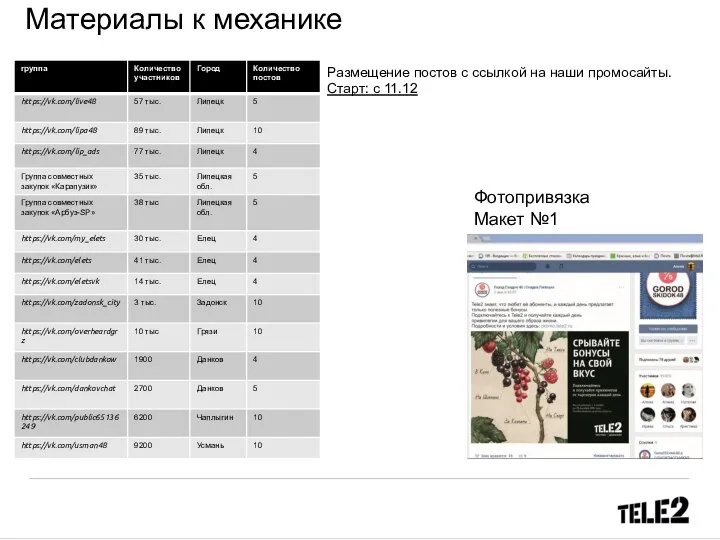 Tele2. Материалы к механике. Размещение постов с ссылкой на промосайты
Tele2. Материалы к механике. Размещение постов с ссылкой на промосайты Тема: Древние тюрки
Тема: Древние тюрки ПРЕЗЕНТАЦИЯ ПО ГЕОМЕТРИИ. НА ТЕМУ: ГЕОМЕТРИЯ В АРХИТЕКТУРЕ
ПРЕЗЕНТАЦИЯ ПО ГЕОМЕТРИИ. НА ТЕМУ: ГЕОМЕТРИЯ В АРХИТЕКТУРЕ Путешествие Японией
Путешествие Японией Central Ostrobothnia ConservatoryKeski-Pohjanmaan KonservatorioKokkola, Finland
Central Ostrobothnia ConservatoryKeski-Pohjanmaan KonservatorioKokkola, Finland Аэротренажер. Модернизация тренажера
Аэротренажер. Модернизация тренажера Химический анализ продуктов питания
Химический анализ продуктов питания Презентация на тему Шолохов Они сражались за Родину
Презентация на тему Шолохов Они сражались за Родину Акционный комплект 3 в 1 ( Инсталляция + кнопка + унитаз). Акция с 27.07.2020
Акционный комплект 3 в 1 ( Инсталляция + кнопка + унитаз). Акция с 27.07.2020 Проект Де Пассерел в Болгарии Альтернативные социальные услуги в сравнении с учреждениями для детей с нарушениями интеллекта С
Проект Де Пассерел в Болгарии Альтернативные социальные услуги в сравнении с учреждениями для детей с нарушениями интеллекта С Обществознание
Обществознание Что там было?
Что там было? Велодрайв
Велодрайв Презентация на тему Цыгане - нация мира
Презентация на тему Цыгане - нация мира Пунктуация при деепричастном обороте
Пунктуация при деепричастном обороте План погашения кредита
План погашения кредита Сущность права
Сущность права Продуктовые воронки. Практикум
Продуктовые воронки. Практикум Самодисциплина
Самодисциплина Презентация на тему: «23 февраля – День Защитника Отечества»
Презентация на тему: «23 февраля – День Защитника Отечества»