Содержание
- 2. Внутренняя энергия. Работа и теплота Наряду с механической энергией любое тело (или система) обладает внутренней энергией.
- 3. В термодинамике важно знать не абсолютное значение внутренней энергии, а её изменение. В термодинамических процессах изменяется
- 4. Внутренняя энергия U одного моля идеального газа равна: или Таким образом, внутренняя энергия зависит только от
- 5. В общем случае термодинамическая система может обладать как внутренней, так и механической энергией и разные системы
- 6. Количество теплоты, сообщаемой телу, идёт на увеличение внутренней энергии тела и на совершение телом работы: –
- 7. В дифференциальном виде первое начало термодинамики будем иметь : U – функция состояния системы; dU –
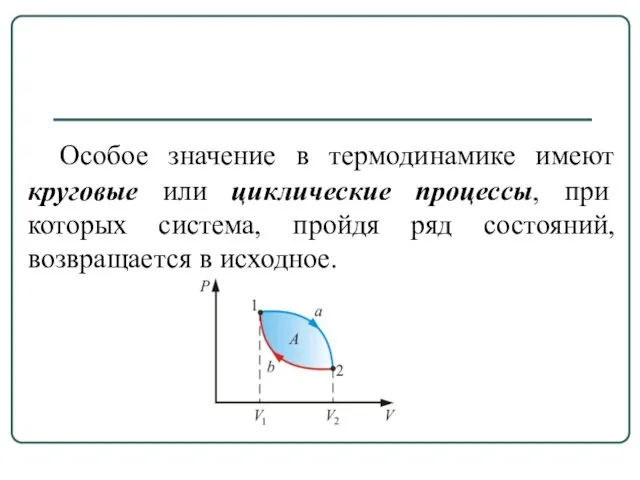
- 8. Особое значение в термодинамике имеют круговые или циклические процессы, при которых система, пройдя ряд состояний, возвращается
- 9. Для цикла из первого начала термодинамики Следовательно, нельзя построить периодически действующий двигатель, который совершал бы бóльшую
- 10. Теплоёмкость идеального газа. Уравнение Майера Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого тела на
- 11. Для газов удобно пользоваться молярной теплоемкостью Сμ − количество теплоты, необходимое для нагревания 1 моля газа
- 12. Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании. Если газ нагревать при
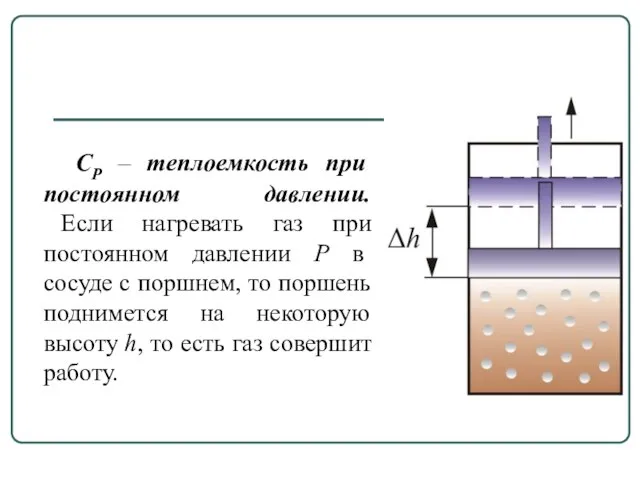
- 13. СР – теплоемкость при постоянном давлении. Если нагревать газ при постоянном давлении Р в сосуде с
- 14. Следовательно, подводимое тепло затрачивается и на нагревание и на совершение работы. Отсюда ясно, что Величины СР
- 15. При нагревании одного моля идеального газа при постоянном объёме, первое начало термодинамики запишется в виде: Теплоемкость
- 16. В общем случае так как U может зависеть не только от температуры. В случае идеального газа
- 17. Внутренняя энергия идеального газа является только функцией температуры (и не зависит от V, Р), поэтому формула
- 18. При изобарическом процессе кроме увеличения внутренней энергии происходит совершение работы газом: Из уравнения Клапейрона-Менделеева Подставив полученный
- 19. Это уравнение Майера для одного моля газа. Из него следует физический смысл универсальной газовой постоянной .
- 20. Теплоёмкости одноатомных и многоатомных газов Внутренняя энергия одного моля идеального газа равна
- 21. Теплоёмкости одноатомных газов Теплоемкость при постоянном объеме СV – величина постоянная, от температуры не зависит.
- 22. Из уравнения Майера Тогда, теплоемкость при постоянном давлении для одноатомных газов:
- 23. Полезно знать отношение: где γ − коэффициент Пуассона
- 24. Так как Тогда . Из этого следует, что Кроме того где i – число степеней свободы
- 25. Подставив в выражение для внутренней энергии, получим: а так как , то внутреннюю энергию можно найти
- 26. Необходимо учитывать вращательное и колебательное движение молекул. Число степеней свободы таких молекул Молекулы многоатомных газов нельзя
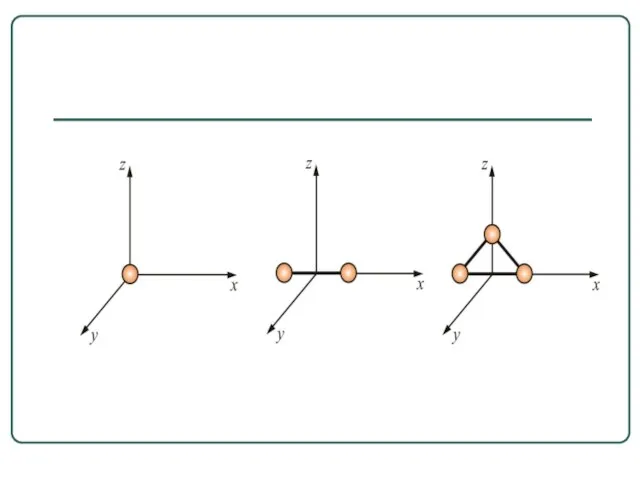
- 27. Числом степени свободы называется число независимых переменных, определяющих положение тела в пространстве и обозначается i Как
- 28. Многоатомная молекула может ещё и вращаться. Например, у двухатомных молекул вращательное движение можно разложить на два
- 31. У двухатомных жестких молекул пять степеней свободы (i = 5), а у трёхатомных шесть степеней свободы
- 32. Больцман доказал, что, средняя энергия, приходящаяся на одну степень свободы равна Закон о равномерном распределении энергии
- 33. На среднюю кинетическую энергию молекулы, имеющей i-степеней свободы приходится Это и есть закон Больцмана о равномерном
- 34. В общем случае, для молярной массы газа
- 35. Для произвольного количества газов: ,
- 36. Применение первого начала термодинамики к изопроцессам Используем I начало термодинамики или закон сохранения энергии в термодинамике
- 37. Изотермический процесс Изохорический процесс
- 38. Изобарический процесс Адиабатный процесс
- 39. Рассмотрим политропный процесс – такой процесс, при котором изменяются все основные параметры системы, кроме теплоемкости, т.е.
- 40. С помощью показателя n можно легко описать любой изопроцесс: 1. Изобарный процесс Р = const, n
- 41. Изохорный процесс Адиабатический процесс ΔQ = 0, n = γ, Сад = 0.
- 42. Во всех этих процессах работу можно вычислить по одной формуле:
- 44. Скачать презентацию





































 Правовые основы организации школьного ученического самоуправления
Правовые основы организации школьного ученического самоуправления Директор Департамента бюджетной политики Минфина России А.М.Лавров
Директор Департамента бюджетной политики Минфина России А.М.Лавров Врубель, Климпт, Матисс, Пикассо
Врубель, Климпт, Матисс, Пикассо Foot
Foot Кустовой сброс попутно добываемой воды
Кустовой сброс попутно добываемой воды Рациональное питание и культура здоровья
Рациональное питание и культура здоровья Научное познание
Научное познание Интересные факты о Бразилии
Интересные факты о Бразилии Биометрические Системы «Росбиометрикс™» - контроль доступа в особые помещения, контроль доступа в банковские депозитные ячейки.
Биометрические Системы «Росбиометрикс™» - контроль доступа в особые помещения, контроль доступа в банковские депозитные ячейки. БОЛЬШЕВИКИ
БОЛЬШЕВИКИ Портфолио выпускника Нечаева Всеволода Вячеславовича
Портфолио выпускника Нечаева Всеволода Вячеславовича Поэзия повседневной жизни в искусстве разных народов
Поэзия повседневной жизни в искусстве разных народов Интеллектуальное предпринимательство
Интеллектуальное предпринимательство Центр подключения и обслуживания водителей Gett
Центр подключения и обслуживания водителей Gett Презентация медицинская терминология (8)
Презентация медицинская терминология (8) Карликовая игрунка или пальчиковая обезьяна (Finger Monkey)
Карликовая игрунка или пальчиковая обезьяна (Finger Monkey) История Нового Года
История Нового Года «Футлярная жизнь» или жизнь без футляра?.. (по произведениям А.П. Чехова)
«Футлярная жизнь» или жизнь без футляра?.. (по произведениям А.П. Чехова) Учебно-методический комплект к занятию:
Учебно-методический комплект к занятию: Измерение ускорения свободного падения
Измерение ускорения свободного падения Город-Сад. Магазины полезных продуктов. Advent календарь в аккаунте
Город-Сад. Магазины полезных продуктов. Advent календарь в аккаунте Об итогах работы Министерство образования Пермского краяв 2009 году и задачах на 2010 год
Об итогах работы Министерство образования Пермского краяв 2009 году и задачах на 2010 год Специфика развития человека
Специфика развития человека Информационные системы в экономике
Информационные системы в экономике  Презентация на тему Безопасность людей при чрезвычайных ситуациях природного характера
Презентация на тему Безопасность людей при чрезвычайных ситуациях природного характера  Фотограф
Фотограф Презентация на тему Виктория Токарева Творчество гениальной писательницы
Презентация на тему Виктория Токарева Творчество гениальной писательницы  Кофейная акварель в технике гризайль
Кофейная акварель в технике гризайль