Содержание
- 2. Получение неочищенных ферментных препаратов При очистке КЖ биомассу отделяют на барабанных вакуум-фильтрах или бактофугах Для улучшения
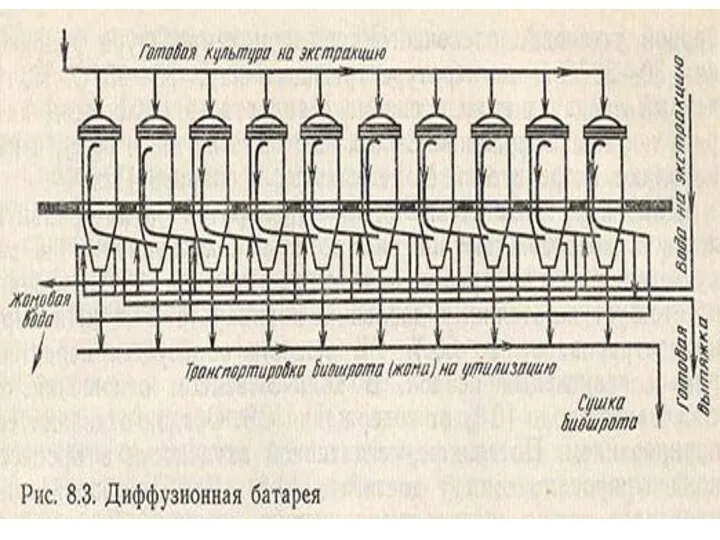
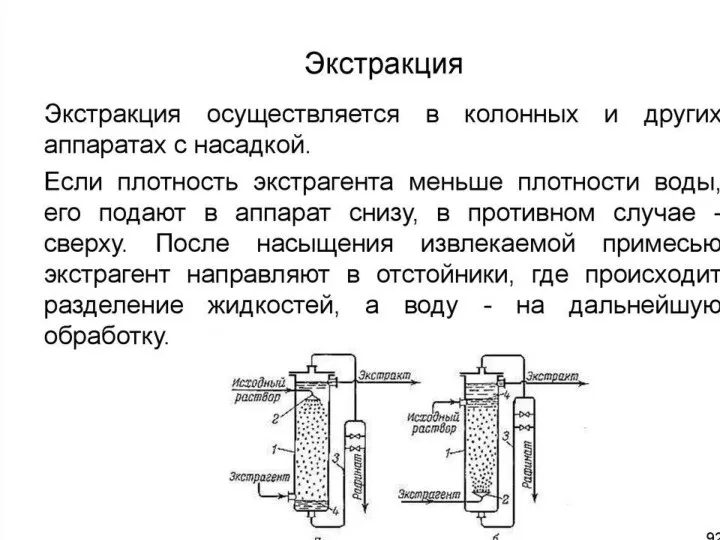
- 3. Экстракция ферментов Экстракция из влажной культуры после разрушения Важные факторы -Т, рН, длительность процесса, природа извлекаемого
- 9. Вакуум- выпаривание Необходима стабилизация ферментов КЖ Нужно учитывать изменение минерального состава – при сгущении КЖ до
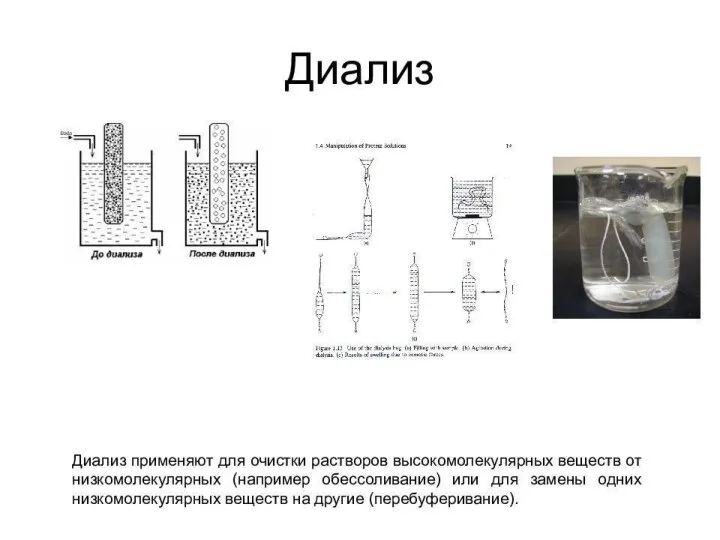
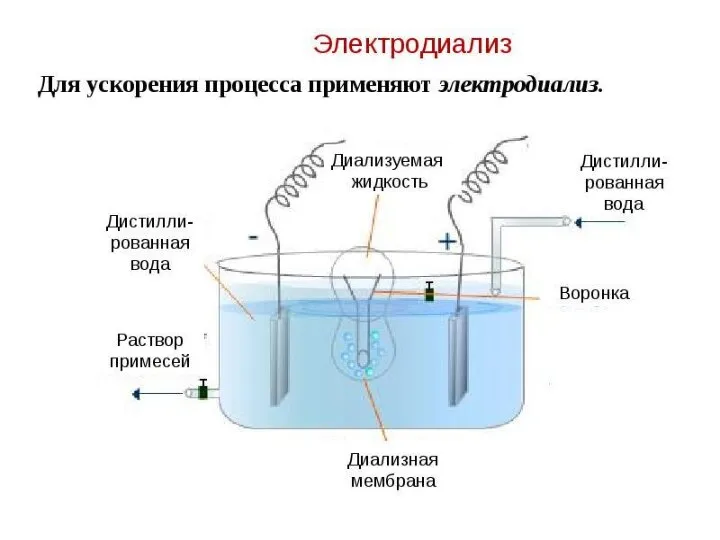
- 10. Мембранные методы очистки и концентрирования ферментных растворов Диффузионные – диализ- для очистки от низкомолекулярных примесей Электромембранные
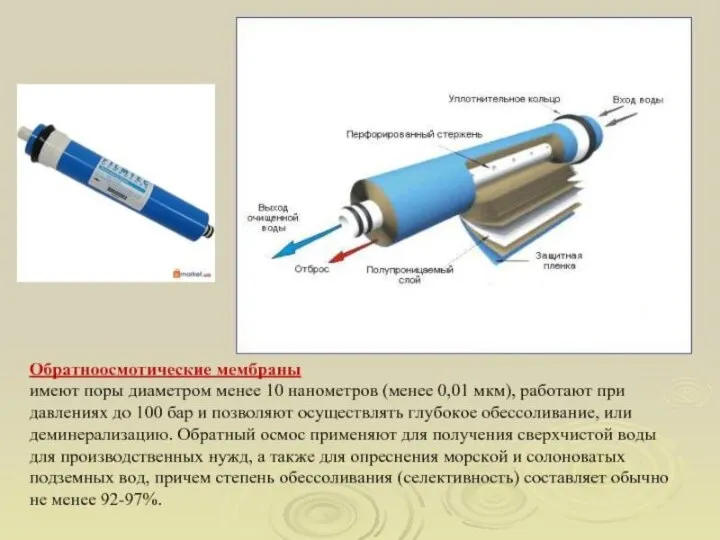
- 14. Мембранный процесс должен удовлетворять следующим требованиям: Высокая удельная производительность, компактность Высокая разделяющая способность Химическая стойкость мембраны
- 15. Селективность мембраны Селективность обратного осмоса, или задерживающая способность мембраны - важнейший показатель работы фильтрующего элемента. Это
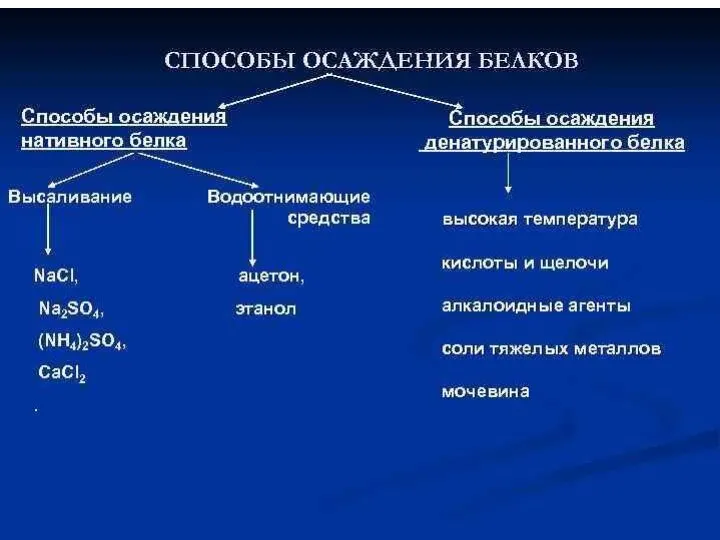
- 23. При высаливании можно добиться осаждения не только всего комплекса ферментов, но и его фракционирования. Растворимость белков
- 24. По силе высаливающего действия катионы Li+>Na+>K+ (NH4+). Чаще используют (NH4)2SO4, реже - NaCl. Ks зависит от
- 25. Внесение соли и способ ее растворения самая сложная стадия процесса высаливания соль измельчают и медленно добавляют
- 26. Факторы, влияющие на осаждение Размер молекулы белка Наличие в растворе некоторых ионов Температура ферментного раствора и
- 27. Из полимеров для осаждения и выделения используются декстраны и полиэтиленгликоль различной степени полимеризации Для осаждения обычно
- 28. Осадителями ферментов могут быть соли каприловой кислоты, риванол и многие другие соединения, имеющие как гидрофобные, так
- 29. Осаждение путем избирательной денатурации Только для стабильных ферментов -Глюкозоизомераза выдерживает температуру до 90-95°С. Помещая такие ферменты
- 30. Избирательная денатурация под воздействием рН применяется чаще - в экстремальных значениях рН происходит денатурация нецелевых белков.
- 31. Денатурация органическими растворителями перспективна, но требует высокой культуры производства и четкого соблюдения режимов денатурации, используется только
- 32. Разделение и очистка ферментов методами адсорбции Адсорбционные методы, особенно колоночная хроматография ,позволяют получить ферменты с наивысшей
- 33. При ионообменной хроматографии белки связываются с помощью электростатических сил. Типичные ионообменники - ДЭАЭ- диэтиламиноэтил и КМ-целлюлоза
- 34. Используют также афинную адсорбционную хроматографию или биоспецифическую хроматографию лигандообменную хроматографию белков и ферментов- (ЛОХ) МХАХ -
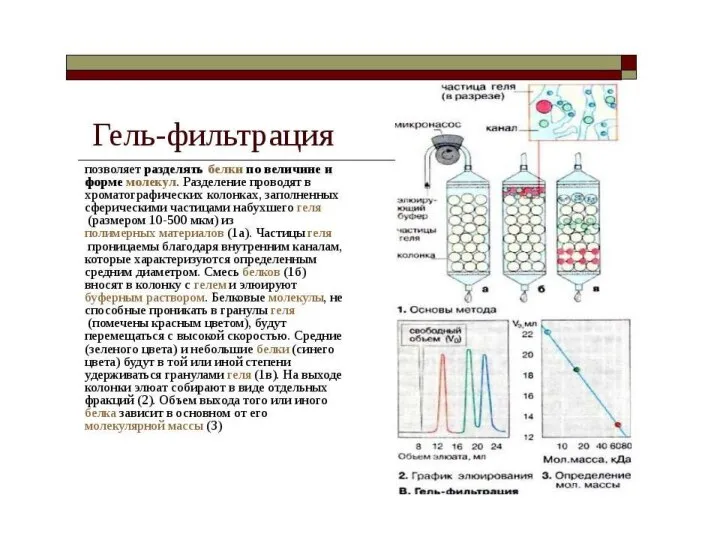
- 35. Разделение и очистка ферментов в растворе - наибольшее практическое значение получила гель-фильтрация. Гели получают на основе
- 37. При сушке ферментов и ферментосодержащих материалов возникает ряд трудностей, связанных с большой термолабильностью ферментов Вакуум-высушивание в
- 38. Сублимационная сушка - при глубоком вакууме Материал на начальных стадиях отдает часть влаги, охлаждается и самозамораживается.
- 39. Распылительная сушка позволяет быстро обрабатывать большие массы ферментных растворов и получать сразу сухой измельченный препарат, можно
- 40. Сохранение активности фермента в процессе сушки в большей степени зависит от источника получения ферментного препарата. Максимальной
- 41. Важно: Чем выше исходная концентрация сухого вещества в высушиваемой жидкости, тем меньше термостабильность ферментов при сушке.
- 42. Измельчение характеризуется степенью измельчения i= dнач / d кон, размер частиц до и после измельчения, который
- 43. В зависимости от размеров частиц различают следующие виды измельчения крупное 1500-200/250-25 мм среднее 150-25/25-5 мелкое 25-10/5-1
- 44. Измельчение можно производить Раздавливанием ударом, раскалыванием истиранием. Используют молотковые дробилки (мельницы), ударные мельницы -дезинтеграторы и дисмембраторы,
- 45. Важно: нельзя допускать повышения температуры; измельчение должно обеспечивать размеры частиц, необходимые для данного препарата; конструкция измельчающего
- 46. Микрокапсулирование имеет целью не только защиту фермента, но и создание возможности его многократного использования, а также
- 47. Два способа микрокапсулирования: химический - образование пленки на границе раздела фаз при реакциях полимеризации и поликонденсации
- 48. Гранулирование чаще для препаратов, используемых в синтетических моющих средствах. Гранулы должны быть по размеру близки к
- 49. Стандартизация ферментных препаратов для каждого выпускаемого препарата устанавливается средний уровень активности с запасом 20-30 %, определяется
- 51. Скачать презентацию









































 Обзор ключевых изменений в Федеральные государственные образовательные стандарты начального и основного общего образования
Обзор ключевых изменений в Федеральные государственные образовательные стандарты начального и основного общего образования Шестой поток. Асакти, привязанность
Шестой поток. Асакти, привязанность Влияние плавания на осанку
Влияние плавания на осанку Роль социально-бытовой ориентировки в адекватной интеграции обучающихся, воспитанников школы-интерната в системе современных
Роль социально-бытовой ориентировки в адекватной интеграции обучающихся, воспитанников школы-интерната в системе современных Связь математики с другими науками
Связь математики с другими науками Юриспруденция интересов и учение о праве и государстве Р. Иеринга
Юриспруденция интересов и учение о праве и государстве Р. Иеринга opyt_SShA
opyt_SShA AutoTrade Pro
AutoTrade Pro Полупроводники в жизни человека.
Полупроводники в жизни человека. Город России - Нижний Новгород 2 класс
Город России - Нижний Новгород 2 класс Бизнес-ситуация:Высокое качество обслуживания клиента за счет потерь от списания просроченного товара Дело № 38р
Бизнес-ситуация:Высокое качество обслуживания клиента за счет потерь от списания просроченного товара Дело № 38р Презентация на тему Прямолинейное равномерное движение
Презентация на тему Прямолинейное равномерное движение Сучасний заклад освіти
Сучасний заклад освіти Советский человек
Советский человек Транспорт
Транспорт Первая Мировая война
Первая Мировая война Художественная культура рубежа XIX – XX веков
Художественная культура рубежа XIX – XX веков Всероссийская олимпиада школьников по предметам (школьный,муниципальный, краевой этапы)2011 – 2012 учебный год
Всероссийская олимпиада школьников по предметам (школьный,муниципальный, краевой этапы)2011 – 2012 учебный год Музыкальные эпохи
Музыкальные эпохи Робототезника
Робототезника Урок математики 3 класс УМК «Школа России»
Урок математики 3 класс УМК «Школа России» Внедрение предмета Проектная деятельность учащихся в школьный компонент учебного плана
Внедрение предмета Проектная деятельность учащихся в школьный компонент учебного плана Контрольная работа по теме Невербальная коммуникация
Контрольная работа по теме Невербальная коммуникация Ф.И. Тютчев "Весенние воды"
Ф.И. Тютчев "Весенние воды" Березники
Березники Презентация на тему Социализация детей с тяжёлыми нарушениями речи
Презентация на тему Социализация детей с тяжёлыми нарушениями речи Эстафета искусств. 9 класс
Эстафета искусств. 9 класс Пасхальная тема в прикладном искусстве
Пасхальная тема в прикладном искусстве