Слайд 2Современные представления о структуре и действии лекарственных веществ

Слайд 4Количественные соотношения
«структура – БА»

Слайд 5Поиск БАВ
Скрининг
В 1966 году США для поиска противоопухолевых препаратов испытано 114 000

соединений, отобрано 12 как потенциальные лекарства, но ни одно не стало выдающимся препаратом
Слайд 6Поиск БАВ
Экономическая эффективность скрининга возрастает с увеличением числа тестируемых активностей

Слайд 7Поиск БАВ
Математическое моделирование – анализ связи структуры веществ и биологической активностью

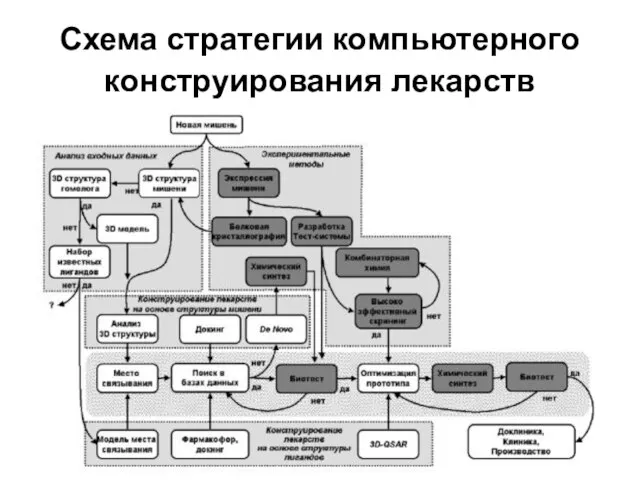
Слайд 8Схема стратегии компьютерного конструирования лекарств
Слайд 9Моделирование
Применение нейронных вычислительных сетей при построении моделей «структура - свойство»

Слайд 10Использование структурных параметров в количественных соотношениях «структура – биологическая активность»

Слайд 11Количественные соотношения «структура – БА»
Наличие корреляций позволяет делать некоторые заключения о природе

действия ХС
Слайд 12Количественные соотношения «структура – БА»
Была предсказана антибутирилхолинэстеразная активность 1-децил-3-(N-метилкарбамоил)пиперидина гидробромида за 3

года до его синтеза
Слайд 13Количественные соотношения «структура – БА»
Позволяет найти оптимальное лекарственное средство «на кончике пера»
62

соединения фениламидомочевины с антималярийным действием – уравнение – прогноз новых ХС – их синтез – испытание (оказались активнее известных)
Слайд 14Показатели БА
ЛД50 – летальная доза для 50%
ЛК50 – летальная концентрация для 50%

особей
НК50 – наркотическая концентрация (вызывает боковое положение 50% мышей)
Сmin – пороговая концентрация, вызывающая изменения характеристики рефлекса
Слайд 15Показатели БА
ПДК – предельно допустимая концентрация
Наиболее низкие коэффициенты зависимости устанавливаются для ЛД50
Наиболее

лучшие корреляции - для НК50
Слайд 16Параметры структуры
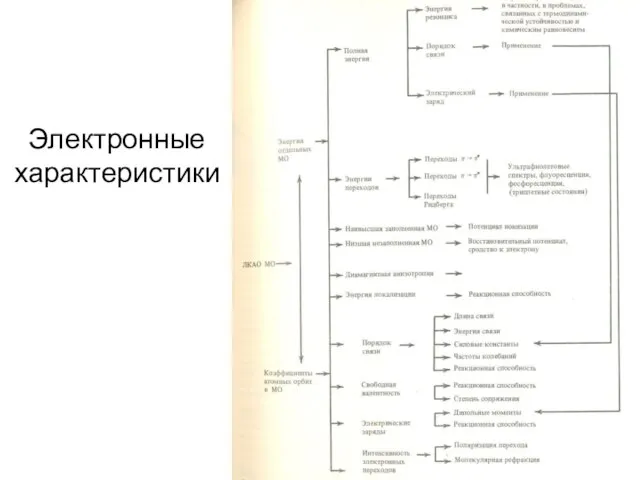
Надмолекулярный уровень (Sг, Sж, dtкип/dp0)
Молекулярный уровень [М, d, V(молек), dкрит, Ркрит,

χ (теплопроводность), Ср (теплоемкость), Тпл, Ткип, Рн (давление насыщенных паров), σ (поверхностное натяжение), η (вязкость), lgP или lgKом, Sр (растворимость), nD20, MR, μ, ε, I (потенциал ионизации), Da (абсолютная дисперсия), константы Гаммета, Е1/2]
Слайд 17Параметры структуры
Наилучшие корреляции наблюдаются для свойств молекулярного уровня
(но η и Рн не

дают высоких корреляций)
Квантово-химические параметры (энергии ВЗМО, НСМО, ΔЕ, заряды на атомах, вклады отдельных атомов в МО и т.д.)
Слайд 18Количественные соотношения «структура – БА»
Физическая интерпретация или объяснения полученным зависимостям
Бактериостатическая активность связана

≈ 18 показателями ХС
Токсическое действие ≈ 26 показателей
Слайд 19Количественные соотношения «структура – БА»
Возможно превращение ХС под действием физических факторов (фото,

термических, электрохимических), химических веществ
Связь структура – БА очень сложна
Нет универсальных характеристик ХС в определении БА
Слайд 20Количественные соотношения «структура – БА»
При поиске корреляций используется регрессивный анализ

Слайд 21Параметры структуры
Х. Мейер (1899 г) и Е. Овертон (1901 г) предложили, что

инертные вещества, вызывающие сон или наркотическое состояние и растворимые в липидах, способны вызывать эти состояния с эффективностью ~ коэффициенту распределения (липид-вода)
Ком = С(олифковое масло)/С(вода)
Слайд 22Коэффициент распределения
Гемолитическое действие некоторых неэлектролитов от коэффициента распределения (оливковое масло – вода)
log

Cгем = - 0.62 log K + 2.45
Слайд 23Параметры структуры
Количественные показатели гидрофобности ХС: lg растворимости, работа адсорбции в системе вода

– гептан (вода-воздух), энергия взаимодействия с неполярными органическими растворителями, поверхностная активность
Слайд 24Параметры структуры
Лазарев Н.В. – отечественный фармаколог – 1944 г. «Неэлектролиты. Опыт биолого-физико-химической

их систематики»
Главное внимание адгезии веществ (≈ гидрофильность)
Слайд 25Классификация неэлектролитов
А – сильные неэлектролиты (сильно притягиваются молекулами воды)
В - слабые неэлектролиты

(слабо притягиваются молекулами воды)
С – переходные электролиты
Слайд 26Классификация неэлектролитов (Ком)
А – гр.1 (<10-2), гр.2 (10-2…10-1)
В – гр.3 (10-1…100), гр.4

(100…101), гр.5 (101…102)
С – гр.6 (102…103), гр.7 (103…104), гр.8 (104…105), гр.9 (>105)
Ряды: 1 ряд – вещества с М <100
2 ряд – М = 100 …200 и т.д.
Слайд 27Классификация неэлектролитов (Ком)
В гомологическом ряду переход от низших групп к высшим
Специфическое действие

~ номеру группы (зависимость пораболическая)
Слайд 28Коэффициент распределения
Количественные связи между БА и коэффициентом распределения (октанол-вода), который характеризует гидрофобность

веществ
(можно определять экспериментально, можно рассчитать на основании структуры ХС)
Слайд 30Коэффициент распределения
Расчет с помощью ACD Labs
Задание
Рассчитать logP для ряда лекарственных препаратов

Слайд 31Уравнение Ханча
А = -ψ1•ln2P + ψ2•lnP + ψ3
где А – 1/c,
ψi

– коэффициенты, зависящие от структурных особенностей
Хорошие корреляции для цитостатических свойств производных нитрозомочевины, канцерогенной активности полициклических аренов
Слайд 32Задание
Какой интервал коэффициента распределения является оптимальным для биологической активности фенольных бактерицидов?

Слайд 33Коэффициент распределения
Хорошо коррелирует с токсичностью для веществ с высокой гидрофобностью
Для гидрофильных соединений

вклад в корреляционные соотношения вносят степень ионизации, заряд иона, μ, способность к образованию водородных связей и т.п.
Слайд 34Степень диссоциации
Для электролитов:
БА ~ α
Антибактериальная активность трифенилметановых красителей (Альберт, 1941)
Минимальная концентрация производных

акридина (101 соед.) для бактерий Streptococcus pyogenes (48 ч инкубации)
Слайд 35Задание
Найти корреляционную зависимость
9-аминоакридин 1/С=16•104 α=99
3-аминоакридин 1/С=8•104 α=72
2-аминоакридин 1/С=1•104 α=2
1-аминоакридин 1/С=1•104 α=2
3,9-диамино….. 1/С=16•104 α=100

Слайд 36П (парахор)
П = (М/ρ)•√√σ
М – молярная масса
ρ - плотность
σ - поверхностное натяжение

жидкости
Слайд 37Корреляции БА – П (парахор)
Получены зависимости:
Для замещенных в 5-м положении пентиламинов препятствовать

свертыванию крови
Активность местных анестетиков
Антимикробная активность пенициллинов
Слайд 38Корреляции БА – П (парахор)
Получены зависимости:
Фибринолитическая активность для 2- и 4-замещенных бензойных

кислот и 5-R-салициловых кислот
Biochem Pharmacol. 1975, V. 24, №10, Р. 1103-1109
Слайд 39Задание
Составить корреляционные уравнения БА ХС с парахором (П)

Слайд 40Свойства и действие ХС
Рише (1893 г) установил, что некоторые вещества по силе

их наркотического действия на мелких рыбок располагаются в обратной зависимости от их растворимости в воде
Слайд 41Физические параметры
БА ~ физические параметры
(Ткип, Тпл, ρ, nD20, ε, Ткип/M, Ткип/V(молек). Ткип/MR,

Тпл/M)
Зависимости не дают высоких корреляций
Слайд 42Задание
Найдите корреляционные уравнения, связывающие физические, или химические, или физико-химические характеристики вещества с

видом биологической активности
Слайд 43Хроматографические параметры
Хроматографические характеристики сравнительно легко определяются экспериментально и хорошо корреллируют со многими

физико-химическими и структурными параметрами
Слайд 44Хроматографические параметры
Использование хроматографических методов для изучения зависимости «структура - биологическая активность»
Корреляции типа

«удерживание — биологическая активность»
Слайд 45Задание
Найдите корреляционные уравнения, связывающие хроматографические характеристики веществ с данными по их биологической

активности
Слайд 46Спектральные характеристики
Параметры флуоресценции (λфл и квантовый выход - связывание с мишенью) ~

БА
Многомерные вектора спектральных характеристик ХС и БА исследовать трудно, необходимо упрощение на подмножества
Слайд 47Спектральные характеристики
Возможны ошибки
Отсутствие у стероидов СН3-групп (С18), лишающее их активности, практически не

скажется на их УФ спектрах
Слайд 48Спектральные данные
В отдельных случаях выявляются корреляционные зависимости биологической активности со специфическими пиками

ИК спектроскопии
Для замещенных бензолов – колебания С-Н связей вне плоскости ароматического кольца
Слайд 49Задание
Найдите корреляционные зависимости биологической активности выбранных вами химических соединений со специфическими пиками

в их ИК спектрах
Слайд 50Компьютерное моделирование
(квантово-химические
параметры)
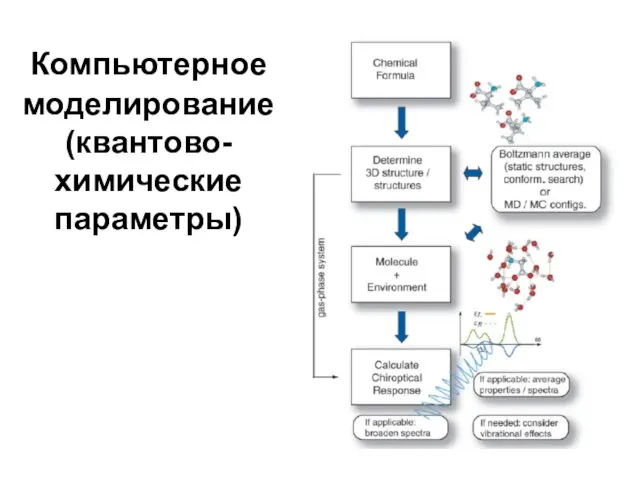
Слайд 51Основы компьютерного прогнозирования связи "структура-свойство"
Квантовохимические расчеты с помощью комплекса программ HyperChem
Выбрать

стерические, электронные, поляризационные свойства молекул
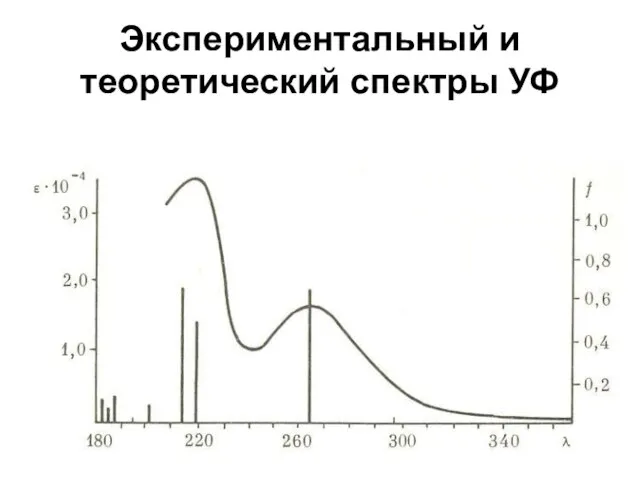
Слайд 53Основы компьютерного прогнозирования связи "структура-свойство"
Экспериментальные данные используются как критерий правильности теоретических

расчетов
Слайд 54Экспериментальный и теоретический спектры УФ
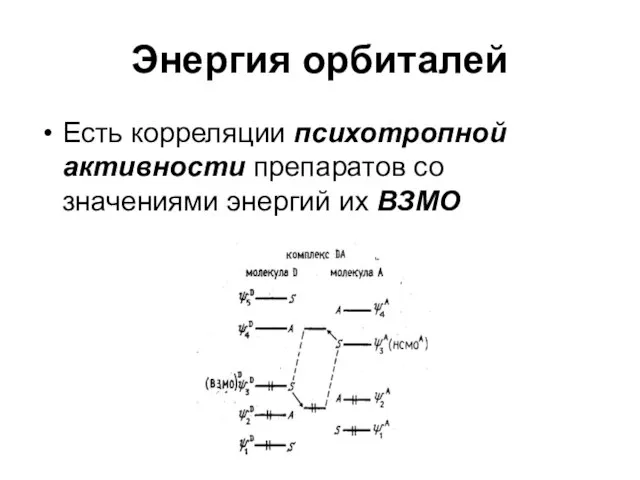
Слайд 55Энергия орбиталей
Есть корреляции психотропной активности препаратов со значениями энергий их ВЗМО
Слайд 56Ряд психотропных препаратов
Дофамин
Мескалин
2,5-диметокси-4-метил-амфетамин
N,N-диметилтриптамин
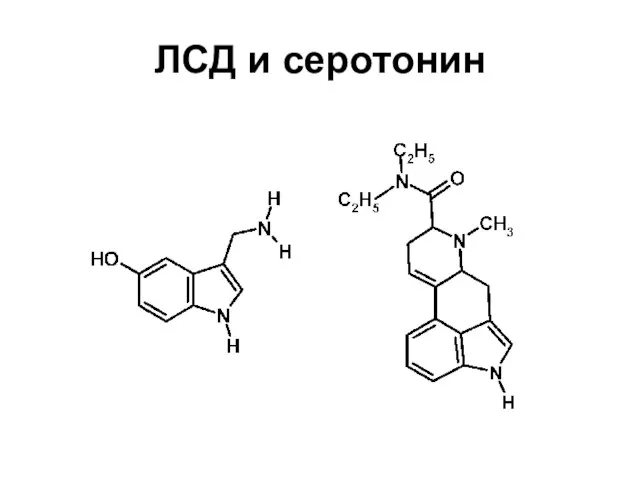
Серотонин
Хлорпромазин
Диэтиламид лизергиновой кислоты (ЛСД)
Предсказать ряд активности по энергиям ВЗМО

Слайд 57Потенциалы ионизации
В оценках нейротропной активности следует учитывать не только первый, но и

последующий потенциалы ионизации молекул препаратов
Слайд 58Потенциалы ионизации
Корреляция биологической активности со значениями потенциалов ионизации соответствует механизму переноса заряда,

при котором электронодонорная π-система молекулы психотропного препарата вступает во взаимодействие с электроноакцепторным центром рецептора
Слайд 59Энергия ВЗМО
Этим взаимодействием может быть комплексообразование, электрофильное замещение по ароматическому кольцу препарата,

образование π-связи рецептора с ароматическим кольцом и т.д.
Роль граничных орбиталей (ГО) в определении психотропного действия представляется весьма убедительной
Слайд 60Распределение электростатического потенциала
Одним из примеров корреляции биологической активности с распределением электростатического потенциала

в молекуле может служить изучение взаимодействия ЛСД и серотонина (и его аналогов – изомерных гидрокситриптофанов) с соответствующим рецептором
Слайд 62Распределение электростатического потенциала
Были рассчитаны контуры молекулярных электростатических потенциалов, показывающие векторы предпочтительной ориентации

молекулы по отношению к полю, генерируемому положительным зарядом
Слайд 63Распределение электростатического потенциала
Оказалось, что направления этих векторов существенно различаются для различных гидрокситриптаминов:

вектор молекулы 6-гидрокситриптамина почти перпендикулярен вектору 5-гидрокситриптамина
Слайд 64Распределение электростатического потенциала
Такое различие в условиях взаимодействия с рецептором может быть причиной

неодинаковой биологической активности серотонина и его аналогов
Слайд 65Распределение электростатического потенциала
Карта электростатического потенциала серотонина в значительной мере воспроизводится в молекуле

ЛСД, что и объясняет их чувствительность к одному и тому же рецептору (оба соединения способны оказывать сильные эффекты на деятельность центральной нервной системы)
Слайд 66Уравнение Гаммета
ХС6Н4СООН <=> ХС6Н4СОО- + Н+
lg(k/k0)= σρ, где
kо - константа скорости

или равновесия при Х=Н,
k - константа скорости при замещении водорода группой Х
ρ - константа, характеризующая данную реакцию в данных условиях
σ- константа, характеризующая заместитель Х (мера суммарных электронных эффектов)
Слайд 67Уравнение Гаммета
Принято ρ=1 для диссоциации мета- и пара-замещенных бензойных кислот в воде

при 25оС
Были рассчитаны σм и σп для различных заместителей
Можно найти ρ для других реакций
Зная ρ и σ, можно предсказать скорость реакции до ее проведения (если механизм одинаков)
Слайд 68Уравнение Гаммета
К орто-заместителям этот подход не оправдывается
Браун предложил σ+ для реакций,

при которых электронодонорная группа взаимодействует с образующимся в переходном состоянии положительным зарядом
Слайд 69Уравнение Гаммета
Предложены σ- (Тафт) для реакций, при которых образуется отрицательный заряд в

переходном состоянии
Слайд 70Уравнение Гаммета
Существуют таблицы с этими константами
Аналогичные расчеты можно проводить для других циклических

систем - нафталина, гетероциклов, для этиленовых, ацетиленовых углеводородов
Слайд 71Уравнение Гаммета
Уравнение Гаммета представляет собой линейное соотношение свободных энергий:
ΔG=-R∙T∙lnK
lgK-lgKo=σρ
-ΔG/2.3RT + ΔGo/2.3RT

= σρ
-ΔG = σρ∙2.3∙RT - ΔGo
Слайд 72Уравнение Гаммета
Для БА ХС
lg(А/А0)= σρ, где
Ао – БА для соединения с

Х=Н,
А - БА для ХС, с замещенным водородом группой Х
ρ - константа, характеризующая данную БА
σ- константа, характеризующая заместитель Х (мера суммарных электронных эффектов)
Слайд 73Аддитивная модель
Фри-Вилсона
БА - Σ активности типового соединения в гомологическом ряду и

активностей заместителя
Слайд 74Задание
Составить уравнения оценки вклада заместителя в общую активность ХС
log(1/c) = X +

log(1/c0)
Слайд 75Количественные соотношения «структура – БА»
Наличие корреляций позволяет делать некоторые заключения о природе

действия ХС
Слайд 76Нелинейные эффекты
Уравнения описывают линейную аддитивную комбинацию свойств заместителей в молекуле, между тем

нелинейные взаимодействия вносят существенный вклад в биологическую активность
Слайд 77Нелинейные эффекты
Обусловлены:
- кинетикой транспорта и распределения соединения в биологической системе
- лимитом

пространства для взаимодействия гидрофобных групп с сайтом связывания
- аллостерическими эффектами (связывание ХС с участками фермента вне активного центра влечет за собой конформационные изменения и его активности)
Слайд 78Нелинейные эффекты
Обусловлены:
- возрастающим метаболизмом липофильных аналогов
- ингибированием конечного продукта липофильными продуктами

ферментных реакций
- ограниченной растворимостью высших аналогов
- принципом минимальной оккупации рецептора
Слайд 79Уравнение Ганча
Для математического описания основных нелинейных эффектов, связанных с липофильностью, Ганч сформулировал

параболическую модель
Слайд 80Трехпараметровые уравнения Ганча-Фуджиты
Использование характеристик электронной структуры (константы Гаммета), стерических взаимодействий (стерические константы

Тафта) и транспортных свойств (коэффициент распределения в системе октанол - вода)
Слайд 81Уравнение Ганча
log(A)= aσ + bπ + cπ2 + dEs + eMR +

f
где π - липофильность (гидрофобность), Es -стерические факторы Тафта, MR - молярная рефракция и дисперсионные силы, σ - константы Гаммета
Величины σ, π, Es, MR относятся к отдельным заместителям и определяются по таблицам
Слайд 82Модель Ганча
Была сделана компьютерная модель транспорта в биологической системе с гипотетическими константами

и она не показала существенного отклонения от сторон параболы, что говорит о хорошем соответствии модели Ганча конкретным взаимодействиям
Слайд 83Взаимодействие ХС с рецептором
1) Обратимое образование комплекса вещества D с рецептором S
D

+ S ↔ D:S
2) Необратимое превращение комплекса в продукты
D:S → Q
Слайд 84Взаимодействие ХС с рецептором
Скорость образования продукта
dQ/dt = k2[D:S]
Константа равновесия
K1 = [D:S]/([D][S]) =
![Взаимодействие ХС с рецептором Скорость образования продукта dQ/dt = k2[D:S] Константа равновесия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/374065/slide-83.jpg)
exp(-ΔG/RT)
ΔG – свободная энергия Гиббса образования комплекса
Слайд 85Взаимодействие ХС с рецептором
Скорость образования продукта
dQ/dt = k2[D][S]exp(-ΔG/RT)
После интегрирования
Q = k2[D][S]exp(-ΔG/RT)t
Так как
[D]
![Взаимодействие ХС с рецептором Скорость образования продукта dQ/dt = k2[D][S]exp(-ΔG/RT) После интегрирования](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/374065/slide-84.jpg)
= AD0
A – вероятность достижения рецептора (постоянная для данного ХС)
Слайд 86Взаимодействие ХС с рецептором
ln(1/D0) = lnA - ΔG/RT + ln|S| + ln(t/Q)

+ lnk2
Где D0 – ЛД50, ЕД50 и т.д.
Принимая, что механизм действия одинаков - ln|S|, ln(t/Q), lnk2 – const
ln(1/D0) = lnA - ΔG/RT + C
Слайд 87Взаимодействие ХС с рецептором
Из подхода Гаммета-Тафта
ΔG ~ Σσi и ΣЕi
ln(1/D0)

= lnA + a1Σσi + a2ΣЕi + a0
А – связана с транспортом вещества до рецептора
Модель: вещество путем диффузии проходит поочередно через водные и липидные фазы
Слайд 88Взаимодействие ХС с рецептором
Принимают, что объем всех фаз и поверхность раздела между

ними одинаковы
Считаем, что константы скоростей диффузии из воды в липид и обратно не зависят от номера фазы
Слайд 90Коэффициент распределения
Вводят новую переменную lnP, где Р – коэффициент распределения между водой

и липидной фазой (от 0.001 до 1000)
Р = k12/k21
Решая систему уравнений вычисляли lnCn – полученные точки хорошо обрабатываются параболой
Слайд 91Коэффициент распределения
lnCn = a ln2P + b lnP + c
Так как, Cn

= А•D0
ln(1/D0) = lnA + a1Σσi + a2ΣЕi + a0
Слайд 92Уравнение Ганча
Методология Ганча хорошо работает в узких рядах гомологичных соединений
Как отнести

новое ХС к определенному ряду?
Слайд 94Элементарный состав химического соединения и расположение его атомов и связей между ними

в пространстве полностью определяют физические, химические свойства соединения, а также его биологическую активность
Слайд 95QSAR
Quantitative Structure-Activity Relationships
Слайд 96QSAR
Направление, возникшее, на стыке органической химии, хемометрики, математического моделирования и компьютерной химии

Слайд 97QSAR
Целью методов QSAR является поиск корреляций между любой из форм биологической активности

и структурными, физико-химическими и квантово-химическими параметрами исследуемого химического соединения
Слайд 98КССА
Количественные соотношения структура - активность

Слайд 99QSAR
В основе метода QSAR лежит утверждение о том, что активность и параметры

соединения связаны известной математической функцией:
BA = F(S)
где ВА - биологическая активность,
S - физико-химические и/или квантово-химические характеристики исследуемого соединения
Слайд 100QSAR
Функция F обычно представляет собой математическое выражение, полученное с помощью статистических методов

(примером может служить широко используемая многофакторная линейная регрессия)
Слайд 101Линейно-регрессионное
QSAR-уравнение
log(A)= Σxi•zi + μ
А - это какой-либо биологический ответ
xi -

дескриптор, который описывает присутствие или отсутствие i-ого заместителя
zi - вклад i-ого заместителя в log(A)
μ - константа
Слайд 102Химическое соединение
ХС разбивается на фрагменты многократно, с суперпозицией отдельных фрагментов

Слайд 103Достоинства метода QSAR
При использовании QSAR-метода исследователю не нужно знать вид
зависимости ВА

= F (S)
Число структурных параметров S может быть достаточно большим
Для QSAR-метода не требуется молекула-эталон (выбор ее зачастую субъективен)
Слайд 104Достоинства метода QSAR
Достаточно знать ранговую оценку свойства ВА (это важно, когда

ВА определяется с достаточно большой погрешностью)
Классификацию молекул по свойствам на основе структурных характеристик можно проводить, варьируя число классов
Слайд 105Достоинства метода QSAR
Количественная оценка соответствия между структурой и свойствами позволяет лучше

понять их взаимосвязь, которая иногда может быть не очень четко выражена в случае большого количества разрозненных данных
Слайд 106Достоинства метода QSAR
QSAR позволяет синтезировать химические соединения с заданными биологическими свойствами
Возможно

предсказание свойств еще не синтезированных химических соединений
Слайд 107Достоинства метода QSAR
Результаты могут быть использованы для лучшего понимания взаимодействий имеющихся между

функциональными группами молекул
и функциональными группами молекул мишеней
Слайд 108Недостатки метода QSAR
Возникновение недостоверных корреляций из-за чрезмерного доверия к биологическим
данным, полученным

экспериментальным путем
Слайд 109Недостатки метода QSAR
Иногда, эксперимент, от которого зависят результаты QSAR-анализа, может быть

плохо продуман, из-за чего полученные в результате эксперимента данные могут быть ошибочными
Слайд 110Недостатки метода QSAR
Некоторое физико-химические и квантово-химические параметры соединений могут оказаться взаимокоррелируемыми,

что может привести к неверным выводам о биологической активности исследуемого соединения
Слайд 111Недостатки метода QSAR
При применении QSAR наиболее эффективными структурными параметрами S являются

лишь те, которые имеют монотонный характер
влияния на исследуемое свойство ВА
Слайд 112Дескрипторы химической структуры
Число или набор чисел, которые характеризуют структуру химического (органического) соединения,

причем характеризуют так, что они описывают наиболее существенные черты этой структуры
Слайд 113Дескрипторы химической структуры
Любое число, которое можно рассчитать исходя из структурной формулы (молекулярный

вес, число определенных атомов, связей или групп, молекулярный объем, частичные заряды на атомах и т.д.)
Слайд 114Дескрипторы
При создании моделей структура - биологическая активность большое значение в отборе дескрипторов

имеют современные представления о процессах в организме, происходящих с участием химических веществ
Слайд 115Дескрипторы элементного уровня
Молекулярная масса
Число атомов какого-либо сорта
Атомные массы заместителей
Молярная

рефракция и др.
содержат слишком мало информации о молекулярной структуре
Слайд 116Топологические дескрипторы
Рассчитываются на основе описания структурной формулы соединения с помощью молекулярного

графа G, представляющего собой двумерное отображение молекулы (вершины соответствуют атомам, а ребра - химическим связям молекулы)
Слайд 117Топологические дескрипторы
Фрагменты структуры, индексы атомов и связей, каппа-индексы, описывающие форму молекулы,

индексы молекулярных связей
Индекс Плата F(G) равен сумме степеней каждого ребра в графе G
Слайд 118Топологические дескрипторы
Число Винера (Σ кратчайших путей)
Индекс Балабана
Теоретико-информационные индексы графов обеспечивают

количественную меру симметрии соответствующей структуры
Слайд 119Дескрипторы электронной структуры
Заряды на атомах (для сильно полярных реагентов) или электронные

плотности
Значения граничных орбиталей (ВЗМО и НСМО)
Значения вкладов отдельных атомов в граничные орбитали
Дипольные моменты
Поляризуемость
Слайд 120Липофильность
характеризует транспортные свойства соединений в биологических объектах
Распределение (Р) соединений в

модельной системе октанол-вода
IgP для нейтральной формы соединения
рКa для ионизированных веществ
Слайд 121Геометрические параметры молекул
Длины связей
Валентные углы
Торсионные углы
Размеры молекулы и т.д.

Слайд 122Методика QSAR
Весь массив соединений с известной характеристикой биологической активности делят на:
обучающий ряд

(обучающая выборка)
тестируемый ряд (контрольная выборка)
Слайд 123Обучающий ряд
Статистический анализ позволяет выявить зависимость и степень зависимости биологической активности от

значения того или иного дескриптора или группы дескрипторов
Слайд 124Обучающий ряд
Математическая зависимость данной биологической активности от значений наиболее значимых дескрипторов

Слайд 125Тестируемый ряд
Проверка полученной математической зависимости данной биологической активности от значений выбранных дескрипторов

Слайд 126Предсказанные и опытные значения LC50

Слайд 127QSAR
Справочников по QSAR-уравнениям пока нет
Обзоры в Chemical Rev.
Слайд 129Примеры уравнений
Производные 1,2,3-тиадиазола – фунгицидная активность (AF) Verticilium dahliae на хлопке

Слайд 130Примеры уравнений
средний молекулярный вес AMW
значение атомного Вандерваальсового радиуса для атомов углерода Mv
значение

атомной поляризуемости для атомов углерода Mp
количество атомов хлора nCl
топологический электронный дескриптор частично тяжелого заряда PCWTe
количество вращающихся связей RBN
относительный отрицательный заряд RNCG
Слайд 131Примеры уравнений
Производные 1,2,3-триазола – фунгицидная активность (AF) Verticilium dahliae на хлопке
Производные

1,2,3-триазола – фунгицидная активность Gibberella zeae на пшенице (G)
Слайд 132Мутагенная/канцерогенная активность
Определение множества дескрипторов для каждой молекулы, их корреляций с мутагенной/канцерогенной активностью,

отбор наиболее значимых дескрипторов, вносящих наибольший вклад в биологическую активность, требуют использования специальных компьютерных программ
Слайд 133Предсказание генотоксичности
Пакеты программ CASE, MULTICASE, META
Rosenkranz H.S., Klopman G. // Toxicol. Ind.

Health. 1988. V.4. P. 533-540
Klopman G., Rosenkranz H.S. // Mutat. Res. 1994. V. 305. P.33-46
Klopman G., Ddimayuga M., Talafos J. // J. Chem. Inf. Comput. Sci. 1994. V.34. P. 1320-1325
Слайд 134CASE
Обучаемая программа, начинает свою работу со считывания всех структур в обучающей выборке

и их фрагментирования на цепочки по 2-10 связанных неводородных атомов, затем программа для этих фрагментов оценивает вероятность их соотношения с активностью, используя биноминальный и другие статистические методы
Слайд 135MULTICASE
Отбирает наиболее значимые из этих фрагментов как биофоры, считая их ответственными за

активность, наблюдаемую у соединений, содержащих эти фрагменты
Биофор понимается как участок локализации основных реакций, приведших к появлению активности
Слайд 136MULTICASE
Затем программа идентифицирует внутри уменьшенной обучающей выборки молекул, содержащих биофоры, фрагменты и

физико-химические свойства, играющие роль в модуляции активности биофоров
Слайд 137CASE и MULTICASE –анализ
Полностью автоматизирован и удобен для пользователя
Для оценки новой молекулы

программа сначала проверяет наличие в ней биофоров, если их нет, то молекула предсказывается как неактивная; если молекула содержит биофоры, тогда исследуется наличие модуляторов для этих биофоров – результатом является качественное и количественное предсказание активности
Слайд 138CASE и MULTICASE –анализ
Получаемые уравнения QSAR действительны только внутри домена, определяемого соответствующими

биофорами
Слайд 139МЕТА – программа
Канцерогенность и мутагенность часто ассоциируется с электрофильным потенциалом молекулы,

однако, электрофильность молекулы может выявиться или сразу, или после одного или нескольких этапов метаболической трансформации
Слайд 140МЕТА – программа
Для решения проблемы метаболической трансформации ксенобиотиков была создана экспертная

программа МЕТА
Слайд 141МЕТА – программа
Использует предварительно установленные правила в идентификации структурных мишеней для некоторых

ферментов и преобразует эти мишени, имитируя метаболическую трансформацию
Слайд 142Метаболиты
По их потенциальной биологической активности: терапевтически активные, неактивный экскретируемый, неактивный неэкскретируемый, потенциально

токсичный т.д.
Слайд 143Метаболиты
Различные метаболиты могут локализоваться в различных тканях в зависимости от способа введения,

коэффициента распределения, способности связываться различными белками и от специфических для соединения механизмов действия
Слайд 144МЕТА – программа
Проблема влияния растворимости на метаболическую трансформацию решается с помощью программы

LOGP, входящей в пакет МЕТА, и рассчитывающей коэффициенты распределения октанол-вода
Слайд 145МЕТА – программа
В зависимости от расчетной величины logP, молекула подлежит или не

подлежит трансформации соответствующим ферментом, также оценивается ее способность проходить через мембрану или двигаться от органа к органу
Слайд 146Пути биотрансформации
Большинство данных касается путей биотрансформации различных метаболитов для животных, а не

для человека
Первый этап оценки стабильности метаболитов, основывается на общих для всех видов реакциях, а специальные задачи могут быть решены с учетом различий метаболизма между видами
Слайд 147Пути биотрансформации
В отдельных случаях могут рассматриваться генетически обусловленные индивидуальные вариации метаболизма, такие

как полиморфизм, связанный с N-ацетилированием и P-450-опосредованным окислением
Слайд 148МЕТА – программа
После каждого этапа трансформации программа с помощью словаря спонтанных реакций

оценивает стабильность полученного метаболита и продолжает трансформировать структуру до образования конечного продукта, нестабильные метаболиты автоматически разрушаются
Слайд 149МЕТА – программа
Метаболиты, оцениваемые как потенциально мутагенные/канцерогенные, вносятся в базу данных CASE

или MULTICASE
Слайд 150Пример использования
QSAR-анализа
Проведено сравнительное изучение мутагенной активности производных бифенила, флуоренона, фенантренхинона, пирена

и его гетероциклических аналогов в тесте Эймса на штамме Salmonella typhimurium TA 1538 (всего 60 соединений)
Слайд 151Пример использования
Большинство из исследованных соединений показало мутагенную активность и некоторые из них

индуцируют до 7000 ревертантов/нмоль
Слайд 152Пример использования
Любимова И.К., Абилев С.К., Мигачев Г.И. // Генетика, 1995. N 2.

С. 268-272
Баскин И.И., Любимова И.К., Абилев С.К., Палюлин В.А., Зефиров Н.С. // Доклады АН. 1993. Т. 332. N 5. С. 587-589
Баскин И.И., Любимова И.К., Абилев С.К., Палюлин В.А., Зефиров Н.С. // Доклады АН. 1994. Т. 339. N 1. С. 106-108
Любимова И.К. Зависимость мутагенной активности полициклических ароматических соединений от их структуры. Автореферат канд. диссертации. М. 1994. 25 с.
Слайд 153Анализ данных
Пара-положение нитро- и амино-групп определяет высокую мутагенную активность, наличие же заместителей

(нитро-, ацетил-, карбонил- ) в других положениях ослабляет или усиливает эту активность
Слайд 154Уравнения QSAR
Для получения уравнений QSAR на выборке исследованных соединений были выбраны следующие

дескрипторы:
d1 – энергия нижней незанятой молекулярной орбитали (LUMO);
d2 – величина максимального заряда на атоме азота;
d3 – величина максимального заряда на атоме кислорода;
d4 – logP (липофильность);
d5 – наличие нитрогруппы в пара- положении;
d6 – наличие аминогруппы в пара- положении;
d7 – наличие заместителей в мета- и орто- положениях
Слайд 155Квантово-химические параметры
Рассчитывали по методу Хюккеля, анализ корреляций между дескрипторами и мутагенной активностью

проводили с помощью программы “EMMA” (Effective Modeling of Molecular Activity), которая позволяет осуществить множественный линейный регрессионный анализ
Слайд 156Уравнения QSAR
Соединения были разделены на 2 группы:
первая включала гетероциклические аналоги пирена,

производные фенантрена и флуоренона;
вторая – производные бифенила
Слайд 157Уравнения QSAR
Была получена серия регрессионных уравнений со следующими параметрами:
Nhis+ - число his+

ревертантов при дозе 7.5 нмоль/чашку;
R – коэффициент корреляции между экспериментальными и прогнозируемыми значениями логарифма числа his+ ревертантов;
Sv – среднеквадратичная ошибка прогноза логарифма his+ ревертантов в контрольной выборке;
F - значение критерия Фишера
Слайд 158Уравнения QSAR
Для гетероциклических аналогов пирена и производных фенантрена и флуоренона (всего 39

соединений)
ln(Nhis+) = 0.88 d1 + 2.08 d5 + 1.07
R = 0.72; Sv = 1.31; F = 14.72
ln(Nhis+) = -1.05 d1 + 1.84 d5 – 0.34 d7 + 1.04 R = 0.75; Sv = 1.24; F = 11.25
ln(Nhis+) = -2.64 d1 - 1.10 d2 - 8.93 d3 –
1.34 d5 + 0.89 d6 - 3.93
R = 0.80; Sv = 1.21; F = 6.68
Слайд 159Уравнения QSAR
Для замещенных бифенилов (21 соединение)
ln(Nhis+) = 2.1 d1 – 0.57 d4

- 0.13
R = 0.82; Sv = 1.12; F = 16.37
Для всех соединений (объединенной группы соединений)
ln(Nhis+) = 1.77 d1 - 0.22 d2 - 0.9 d5 - 0.52 R = 0.75; Sv = 1.94; F = 18.80
Слайд 160Уравнения QSAR
Все эти соединения удовлетворительно прогнозировали мутагенную активность контрольных выборок соединений (3

производных пирена и фенантрена и 2 производных бифенила)
Слайд 161Уравнения QSAR
Во всех уравнениях присутствует дескриптор d1 – энергия LUMO, которая характеризует

способность соединения реагировать с нуклеофилами, т.е. его электрофильность
Слайд 162Анализ уравнений QSAR
Характеризующих взаимосвязь структура-активность в группе разнородных соединений, включающей гетероциклические аналоги

пирена, производные фенантрена и флуоренона показывает, что величина R зависит от числа включенных в уравнение дескрипторов
Слайд 163Анализ уравнений QSAR
R = 0.80 достигается только при включении в QSAR-модель таких

дескрипторов как d2 и d3, характеризующих величину максимального заряда на атомах азота и кислорода, соответственно
Слайд 164Анализ уравнений QSAR
Наличие в этом уравнении дескрипторов d5 и d6 , характиризующих

наличие нитро- и амино- группы в пара- положении, соответственно, отражает эмпирические выводы, сделанные на основе анализа экспериментальных данных
Слайд 165Анализ уравнений QSAR
Дальнейшее повышение коэффициента корреляции между экспериментальным и прогнозируемым значением мутагенной

активности (логарифм числа his+ ревертантов) достигается только при увеличении числа квантово-химических и подструктурных дескрипторов
Слайд 166Анализ уравнений QSAR
Увеличение числа дескрипторов в уравнениях QSAR, сужает круг прогнозируемых структур

Такое уравнение будет прогнозировать активность в реальной ситуации не лучше, чем уравнения с дескрипторами, характеризующими наиболее общие свойства обучающей выборки
Слайд 167Анализ уравнений QSAR
Прогностическая ценность уравнений QSAR зависит от ряда общих проблем, касающихся

принципов подготовки материала для анализа методами SAR и QSAR
Слайд 168Анализ уравнений QSAR
Подходы к изучению взаимосвязи структура-активность основаны на существующих знаниях о

физико-химических свойствах исследуемых соединений и о механизмах их биологической активности
Все это зависит от современного уровня знаний, точек зрения, предположений, которые могут быть верными и неверными
Слайд 169Проблемы использования метода QSAR
Размер и неоднородность базы данных
От размера и однородности

обучающей выборки зависит прогностическая способность уравнений QSAR
Слайд 170Проблемы использования метода QSAR
Большая и однородная база данных, полученная на группе

родственных соединений, позволяет получить уравнение с высокими предсказательными возможностями и с ограниченным числом дескрипторов, описывающих главные свойства химических соединений, с которыми связано наличие или отсутствие биологической активности
Слайд 171Проблемы использования метода QSAR
Неоднородная база данных и, соответственно, такая же обучающая

выборка, не позволяет получить уравнения с высокими предсказательными возможностями
Увеличения значения R для таких выборок можно достичь только за счет увеличения ее размера или числа дескрипторов
Слайд 172Проблемы использования метода QSAR
Проблема выделения дескрипторов
Можно использовать всевозможные квантовые, физико-химические свойства и

структурные характеристики, а затем с помощью статистических процедур отбирать те из них, которые лучше всех коррелируют с активностью
Слайд 173Проблемы использования метода QSAR
Такой подход нуждается в проведении большой предварительной работы, (расчета

квантово-химических параметров для каждого соединения, включенного в базу данных, с помощью специальных программ)
Слайд 174Проблемы использования метода QSAR
Поэтому при анализе структура-активность химических мутагенов особое внимание уделяется

механизмам мутагенного действия химических соединений (алкилирование, интеркаляция и т.д.)
Слайд 175Проблемы использования метода QSAR
Известно, что мутагенная активность отражает способность молекул к реакции

с азотистыми основаниями ДНК
В таком случае общим свойством соединений с мутагенной активностью является наличие в их молекуле электрофильных свойств или эти сайты образуются в результате метаболизма
Слайд 176Проблемы использования метода QSAR
Для выделения таких “структурных алертов” необходимы глубокие знания химии

и метаболизма соединений, чего нет на практике
Электрофильная теория не может быть признана единственно верной
Слайд 177Проблемы использования метода QSAR
Анализ баз данных по мутагенной активности нитро- и аминоароматических

соединений
Чтобы отличить мутагенные соединения от немутагенных при наличии у всех структурного алерта – нитро- или амино- группы, необходимо обязательно учитывать наличие дескрипторов-модуляторов мутагенной активности
Слайд 178Проблемы использования метода QSAR
Если энергию LUMO, отражающую электрофильность молекулы и logP -

показатель ее биологической доступности, принять за основные дескрипторы, то другие дескрипторы являются модуляторами мутагенной активности
Слайд 179Уравнение QSAR
Уравнение для бифенильных соединений:
ln(Nhis+) = - 111 d1 – 2.66

d2 – 36.7 d3 – 10.4 d4 + 0.967
R = 0.95; Sv = 0.69; F = 35
Слайд 180Уравнение QSAR
где d1 – минимальный квадрат коэффициента вклада атомной орбитали углерода в

низшую свободную молекулярную орбиталь
d2 – минимальный квадрат коэффициента вклада атомной орбитали азота в низшую свободную молекулярную орбиталь
d3 –максимальный индекс свободной валентности на атоме углерода
d4 – среднее значение индекса свободной валентности на атомах кислорода
Слайд 181Уравнение QSAR
Уравнение отличается от прежнего уравнения более высоким уровнем коэффициента корреляции R=0.95
Но,

оно не отражает возможного механизма мутагенного действия соединения и не имеет очевидного биологического смысла, что затрудняет его восприятие с точки зрения биолога-экспериментатора
Слайд 182Уравнение QSAR
Возникает дилемма
Выбирать дескрипторы исходя из механизмов мутагенного действия и результатов

анализа экспериментальных данных
Перебирать всевозможные квантовохимические параметры
Слайд 183Уравнение QSAR
Реальная предсказательная ценность уравнений второго типа пока остается неизвестной

Слайд 184QSAR – анализ
При существующем разнообразии программ QSAR и баз данных по мутагенной

активности химических соединений в различных тест-системах, достаточно корректное уравнение QSAR можно получить только при совместной работе биологов, химиков, математиков
Слайд 185QSAR – анализ
Определение цели – получить корреляции между активностью и структурными особенностями

молекулы (качественный анализ – SAR) или получить коэффициент корреляции между экспериментальными и прогнозируемыми значениями мутагенной активности (количественный анализ – QSAR)
Слайд 186QSAR – анализ
В последнем случае количественные экспериментальные данные анализируются и формализуются
Решается

вопрос об однородности базы данных
Если принимается обоснованное решение о разделении базы данных на подгруппы, то дальнейший анализ проводится для каждой подгруппы по отдельности
Слайд 187QSAR – анализ
Выбор дескрипторов зависит от общих знаний механизма мутагенного действия, от

возможности программ, которые предполагается использовать для расчета квантовохимических параметров и анализа фрагментов структур, а также для регрессионного анализа связи между рассматриваемыми дескрипторами и мутагенной активностью
Слайд 188QSAR – анализ
В конечном итоге выбираются те уравнения QSAR, которые достаточно удовлетворительно

прогнозируют активность соединений, отнесенных к контрольной выборке
Слайд 189QSAR – анализ
Речи сегодня о замене теста Эймса или другого теста методологией

QSAR нет
Это возможно в будущем
Сегодня QSAR является хорошим инструментом для внеэкспериментального прогноза
Слайд 190Задание
Используя известное QSAR уравнение осуществите теоретическое конструирование новых ХС с данным видом

БА
Слайд 191Задание
Найдите корреляционные уравнения, связывающие ЛД50 химических веществ с параметрами их структуры

Слайд 192Задание
Обработайте массив экспериментальных данных зависимости БА ~ параметры ХС
Создайте систему данных,

аналогичную системе элементов Д.И. Менделеева
Слайд 193PASS
Prediction of Activity
Spectra for Substances

Слайд 194Биологическая активность
Обнаружение у веществ определенных свойств – по-прежнему случайное событие, но вероятность

проявления такого события резко возрастает
Слайд 195Пример
Аминазин (нейролептик) – использовался для непсихотропных целей, прежде чем были открыты его

свойства нейролептика
Слайд 196Примеры
ВИАГРА - силденафил - как антиагрегантное средство начал применяться в 1988 г.

и как препарат, стимулирующий эрекцию - в 1994 г.
Аспирин был предложен в качестве анальгетика в 1899 г., а его антиагрегантное действие было открыто лишь в 1971 г.; и т.д.
Слайд 197Пример
Талидомид, обладающий анксиолитическим и снотворным эффектами, был введен в медицинскую практику в

50-х годах
В начале 60-х годов из-за наличия тератогенности он стал причиной врожденных дефектов у более чем 8000 новорожденных, что привело к запрету на его применение
Слайд 198Пример
Сорок лет спустя, талидомид переживает «второе рождение» - он активно испытывается в

клинике как потенциальное противоопухолевое и антиметастатическое средство, как препарат для симптоматической терапии СПИДа
Слайд 199Компьютерная система прогноза
Собрать всю известную информацию о биологически активных соединениях, создать на

этой основе обучающую выборку, провести анализ связей "структура-активность" для веществ из обучающей выборки и построить соответствующие зависимости
"Подставив" в эти зависимости данные о структуре нового вещества, можно получить в результате оценку его биологической активности
Слайд 200КССА
Применимы к соединениям одного и того же химического класса
Оперируют с одним

видом биологической активности
Можно ли разработать подобные методы для веществ, гетерогенных как по химической структуре, так и по проявляемому ими биологическому действию?
Слайд 201PASS
Основа – характеристика активных частей молекулы
Расчет частоты субструктурной активности (ЧСА) – отношение

БАС, содержащих данную структуру, к числу соединений, имеющих эту структуру
Слайд 202PASS
Вычисляют из данных ЧСА среднюю арифметическую ЧСА для всей молекулы
ЧСА – предсказывает

БАВ
Слайд 203PASS
Выделение фрагментов фармакофоров
Определение частоты встречаемости этих фрагментов для определения видов БА

Слайд 204Дескрипторы
Топологические – не меняющиеся при деформациях молекулы (брутто-формула)
Топографические – пространственные соотношения между

компонентами молекулы (расстояния, углы)
Квантовомеханические или квантовохимические – электронная структура (ЕМО, q, порядок связи, индекс свободной валентности)
Слайд 205Дескрипторы
Химические – изменение состава, числа связей (ΔG, pK)
Физические (Vмолекулы, Тпл, Ткип,

nD20)
Физико-химические – взаимодействие с другими веществами без химической реакции (растворимость, хроматографические индексы)
Слайд 206PASS
Мера информативности дескриптора – отношение частоты встречаемости в подмассиве с данной активностью

к частоте встречаемости во всем массиве
ni/Ni : nj/N
Слайд 207PASS
Версия компьютерной системы предсказания спектра биологической активности PASS реализована в 1998 году

Институтом биомедицинской химии (Москва)
Слайд 208PASS
Она включала в себя обучающую выборку, содержащую более 30000 БАВ с известной

биологической активностью, и охватывала более 400 (900) фармакологических эффектов, механизмов действия, а также мутагенность, канцерогенность, тератогенность и эмбриотоксичность
Слайд 209PASS online
www.pharmaexpert.ru/
PASSOnline/

Слайд 211PASS online
Биологическая активность описывается в PASS качественным образом ("да"/"нет")
Выдаваемые результаты прогноза помимо

названий активности включают в себя оценки вероятностей наличия (Pa) и отсутствия каждой активности (Pi), имеющие значения от 0 до 1
Эти вероятности рассчитываются независимо, их сумма не равна единице
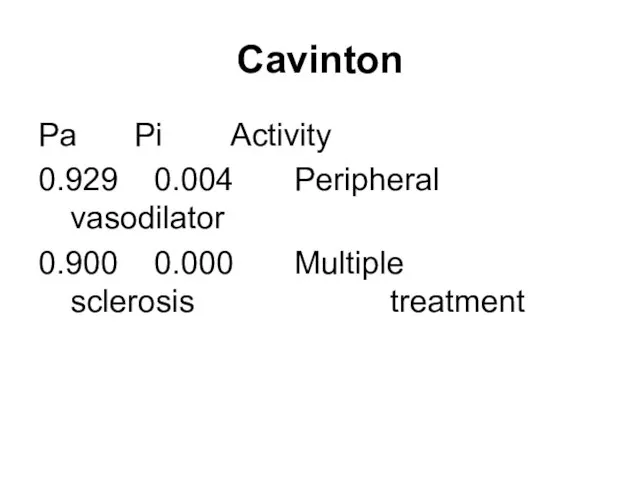
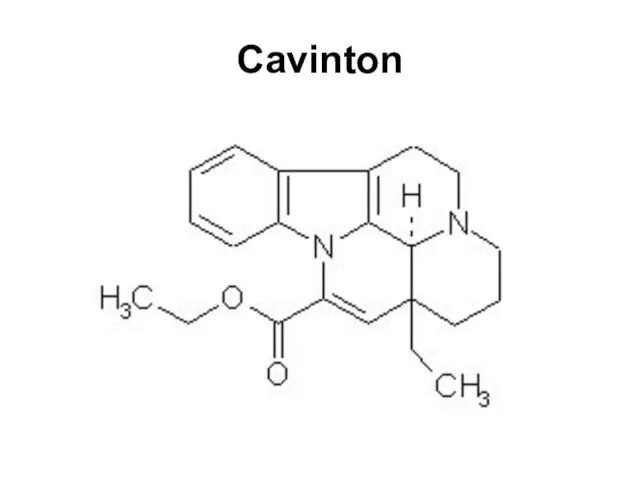
Слайд 212Cavinton
Pa Pi Activity
0.929 0.004 Peripheral vasodilator
0.900 0.000 Multiple sclerosis treatment
Слайд 214Задание
Рассчитать спектр предсказания биологической активности для Талидомида

Слайд 215PASS
Если целью исследования является поиск базовых структур лекарств, целесообразно отбирать из массива

доступных веществ не те структуры, для которых величина Pa близка к единице (они могут оказаться близкими аналогами известных препаратов), а соединения с Pa<0.7
Слайд 216PASS
Риск получения отрицательного результата в эксперименте тем больше, чем меньше величина Pa,

однако и новизна такой структуры (при подтверждении прогноза в эксперименте) будет более высокой
Слайд 217PASS
Если поставлена цель поиска близкого аналога известного препарата, то из массива имеющихся

образцов следует отобрать вещества с наибольшими значениями Pa
Слайд 218PASS
При отборе перспективных для исследований соединений можно руководствоваться комбинированным критерием:
- наличие в

прогнозируемом спектре требуемых эффектов/механизмов
- отсутствие нежелательных эффектов/механизмов
Слайд 219PASS
Может быть выполнен уже на этапе планирования синтеза
Будут синтезированы лишь некоторые из

теоретически возможных производных, в наибольшей степени удовлетворяющие критериям задачи
Слайд 220Компьютерная система интерпретации спектров биологической активности
Можно составить большое количество комбинаций из требуемых

и нежелательных эффектов
Слайд 221Компьютерная система интерпретации спектров биологической активности
Для их анализа сотрудник Лаборатории структурно-функционального конструирования

лекарств НИИ Биомедхимии РАМН А.А. Лагунин разработал специальную компьютерную систему интерпретации спектров биологической активности веществ IBIAC, основанную на знаниях об известных взаимосвязях между фармакологическими эффектами и механизмом действия биологически активных веществ (более 2000 терминов, описывающих биологическую активность)
Слайд 222Компьютерная система интерпретации спектров биологической активности
С использованием системы IBIAC генерация перечня эффектов,

соответствующих определенному механизму действия и, наоборот, списка вероятных механизмов, ответственных за проявление определенного эффекта, осуществляется автоматически
Слайд 223Ограничения РАSS
Имеет смысл прогноз для синтетических и биополимеров, для неорганических веществ и

т.п.
Слайд 224Ограничения РАSS
Наличие не менее 5 веществ с известной активностью для формирования обучающей

выборки
В случае принципиально новых мишеней действия лекарственных препаратов, для которых имеются данные только об 1-2 лигандах, предсказание биологической активности таким методом не может быть реализовано
Слайд 225Ограничения РАSS
В случае существенной по отношению к соединениям обучающей выборки новизны химической

структуры прогнозируемого вещества (более 3-х дескрипторов ни разу не встретились в обучающей выборке) результаты прогноза могут иметь значительную погрешность
Слайд 226Ограничения РАSS
Целесообразно протестировать вещество на требуемые виды активности независимо от результатов прогноза,

так как результатом может оказаться принципиально новая базовая структура
Слайд 227Ограничения РАSS
В некоторых случаях вещество прогнозируется одновременно как агонист и антагонист (стимулятор

и блокатор, активатор и ингибитор) по отношению к одним и тем же рецепторам (ферментам и т.п.)
Это означает, что система не может дифференцировать внутреннюю активность вещества, а лишь указывает на его способность к связыванию с данным рецептором (ферментом)
Слайд 228Система PASS
Не может предсказать, станет ли конкретное вещество лекарственным препаратом, поскольку это

будет зависеть также от многих других факторов (сравнительной оценки безопасности и клинической эффективности; наличия необходимых для разработки и внедрения инвестиций, и т.д.)
Слайд 229Система PASS
Прогноз, однако, может помочь определить, какие тесты наиболее адекватны для изучения

биологической активности конкретного химического вещества, и какие вещества из имеющихся в распоряжении исследователя наиболее вероятно проявят требуемые эффекты
Слайд 230Задание
Провести анализ прогноза видов БА для известного лекарственного препарата
(Сульфадимезин, Норсульфазол и др.)

Слайд 231Методы компьютерного моделирования
Позволяют ученым строить компьютерные модели «мишени» и определять структуру потенциального

«ключа»
Химики синтезируют это соединение
Слайд 232Лекарство от болезни Альцгеймера
С помощью компьютерного моделирования химики МГУ (Зефиров Н.С.) выяснили,

что димебон – лекарство от аллергии – может и должен обладать нейропротекторными свойствами
Слайд 233Лекарство от болезни Альцгеймера
Димебон недавно прошел клинические испытания в России
Российский препарат даже

пропустили на американский лекарственный рынок!
















































































![Взаимодействие ХС с рецептором Скорость образования продукта dQ/dt = k2[D:S] Константа равновесия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/374065/slide-83.jpg)
![Взаимодействие ХС с рецептором Скорость образования продукта dQ/dt = k2[D][S]exp(-ΔG/RT) После интегрирования](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/374065/slide-84.jpg)


















































































































































 FAKRO STANDART – СТАНДАРТ КАЧЕСТВА FAKRO STANDART – СТАНДАРТ КАЧЕСТВА Закаленное внешнее стекло Бессрочная гарантия от повреждения градом Мор
FAKRO STANDART – СТАНДАРТ КАЧЕСТВА FAKRO STANDART – СТАНДАРТ КАЧЕСТВА Закаленное внешнее стекло Бессрочная гарантия от повреждения градом Мор Психолого-педагогическая и предметная подготовка выпускников к ЕГЭ
Психолого-педагогическая и предметная подготовка выпускников к ЕГЭ Ономастическое путешествие: Польша
Ономастическое путешествие: Польша Как бороться с буллингом в школе
Как бороться с буллингом в школе Прощание с детским садом
Прощание с детским садом Мәселе
Мәселе Первая оценка и как к ней относиться
Первая оценка и как к ней относиться Презентация на тему Мифы
Презентация на тему Мифы  Использование технологии развития критического мышления учащихся (ТРКМ) на уроках
Использование технологии развития критического мышления учащихся (ТРКМ) на уроках тест н и нн в прилагательных
тест н и нн в прилагательных Презентация на тему Литература в годы Великой Отечественной войны 1941-1945 гг.
Презентация на тему Литература в годы Великой Отечественной войны 1941-1945 гг. Моделирование предметно-пространственной коррекционно-развивающей среды в группе компенсирующей направленности
Моделирование предметно-пространственной коррекционно-развивающей среды в группе компенсирующей направленности Контрольний норматив. Тести і нормативи оцінки фізичної підготовленості студентів
Контрольний норматив. Тести і нормативи оцінки фізичної підготовленості студентів Определение понятий элитаризм бюрократизм
Определение понятий элитаризм бюрократизм Чай. Как правильно заваривать чай
Чай. Как правильно заваривать чай Юбилейный свадебный тур выходного дня Корабль любящих сердец. Шаблон
Юбилейный свадебный тур выходного дня Корабль любящих сердец. Шаблон CERT AM servicesСервисы CERT AM
CERT AM servicesСервисы CERT AM Психологические основы индивидуальной работы с учащимися. Индивидуальная работа — это деятельность педагога, требующая знаний о
Психологические основы индивидуальной работы с учащимися. Индивидуальная работа — это деятельность педагога, требующая знаний о ФАКУЛЬТЕТ ГОСУДАРСТВЕННОГО УПРАВЛЕНИЯ (Бакалавриат) МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ М.В. ЛОМОНОСОВА.
ФАКУЛЬТЕТ ГОСУДАРСТВЕННОГО УПРАВЛЕНИЯ (Бакалавриат) МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ М.В. ЛОМОНОСОВА. Профессиональная компетентность и компетенции современного учителя
Профессиональная компетентность и компетенции современного учителя Контрактная служба
Контрактная служба Декларация об охране
Декларация об охране Территориальная организация банковской системы России. 11 класс
Территориальная организация банковской системы России. 11 класс Маркетинг. Вводная
Маркетинг. Вводная О реализации органами местного самоуправления Ярославской области требований федерального закона от 27 июля 2010 года «Об организац
О реализации органами местного самоуправления Ярославской области требований федерального закона от 27 июля 2010 года «Об организац Внешние параметры исследования личности
Внешние параметры исследования личности Ханты Мансийский автономный округ - Югра. г. Когалым . 2011г.
Ханты Мансийский автономный округ - Югра. г. Когалым . 2011г. Адаптация образовательного учреждения к новым образовательным стандартам по физической культуре
Адаптация образовательного учреждения к новым образовательным стандартам по физической культуре