Содержание
- 2. Введение В данной курсовой работе будет определяться химический состав минеральной воды «Шадринская» «Архыз » Производитель указывает,
- 3. Цели и задачи Цель: определить содержание Ca и Mg в минеральной воде методом комплексонометрии, HCO3- методом
- 4. Комплексонометрия Комплексонометрия – титриметрический метод анализа, основан на образовании прочных внутрикомплексных соединений (хелатов) между катионами металлов
- 5. Индикаторы в комплексонометрии Металлоиндикаторы — вещества, предназначенные для определения точки эквивалентности при комплексонометрическом титровании. Требования к
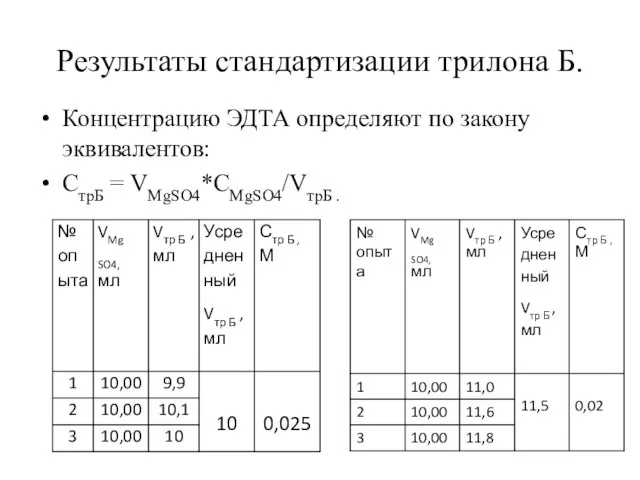
- 6. Результаты стандартизации трилона Б. Концентрацию ЭДТА определяют по закону эквивалентов: CтрБ = VMgSO4*CMgSO4/VтрБ .
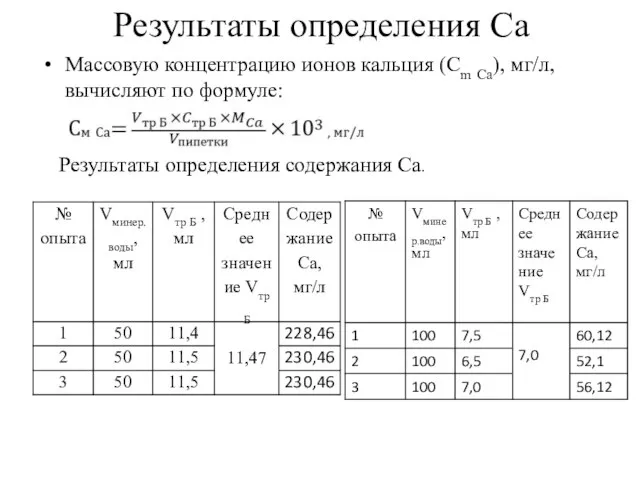
- 7. Результаты определения Ca Массовую концентрацию ионов кальция (Сm Са), мг/л, вычисляют по формуле: Результаты определения содержания
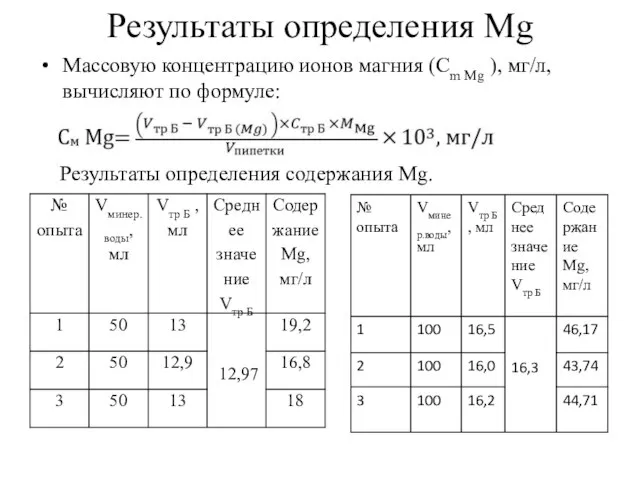
- 8. Результаты определения Mg Массовую концентрацию ионов магния (Сm Mg ), мг/л, вычисляют по формуле: Результаты определения
- 9. Потенциометрия Потенциометрический метод титрования основан на измерении потенциала электрода, погруженного в раствор. Величина потенциала зависит от
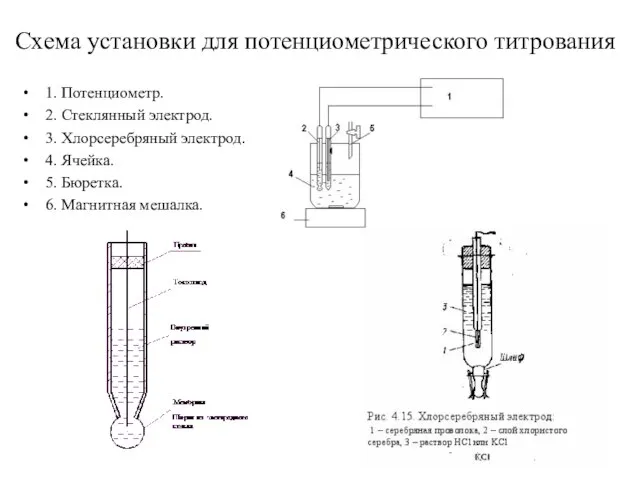
- 10. Схема установки для потенциометрического титрования 1. Потенциометр. 2. Стеклянный электрод. 3. Хлорсеребряный электрод. 4. Ячейка. 5.
- 11. Результаты стандартизации HCl Концентрацию HCl определяют по закону эквивалентов: С HCl *V HCl = С Na2CO3*V
- 12. Результаты титрования
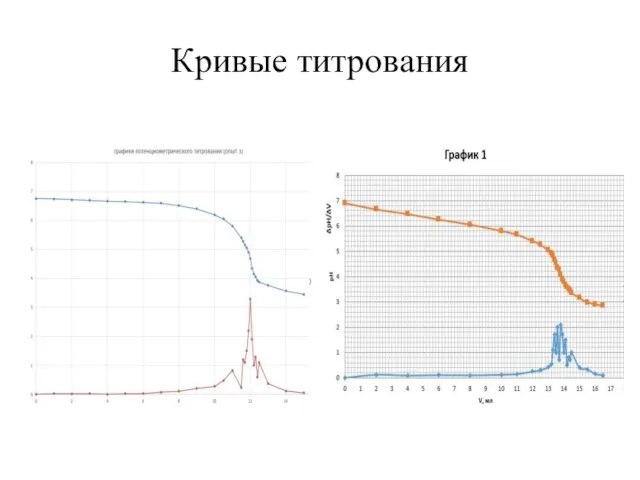
- 13. Кривые титрования
- 14. Статистическая обработка результатов анализа
- 15. Статистическая обработка результатов анализа
- 16. Статистическая обработка результатов анализа
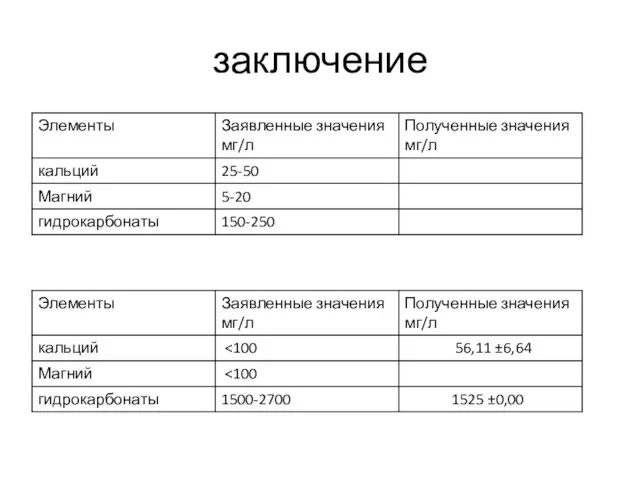
- 17. заключение
- 19. Скачать презентацию










 Волжский самородок
Волжский самородок Как разные животные готовятся к зиме
Как разные животные готовятся к зиме О вреде наркотиков
О вреде наркотиков Средство обучения, используемое в дистанционной технологии обучения
Средство обучения, используемое в дистанционной технологии обучения Внеклассное мероприятие по окружающему миру в 4 классе Автор: Аманжулова И.Ю. Учитель начальной школы МОУ БСОШ 2.
Внеклассное мероприятие по окружающему миру в 4 классе Автор: Аманжулова И.Ю. Учитель начальной школы МОУ БСОШ 2. Методы прогноза в условиях определенности и риска
Методы прогноза в условиях определенности и риска Визуальная среда Delphi
Визуальная среда Delphi Портативные телевизоры
Портативные телевизоры Bowling Club
Bowling Club Методы и методики исследования влияния видеоигр на деятельность психики
Методы и методики исследования влияния видеоигр на деятельность психики Квазирента
Квазирента Present continuous
Present continuous  Конкурсы с ограниченным участием, двухэтапный. Закрытый конкурс
Конкурсы с ограниченным участием, двухэтапный. Закрытый конкурс  Театральная студия «Солнечный круг»
Театральная студия «Солнечный круг» Родительское собрание«Наши повзрослевшие дети»
Родительское собрание«Наши повзрослевшие дети» Архивная служба – память человека
Архивная служба – память человека Новая услуга НКЦ: «Неттинг по итогам клиринга на ЕТС»
Новая услуга НКЦ: «Неттинг по итогам клиринга на ЕТС» Презентация на тему Макраме
Презентация на тему Макраме Вредные привычки
Вредные привычки Травматизм
Травматизм Директ-маркетинг -эффективный инструмент на IT и Телекоммуникационных рынках.
Директ-маркетинг -эффективный инструмент на IT и Телекоммуникационных рынках. ТЕРМИНОЛОГИЯ ГИГИЕНЫ И ФИЗИОЛОГИИ ТРУДА
ТЕРМИНОЛОГИЯ ГИГИЕНЫ И ФИЗИОЛОГИИ ТРУДА Источники Римского права
Источники Римского права  Откуда взялись названия месяцев?
Откуда взялись названия месяцев? Утренняя гимнастика
Утренняя гимнастика Презентация на тему Скорпионы
Презентация на тему Скорпионы ТАТАРО-МОНГОЛЬСКОЕ НАШЕСТВИЕ НА РУСЬ
ТАТАРО-МОНГОЛЬСКОЕ НАШЕСТВИЕ НА РУСЬ  Whizz Education
Whizz Education