Содержание
- 3. Кислоты Тема урока: «Химические свойства кислот с позиции теории электролитической диссоциации». «От кислых яблок сразу скисну».
- 4. Кислота, когда здорова, Угостить друзей готова Тем, что ей дала природа - Катионом водорода! Н+ Н+
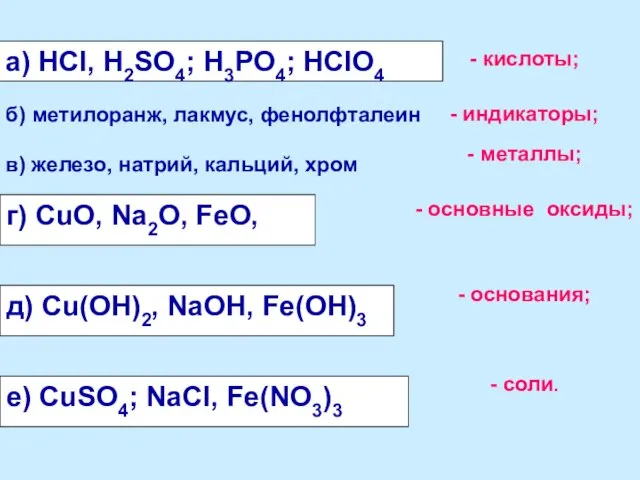
- 5. а) НСl, H2SO4; H3PO4; HClO4 - кислоты; - индикаторы; - металлы; - основные оксиды; - основания;
- 6. Задачи урока Образовательная: изучить химические свойства кислот с позиции теории электролитической диссоциации. 2. Развивающие (формирование и
- 7. Планируемые результаты обучения В результате изучения данного материала учащиеся должны: Знать: а) определение понятий – электролиты,
- 8. Лабораторный опыт №3 Каковы химические свойства кислот? Почему кислоты обладают сходными химическими свойствами?
- 9. Правила техники безопасности Осторожно обращайтесь с химическим оборудованием! Запрещается пробовать вещества на вкус (а); брать вещества
- 10. Цели: проделать реакции, характерные для кислот на примере серной кислоты, соляной кислоты. сделать вывод о химических
- 11. Взаимодействие кислот с индикаторами Красный
- 12. Взаимодействие кислот с металлами
- 13. Взаимодействие кислот с основными оксидами
- 14. Взаимодействие кислот с основаниями
- 15. Взаимодействие кислот с солями
- 16. Содержание I. Определение кислот. II. Химические свойства кислот. Взаимодействие кислот: 1) с индикаторами; 2) с металлами,
- 17. «Воспоминание о лете» Погадаем на ромашке: «Взаимодействует – не взаимодействует?» Задание С какими из веществ взаимодействует
- 18. «Сами трудясь, вы многое сделаете для себя и для близких, а если при труде успеха не
- 19. О кислотных дождях Оксиды азота, серы содержатся в выхлопных газах реактивных двигателей и двигателей внутреннего сгорания,
- 20. Кислотные дожди виноваты в исчезновении рыбы во многих реках и озёрах, так как рыба не выдерживает
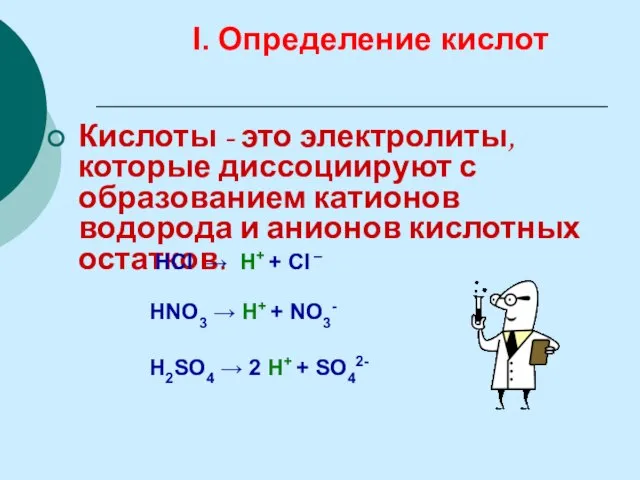
- 21. Кислоты - это электролиты, которые диссоциируют с образованием катионов водорода и анионов кислотных остатков. I. Определение
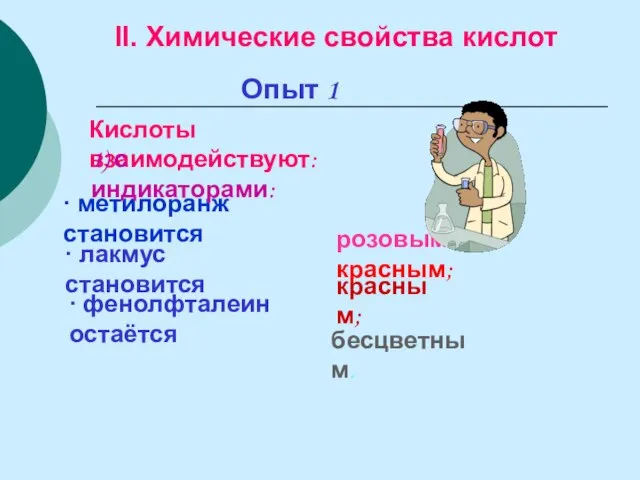
- 22. Опыт 1 Кислоты взаимодействуют: II. Химические свойства кислот ∙ метилоранж становится ∙ фенолфталеин остаётся розовым или
- 23. Опыт 2 2) с металлами, стоящими в ряду напряжений металлов до водорода (исключение составляют азотная и
- 24. 3) с основными оксидами с образованием соли и воды СаО + 2НСl → CaCl2 + H2O
- 25. 4) с основаниями с образованием соли и воды Cu (OH)2 + 2HCl → CuCl2 + H2O
- 26. 5) с солями (реакция возможна, если выпадает осадок или выделяется газ) СаСО3 + 2НСl → CaCl2
- 27. Литература: Мартыненко Б.В. Кислоты – основания. Аликберова Л.Ю.Занимательная химия.-М.:Аст-Пресс, 1999. Савина Л.А. Я познаю мир. Химия.-
- 29. Скачать презентацию























 Новый подход к решению систем уравнений в задачах дискретного логарифмирования
Новый подход к решению систем уравнений в задачах дискретного логарифмирования Топологии компьютерных сетей
Топологии компьютерных сетей Usability интернет-магазина: как сделать сайт удобным и «продающим» Боровский Александр, специалист по онлайн-продвижению. ЛІГАБізн
Usability интернет-магазина: как сделать сайт удобным и «продающим» Боровский Александр, специалист по онлайн-продвижению. ЛІГАБізн Усадьба Поленово
Усадьба Поленово Разнообразие природы
Разнообразие природы Климат России
Климат России Презентация на тему Здоровый образ жизни (5 класс)
Презентация на тему Здоровый образ жизни (5 класс) Презентация на тему В мире камня (2 класс)
Презентация на тему В мире камня (2 класс) Берлинская наступательная операция
Берлинская наступательная операция МТО ПЗ 1
МТО ПЗ 1 Виды проектов
Виды проектов Урок русского языка
Урок русского языка Государство и культура: определения, взаимное влияние, политическая культура
Государство и культура: определения, взаимное влияние, политическая культура НАШИ ВЫПУСКНИКИ(1989/2009)
НАШИ ВЫПУСКНИКИ(1989/2009) Називні речення
Називні речення Презентация на тему Равновесие тел урок физики, 10 класс
Презентация на тему Равновесие тел урок физики, 10 класс  Оренгбурский пуховой платок
Оренгбурский пуховой платок Правоохранительные органы
Правоохранительные органы Масленица 2021 в Светлицах
Масленица 2021 в Светлицах Организационная культура. Понятие, структура, функции
Организационная культура. Понятие, структура, функции День Святителя Николая Чудотворца
День Святителя Николая Чудотворца Рекламное агентство "Здоровье"
Рекламное агентство "Здоровье" Презентация на тему Горы России
Презентация на тему Горы России Presentation (2)
Presentation (2) Подлежащее
Подлежащее Презентация на тему Русский язык - богатство России
Презентация на тему Русский язык - богатство России ОБ ИЗМЕНЕНИЯХ В СОЦИАЛЬНОЙ СФЕРЕ, СВЯЗАННЫХ С РЕАЛИЗАЦИЕЙ ЗАКОНА РОССИЙСКОЙ ФЕДЕРАЦИИ ОТ 08.05.2010 № 83-ФЗ «О ВНЕСЕНИИ ИЗМЕНЕНИЙ В ОТД
ОБ ИЗМЕНЕНИЯХ В СОЦИАЛЬНОЙ СФЕРЕ, СВЯЗАННЫХ С РЕАЛИЗАЦИЕЙ ЗАКОНА РОССИЙСКОЙ ФЕДЕРАЦИИ ОТ 08.05.2010 № 83-ФЗ «О ВНЕСЕНИИ ИЗМЕНЕНИЙ В ОТД Наплавка валиков в вертикальном положении сварочного шва
Наплавка валиков в вертикальном положении сварочного шва