Содержание
- 2. Строение атома. Опыты Резерфорда. Атом состоит из атомного ядра и электронов. Электрон – это частица, заряд
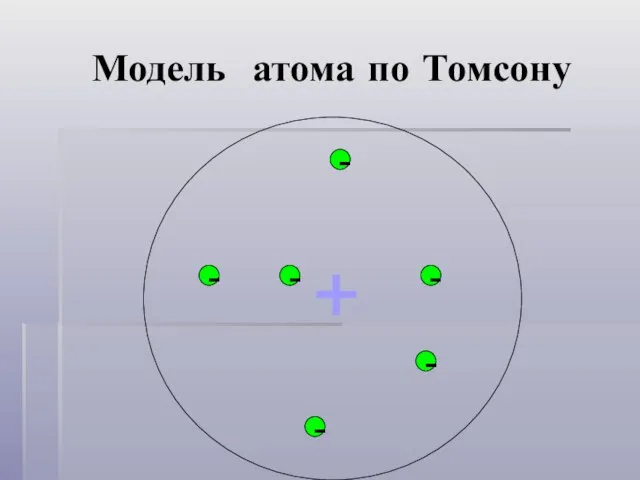
- 3. Модель атома по Томсону - - - - - - +
- 4. Опыты резерфорда Планетарная модель атома Резерфорда. Атомное ядро заряжено положительно. Его диаметр не превышает 10–14–10–15 м,
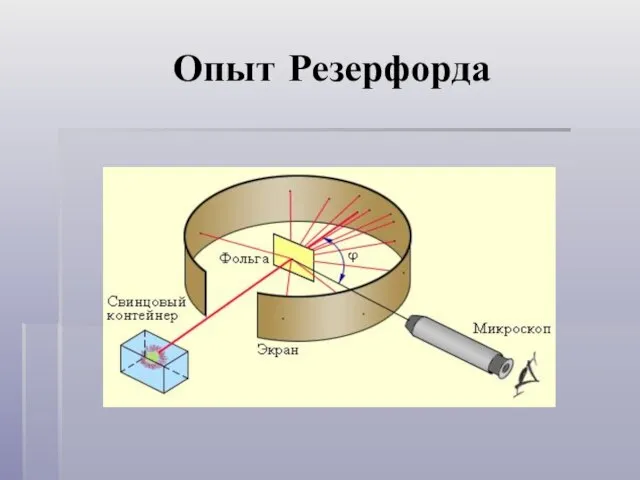
- 5. Опыт Резерфорда
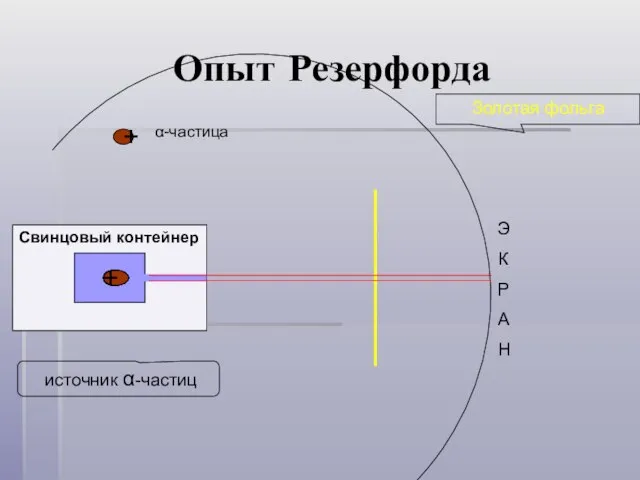
- 6. Опыт Резерфорда + + + + + + + + Свинцовый контейнер + + Золотая фольга
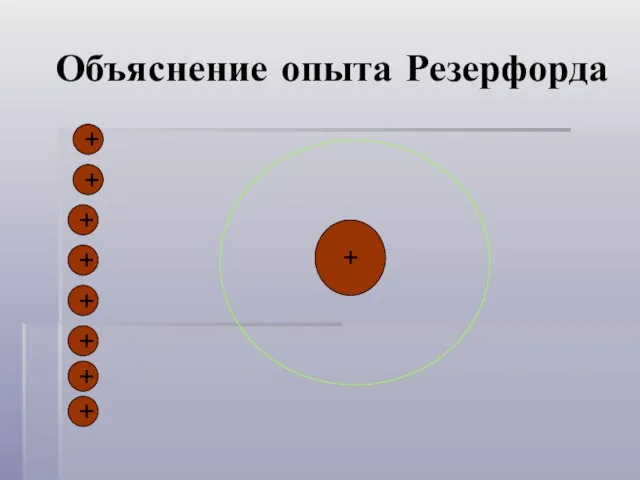
- 7. Объяснение опыта Резерфорда + + + + + + + + +
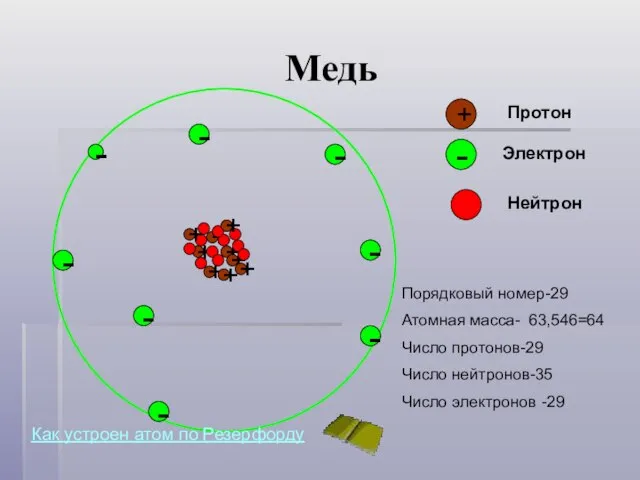
- 8. Медь - + Протон - Электрон - Нейтрон - - - - - - Порядковый номер-29
- 9. Строение атомов Планетарная модель атомов Резерфорд создал планетарную модель атома: электроны обращаются вокруг ядра, подобно тому
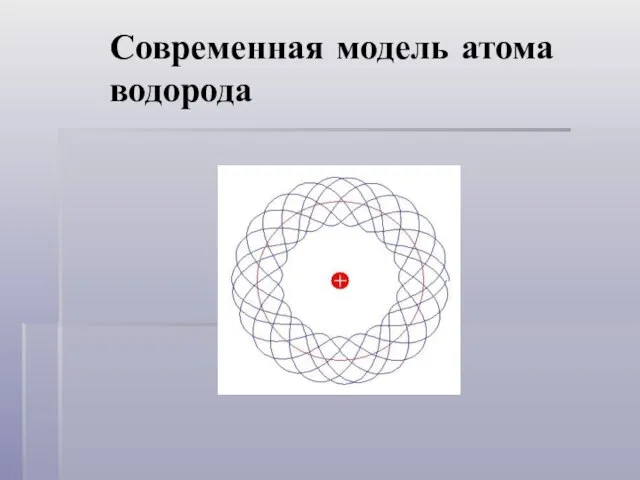
- 10. Современная модель атома водорода
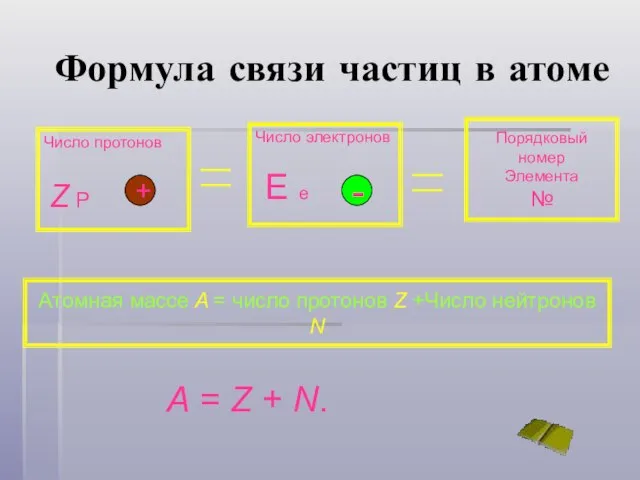
- 11. Формула связи частиц в атоме Число протонов Z P Число электронов E e Порядковый номер Элемента
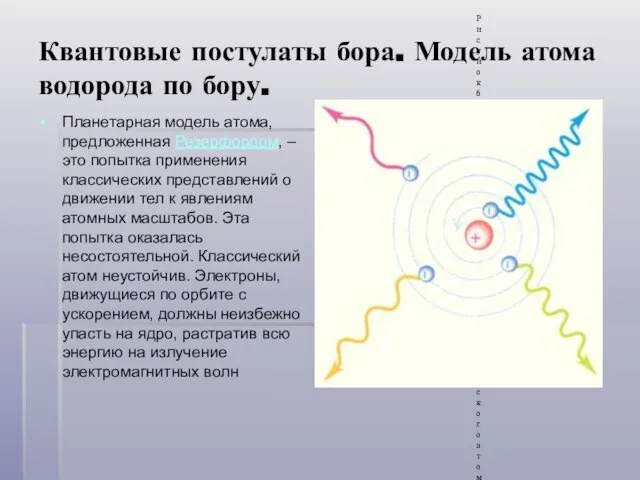
- 12. Квантовые постулаты бора. Модель атома водорода по бору. Планетарная модель атома, предложенная Резерфордом, – это попытка
- 13. Постулаты Бора Следующий шаг в развитии представлений об устройстве атома сделал в 1913 году выдающийся датский
- 14. Модель постулаты Бора.
- 16. Скачать презентацию





 Циклоны и антициклоны
Циклоны и антициклоны New Patrol
New Patrol Презентация на тему моллюски 7 класс
Презентация на тему моллюски 7 класс The Most Absurd Inventions of All Time
The Most Absurd Inventions of All Time Внутренний аудит системы менеджмента безопасности пищевой продукции
Внутренний аудит системы менеджмента безопасности пищевой продукции Договор перевозки груза железнодорожным транспортом
Договор перевозки груза железнодорожным транспортом нам 10 лет
нам 10 лет ГУО «Институт теологии имени святых Мефодия и Кирилла» Белорусского государственного университетаПарепко Елена Васильевна
ГУО «Институт теологии имени святых Мефодия и Кирилла» Белорусского государственного университетаПарепко Елена Васильевна Неравенство в благосостоянии
Неравенство в благосостоянии Смена слайдов
Смена слайдов «Режим дня третьеклассника»
«Режим дня третьеклассника» Степень социальной открытости теологии
Степень социальной открытости теологии Флинстоны
Флинстоны Профорг
Профорг Капиллярные системы для повышения эффективности эксплуатации глубинно-насосного оборудования
Капиллярные системы для повышения эффективности эксплуатации глубинно-насосного оборудования ACUTE CHOLECYSTITIS
ACUTE CHOLECYSTITIS  Налоговая задолженность
Налоговая задолженность Презентация на тему График с точкой разрыва
Презентация на тему График с точкой разрыва Квантовые компьютеры
Квантовые компьютеры مساق قرآن كريم
مساق قرآن كريم Регистрация для участия в отборе для приема на обучение иностранных граждан в РФ
Регистрация для участия в отборе для приема на обучение иностранных граждан в РФ Машинные швы
Машинные швы Андрей Платонович Платонов
Андрей Платонович Платонов Международно-правовые аспекты защиты права
Международно-правовые аспекты защиты права Энциклопедия Znanium
Энциклопедия Znanium ЧТО ОБАЗНАЧАЮТ ТАТУИРОВКИ
ЧТО ОБАЗНАЧАЮТ ТАТУИРОВКИ Алгебра Логики
Алгебра Логики  худ
худ