Слайд 2Электролиты
Проводниками электрического тока являются не только металлы и полупроводники. Электрический ток

проводят растворы многих веществ в воде. Как показывает опыт, чистая вода не проводит электрический ток, то есть в ней нет свободных носителей электрических зарядов. Не проводят электрический ток и кристаллы поваренной соли, хлорида натрия.
Однако раствор хлорида натрия является хорошим проводником электрического тока.
Растворы солей, кислот и оснований, способные проводить электрический ток, называются электролитами.
Слайд 3Электролиз
Прохождение электрического тока через электролит обязательно сопровождается выделением вещества в твёрдом

или газообразном состоянии на поверхности электродов. Выделение вещества на электродах показывает, что в электролитах электрические заряды переносят заряженные атомы вещества – ионы. Этот процесс называется электролизом.
Слайд 4Закон электролиза
Майкл Фарадей на основе экспериментов с различными электролитами установил, что

при электролизе масса m выделившегося на электроде вещества пропорциональна прошедшему через электролит заряду ∆q или силе тока I и времени ∆t прохождения тока:
m=k∆q= kI∆t.
Это уравнение называется законом электролиза. Коэффициент k, зависящий от выделившегося вещества, называется электрохимическим эквивалентом вещества.
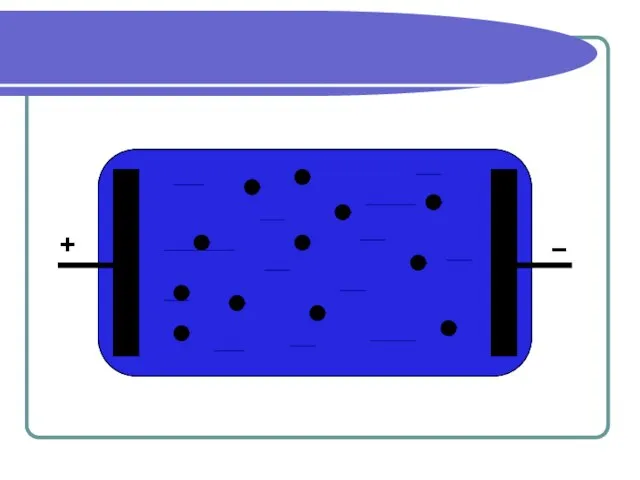
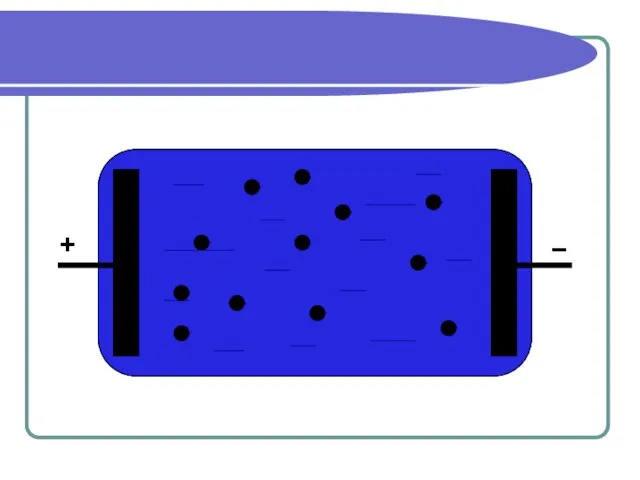
Слайд 5Проводимость электролитов
Проводимость жидких электролитов объясняется тем, что при растворении в воде

нейтральные молекулы солей, кислот и оснований распадаются на отрицательные и положительные ионы.
В электрическом поле ионы приходят в движение и создают электрический ток.
Слайд 8Агрегатное состояние электролитов
Существуют не только жидкие, но и твёрдые электролиты. Примером

твёрдого электролита может служить стекло. В составе стекла имеются положительные и отрицательные ионы. В твёрдом состоянии стекло не проводит электрический ток, так как ионы не могут двигаться в твёрдом теле.
При нагревании стекла ионы получают возможность перемещаться под действием электрического поля и стекло становится проводником.





 Мир геометрических фигур
Мир геометрических фигур Презентация на тему Организация и содержание физминутки на уроке
Презентация на тему Организация и содержание физминутки на уроке Мы за Новый мир! Движение за Новый Коммунизм
Мы за Новый мир! Движение за Новый Коммунизм Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие
Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие Неиспользуемые здания в коммунальной собственности Мостовского района, планируемые к продаже в 2012 году
Неиспользуемые здания в коммунальной собственности Мостовского района, планируемые к продаже в 2012 году СПП нерасчлененной структуры
СПП нерасчлененной структуры Курсовая работа
Курсовая работа Транспортное средство. Характеристика непрофильного актива
Транспортное средство. Характеристика непрофильного актива «Определение характерных черт портрета успешного предпринимателя »Проект Подготовили: Любченко Алёна и Няргинен ВикторияРуков
«Определение характерных черт портрета успешного предпринимателя »Проект Подготовили: Любченко Алёна и Няргинен ВикторияРуков И.И. Шишкин
И.И. Шишкин Круг обучения. Готовим профессионалов.
Круг обучения. Готовим профессионалов. Конституция Тыва
Конституция Тыва «Дело-КС» Автоматизация делопроизводства
«Дело-КС» Автоматизация делопроизводства Охрана материнства и детства в свете приоритетных правительственных программ Директор Департамента медико-социальных проблем с
Охрана материнства и детства в свете приоритетных правительственных программ Директор Департамента медико-социальных проблем с Тема проекта:«Здоровьесберегающие компоненты математического образования младшего школьника в свете стандарта второго поколен
Тема проекта:«Здоровьесберегающие компоненты математического образования младшего школьника в свете стандарта второго поколен Тургенев и Виардо
Тургенев и Виардо Менеджер по компенсациям и льготам. Профпереподготовка
Менеджер по компенсациям и льготам. Профпереподготовка 7 период развития соц.работы
7 период развития соц.работы Рынок труда: состав, состояние и перспективы развития.
Рынок труда: состав, состояние и перспективы развития. Игровые технологии в младшем школьном возрасте
Игровые технологии в младшем школьном возрасте Открытки с 9 мая
Открытки с 9 мая О введении комплексного курса
О введении комплексного курса Презентация на тему Народы России
Презентация на тему Народы России  Изменчивость. Мутации
Изменчивость. Мутации Презентация на тему Мастерство педагога
Презентация на тему Мастерство педагога Сирень 1945 года
Сирень 1945 года Методы составления и анализа семантического ядра
Методы составления и анализа семантического ядра Презентация на тему Одиночество
Презентация на тему Одиночество