Содержание
- 2. Электролиты - вещества, растворы и расплавы которых проводят электрический ток (NaCl, NaOH, HCl).
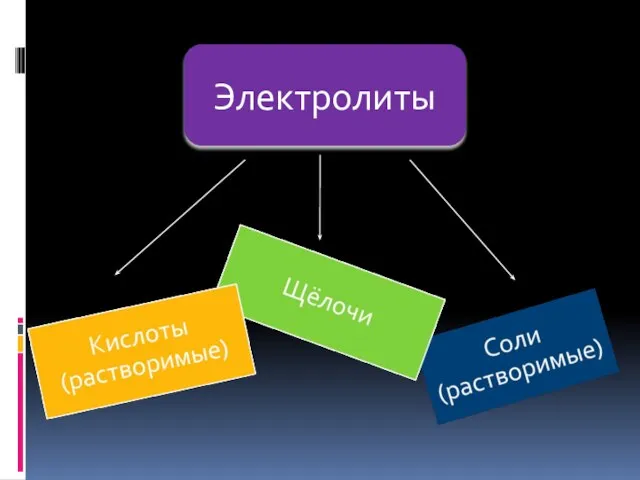
- 3. Электролиты
- 4. Кислоты- это электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка. HCI = H+ +
- 5. Многоосновные кислоты диссоциируют ступенчато: 1 стадия: H3PO4 H+ + H2PO4- 2 стадия: H2PO4- H+ + HPO42-
- 6. Основания- это электролиты, которые диссоциируют на катионы металлов и анионы гидроксогрупп. NaOH = Na+ + OH-
- 7. Соли - это электролиты, которые диссоциируют на катионы металла и анионы кислотного остатка. Na Cl =
- 8. Вывод: Общие свойства кислот объясняются наличием в них ионов H+ , а общие свойства щелочей –
- 10. Скачать презентацию






 Развитие инновационного (технологического) предпринимательства – что ЕСТЬ и что ПРЕДСТОИТ сделать
Развитие инновационного (технологического) предпринимательства – что ЕСТЬ и что ПРЕДСТОИТ сделать Презентация на тему ТЭК России (9 класс)
Презентация на тему ТЭК России (9 класс)  За что можно получить штрафы
За что можно получить штрафы Технологии власти. Власть технологий
Технологии власти. Власть технологий Презентация на тему Осуществление образовательной деятельности в игре
Презентация на тему Осуществление образовательной деятельности в игре  Личность в истории: жизнь и деятельность Александра Федоровича Керенского
Личность в истории: жизнь и деятельность Александра Федоровича Керенского Даосизм.
Даосизм. Регионализация в международных отношениях
Регионализация в международных отношениях Презентация на тему Технология трудовой деятельности
Презентация на тему Технология трудовой деятельности Приглашаем на работу
Приглашаем на работу Причины многообразия религий. Введение
Причины многообразия религий. Введение Автошкола для старшеклассников
Автошкола для старшеклассников лера
лера Компьютер и здоровье
Компьютер и здоровье Скульптор. Лепит разные фигуры, и ваяет он скульптуры
Скульптор. Лепит разные фигуры, и ваяет он скульптуры С праздником САТ и АТП
С праздником САТ и АТП Основные функции распределённых сетей (WAN) и маршрутизаторов
Основные функции распределённых сетей (WAN) и маршрутизаторов О ходе подготовки к проведению государственной (итоговой) аттестации обучающихся, освоивших образовательные программы основного
О ходе подготовки к проведению государственной (итоговой) аттестации обучающихся, освоивших образовательные программы основного  Организационная структура предприятия - соединение управленческих звеньев и подчиненных им подразделений
Организационная структура предприятия - соединение управленческих звеньев и подчиненных им подразделений Бренд от бренда не далеко падает
Бренд от бренда не далеко падает Исследовательская деятельность учащихся
Исследовательская деятельность учащихся Супружество без брака?
Супружество без брака? Конкуренция в живой природе
Конкуренция в живой природе История возникновения различных чисел
История возникновения различных чисел Приказы – упорядочивание и стандартизация процессов в СЭД
Приказы – упорядочивание и стандартизация процессов в СЭД ПЕРВОЕ ВСЕУКРАИНСКОЕ БЮРО КРЕДИТНЫХ ИСТОРИЙ – необходимый элемент кредитного рынка г.Киев 29 сентября 2006г.
ПЕРВОЕ ВСЕУКРАИНСКОЕ БЮРО КРЕДИТНЫХ ИСТОРИЙ – необходимый элемент кредитного рынка г.Киев 29 сентября 2006г. Кактус из фетра
Кактус из фетра Системы счисления 10 класс
Системы счисления 10 класс