Содержание
- 2. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ, ПРОТЕКАЮЩИЕ НА ЭЛЕКТРОДАХ ПРИ ПРОПУСКАНИИ ПОСТОЯННОГО ЭЛЕКТРИЧЕСКОГО ТОКА ЧЕРЕЗ РАСТВОРЫ ИЛИ РАСПЛАВЫ ЭЛЕКТРОЛИТОВ, НАЗЫВАЮТ
- 3. Катодные процессы в водных растворах электролитов :катионы или молекулы воды принимают электронов и восстанавливаются. Li,K,Ca, |
- 4. Cu2+ + 2e– = Cu0, E0=0,337 В 2H2O + 2e– = H2 + 2OH–, E0=–0,83 В
- 5. 2. Катионы металлов с малой величиной стандартного электродного потенциала (катионы металлов начала ряда напряжений Li+, Na+,
- 6. 3. Катионы металлов со стандартным электродным потенциалом меньшим, чем у ВОДОРОДА, но большим, чем у алюминия
- 7. 4. На катоде легче всего разряжаются катионы того металла, которому отвечает наиболее положительный потенциал. Так, например,
- 8. На аноде происходит окисление анионов или молекул воды ( частицы отдают электронов - окисляются) Анионы по
- 9. НА АНОДЕ ОКИСЛЯЮТСЯ АНИОНЫ БЕСКИСЛОРОДНЫХ КИСЛОТ, OH– ИЛИ МОЛЕКУЛЫ ВОДЫ 2Cl– – 2e– = Cl2 2H2O
- 10. При электролизе водного раствора соли из активного металла и кислородосодержащей кислоты на катоде выделяется Н2, а
- 11. При электролизе раствора соли из активного металла и бескислородной кислоты на катоде образуется - Н2, на
- 12. При электролизе водного раствора соли из малоактивного металла и кислородосодержащей кислоты на катоде выделяется металл, а
- 13. При электролизе катиона аммония NH4+ восстанавливается вода. При электролизе солей органических кислот на катоде восстанавливается вода,
- 14. Электролиз раствора щелочи – это электролиз воды. Электролиз раствора кислородосодержащей кислоты – это тоже электролиз воды.
- 15. ЭЛЕКТРОЛИЗ РАСТВОРА NACL
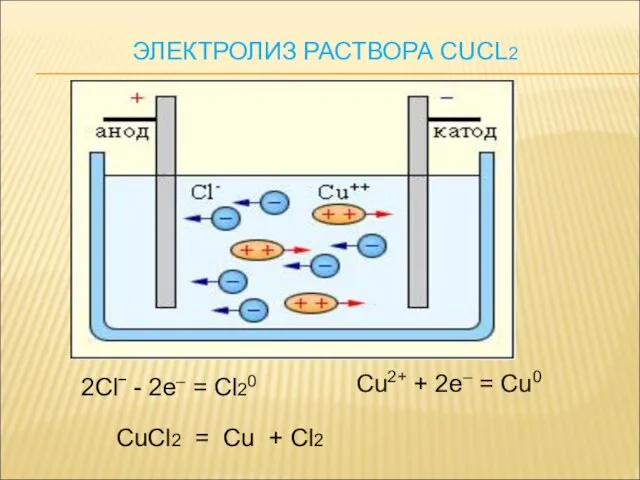
- 16. 2Clˉ - 2e– = Cl20 Cu2+ + 2e– = Cu0 CuCl2 = Cu + Cl2 ЭЛЕКТРОЛИЗ
- 18. Скачать презентацию














 Красное-черное. Творческая работа
Красное-черное. Творческая работа Презентация на тему Олимпийский огонь
Презентация на тему Олимпийский огонь Предиктивная аналитика рисков в системе закупок
Предиктивная аналитика рисков в системе закупок А если одного предложения мало?
А если одного предложения мало? 20171102_nauki_o_prirode
20171102_nauki_o_prirode Учреждение образования «Белорусский государственный университет физической культуры»
Учреждение образования «Белорусский государственный университет физической культуры» Derecho inmobiliario Power Point (Protección posesión y propiedad)
Derecho inmobiliario Power Point (Protección posesión y propiedad) Родительское собрание
Родительское собрание Презентация на тему Неклеточные формы жизни вирусы (10 класс)
Презентация на тему Неклеточные формы жизни вирусы (10 класс) ПРОГРАММА «ТРУДОВАЯ СЛАВА РОССИИ» Инициатор: Автономная некоммерческая организация содействия повышению престижа труда и социа
ПРОГРАММА «ТРУДОВАЯ СЛАВА РОССИИ» Инициатор: Автономная некоммерческая организация содействия повышению престижа труда и социа Урок 13.БАЙКИ ЕЗОПА
Урок 13.БАЙКИ ЕЗОПА Айрис фолдинг (радужное складывание)
Айрис фолдинг (радужное складывание) ПОЛЬ ГОГЕН
ПОЛЬ ГОГЕН Противодействие коррупции в США
Противодействие коррупции в США Буква Я
Буква Я Автомобильный транспорт
Автомобильный транспорт  Золотопромышленность в Енисейской губернии
Золотопромышленность в Енисейской губернии Ученик года - 2016
Ученик года - 2016 Фотография. Что можно назвать фотографией?
Фотография. Что можно назвать фотографией? Vocabulary presentation
Vocabulary presentation Молоко и его свойства
Молоко и его свойства Социокультурные детерминанты развития и торможения исследовательского поведения
Социокультурные детерминанты развития и торможения исследовательского поведения Когнитивная психология
Когнитивная психология Понятие административного права
Понятие административного права Половое и бесполое размножение. Обобщение
Половое и бесполое размножение. Обобщение Pervy_urok_Moya_istoria
Pervy_urok_Moya_istoria Применение SCAD Office для расчета сооружений сложной геометрической формы на сейсмические воздействия(нормы и опыт расчетов)
Применение SCAD Office для расчета сооружений сложной геометрической формы на сейсмические воздействия(нормы и опыт расчетов) Проведение индустриализации в СССР: методы, результаты, цена. Коллективизация в СССР: причины, методы проведения, итоги
Проведение индустриализации в СССР: методы, результаты, цена. Коллективизация в СССР: причины, методы проведения, итоги