Содержание
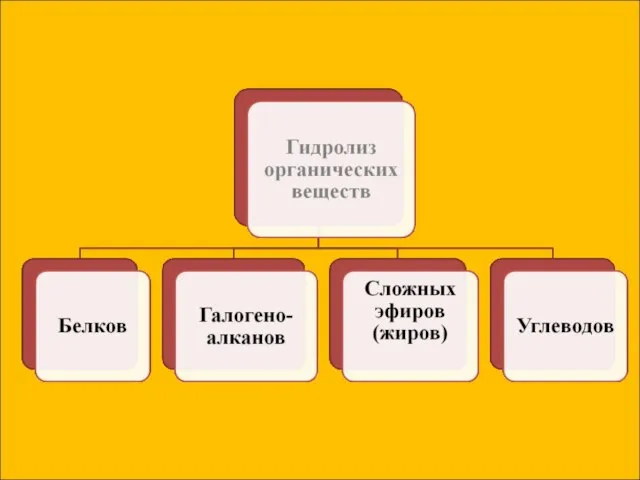
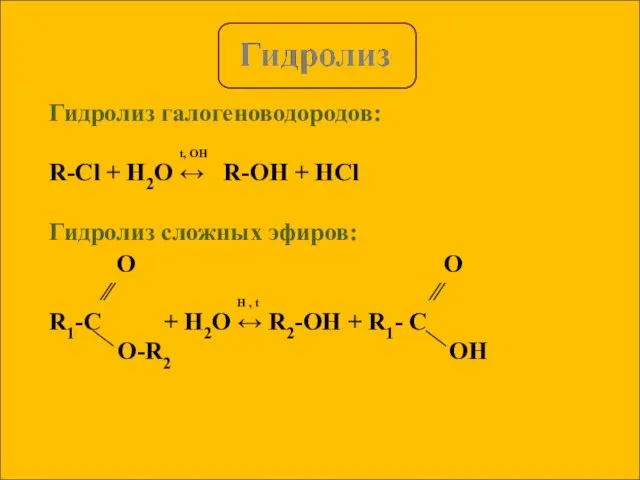
- 4. Гидролиз галогеноводородов: t, OH R-Cl + H2O ↔ R-OH + HCl Гидролиз сложных эфиров: ∕∕ H
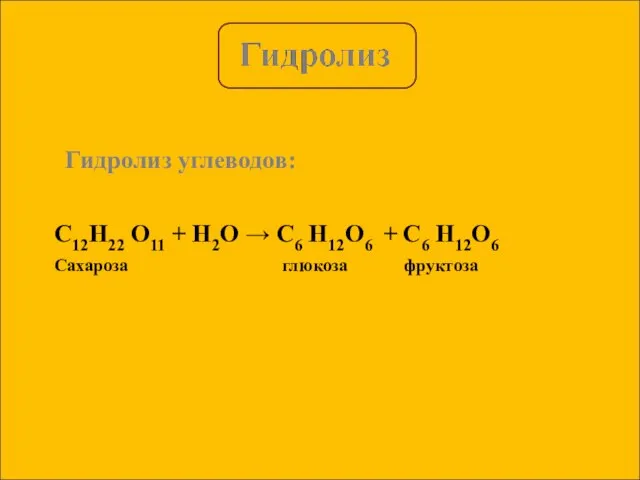
- 5. Гидролиз углеводов: C12H22 O11 + H2O → C6 H12O6 + C6 H12O6 Сахароза глюкоза фруктоза
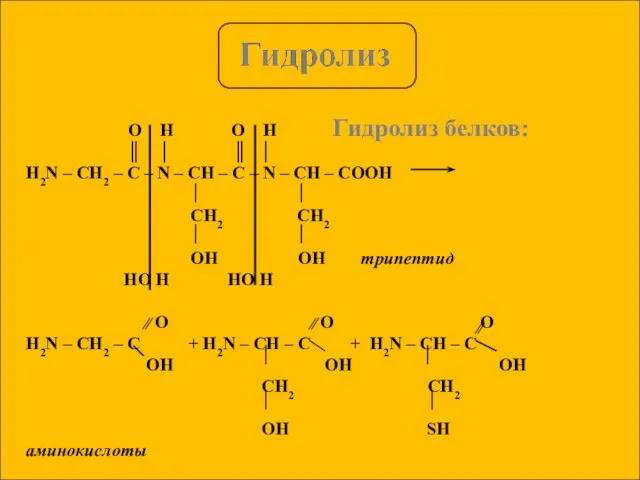
- 6. Гидролиз белков: O H O H ║ │ ║ │ H2N – CH2 – C –
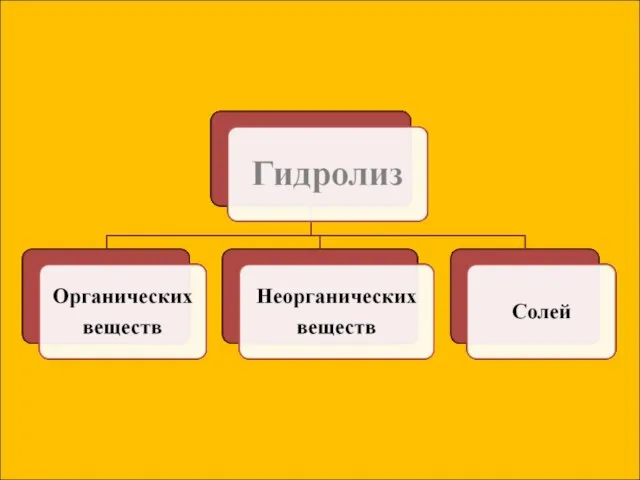
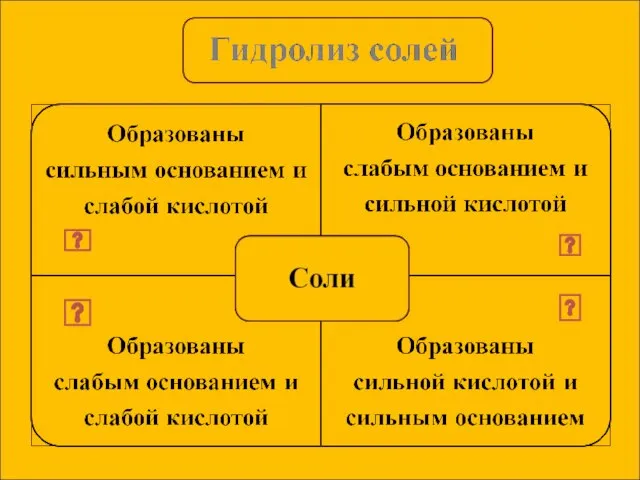
- 7. Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате
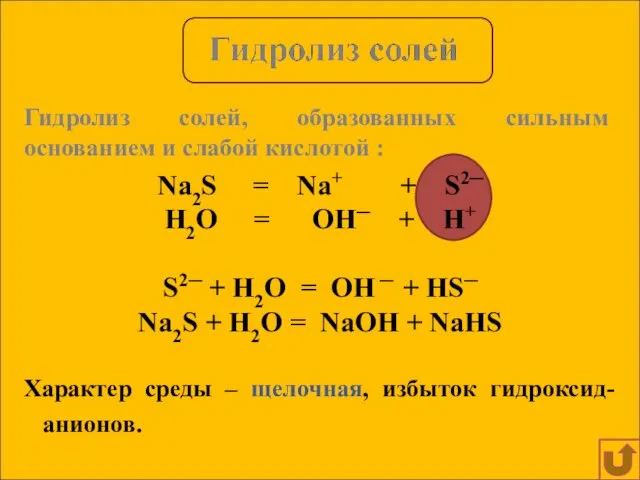
- 9. Na2S = Na+ + S2─ H2O = OH─ + H+ S2─ + H2O = OH ─
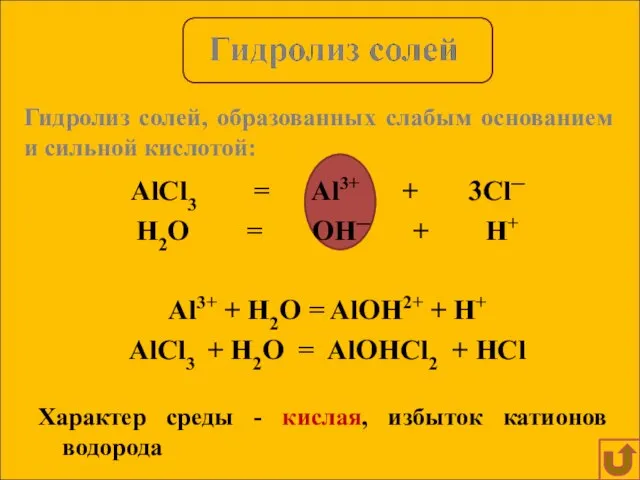
- 10. AlCl3 = Al3+ + 3Cl─ H2O = OH─ + H+ Al3+ + H2O = AlOH2+ +
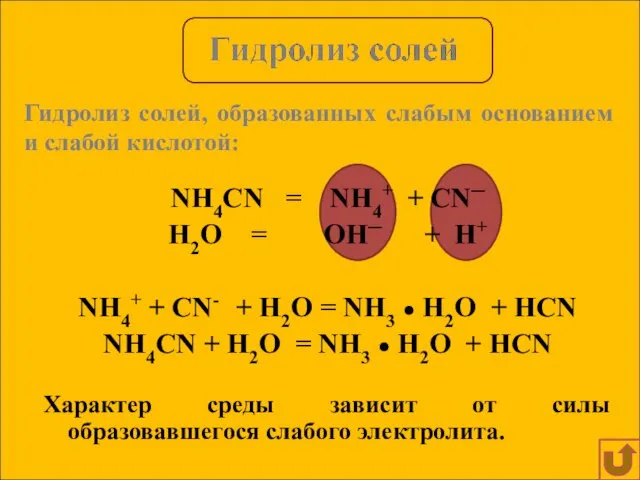
- 11. NH4CN = NH4+ + CN─ H2O = OH─ + H+ NH4+ + CN- + H2O =
- 12. Необратимый гидролиз солей, образованных слабым основанием и слабой кислотой: Например, соли, которые нельзя получить реакцией обмена
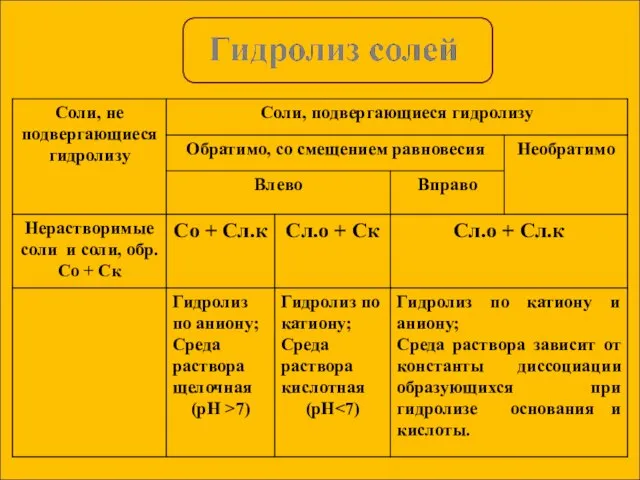
- 13. KCl = K+ + Cl- Слабых ионов нет, гидролиз не идет, среда нейтральная. Гидролиз солей, образованных
- 15. Условия смещения реакций обратимого гидролиза (согласно принципу Ле Шателье). Усилить гидролиз соли можно следующими способами: Добавить
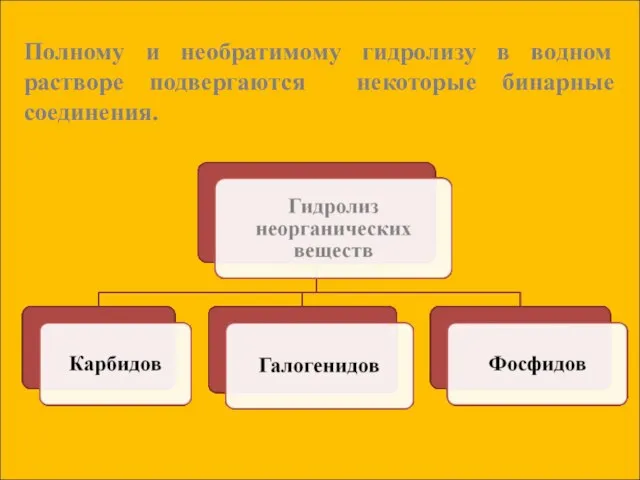
- 16. Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения.
- 17. Гидролиз карбидов: CaC2 + 2H2O = Ca(OH)2 + C2 H2↑ Карбид ацетилен кальция Al4C3 + 12H2O
- 18. Гидролиз галогенидов: SiCl4 + 3H2O = H2SiO4↓ + 4HСl хлорид кремниевая кремния (+4) кислота Гидролиз фосфидов:
- 19. Роль гидролиза: В природе: преобразование земной коры; обеспечение слабощелочной среды морской воды. В народном хозяйстве: порча
- 20. Гидратация Присоединение молекул воды к молекулам без разложения на новые вещества
- 21. Гидратация алканов H2SO4 CH2=CH–CH3+HOH → CH3–CH–CH3 OH – H2SO4 Где больше водородов туда водород при разрыве
- 22. Дегидратация спиртов H2SO4 CH3–CH–CH2–CH3 → CH3–CH=CH–CH3 H2SO4 OH – -H2O У какого близ стоящего углерода меньше
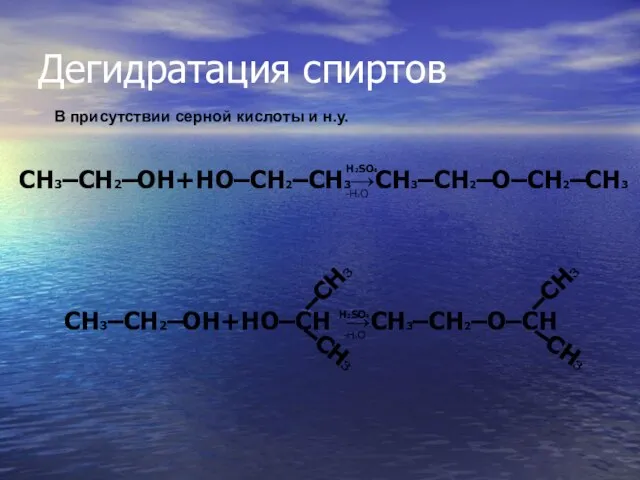
- 23. Дегидратация спиртов H2SO4 -H2O В присутствии серной кислоты и н.у. CH3–CH2–OH+HO–CH →CH3–CH2–O–CH –CH3 –CH3 –CH3 –CH3
- 24. Гидратация алкинов = O – H CH≡CH–CH3+HOH→CH2=CH–CH3 →CH2–C–CH3 = O HO – В OH гр кислород
- 25. Гидратация оксидов металов Ca=O+H2O↔Ca(OH)2 Ca=OMg=O+H2O↔Ca(OH)2MgO Ca=O Mg=O+2H2O↔Ca(OH)2 Mg(OH)2
- 26. Гидратация солей При гидратации бесцветного сульфата меди(II) последовательно образуются различные окрашенные кристаллогидраты, из которых выделены в
- 27. Кристализация солей При кристаллизации многих солей из их водных растворов молекулы воды входят в состав кристаллической
- 29. Скачать презентацию














 Красное-черное. Творческая работа
Красное-черное. Творческая работа Презентация на тему Олимпийский огонь
Презентация на тему Олимпийский огонь Предиктивная аналитика рисков в системе закупок
Предиктивная аналитика рисков в системе закупок А если одного предложения мало?
А если одного предложения мало? 20171102_nauki_o_prirode
20171102_nauki_o_prirode Учреждение образования «Белорусский государственный университет физической культуры»
Учреждение образования «Белорусский государственный университет физической культуры» Derecho inmobiliario Power Point (Protección posesión y propiedad)
Derecho inmobiliario Power Point (Protección posesión y propiedad) Родительское собрание
Родительское собрание Презентация на тему Неклеточные формы жизни вирусы (10 класс)
Презентация на тему Неклеточные формы жизни вирусы (10 класс) ПРОГРАММА «ТРУДОВАЯ СЛАВА РОССИИ» Инициатор: Автономная некоммерческая организация содействия повышению престижа труда и социа
ПРОГРАММА «ТРУДОВАЯ СЛАВА РОССИИ» Инициатор: Автономная некоммерческая организация содействия повышению престижа труда и социа Урок 13.БАЙКИ ЕЗОПА
Урок 13.БАЙКИ ЕЗОПА Айрис фолдинг (радужное складывание)
Айрис фолдинг (радужное складывание) ПОЛЬ ГОГЕН
ПОЛЬ ГОГЕН Противодействие коррупции в США
Противодействие коррупции в США Буква Я
Буква Я Автомобильный транспорт
Автомобильный транспорт  Золотопромышленность в Енисейской губернии
Золотопромышленность в Енисейской губернии Ученик года - 2016
Ученик года - 2016 Фотография. Что можно назвать фотографией?
Фотография. Что можно назвать фотографией? Vocabulary presentation
Vocabulary presentation Молоко и его свойства
Молоко и его свойства Социокультурные детерминанты развития и торможения исследовательского поведения
Социокультурные детерминанты развития и торможения исследовательского поведения Когнитивная психология
Когнитивная психология Понятие административного права
Понятие административного права Половое и бесполое размножение. Обобщение
Половое и бесполое размножение. Обобщение Pervy_urok_Moya_istoria
Pervy_urok_Moya_istoria Применение SCAD Office для расчета сооружений сложной геометрической формы на сейсмические воздействия(нормы и опыт расчетов)
Применение SCAD Office для расчета сооружений сложной геометрической формы на сейсмические воздействия(нормы и опыт расчетов) Проведение индустриализации в СССР: методы, результаты, цена. Коллективизация в СССР: причины, методы проведения, итоги
Проведение индустриализации в СССР: методы, результаты, цена. Коллективизация в СССР: причины, методы проведения, итоги