Содержание
- 2. Варианты столкновений молекул Благоприятная (а) и неблагоприятные (б, в) ориентации молекул при столкновении А А В
- 3. Этапы химической реакции
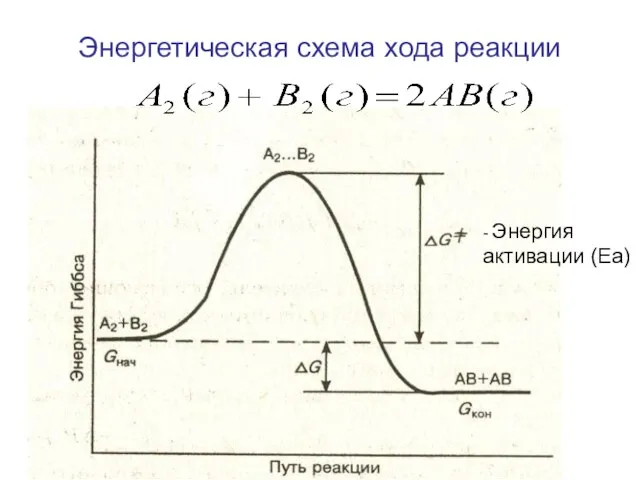
- 4. Энергетическая схема хода реакции - Энергия активации (Еа)
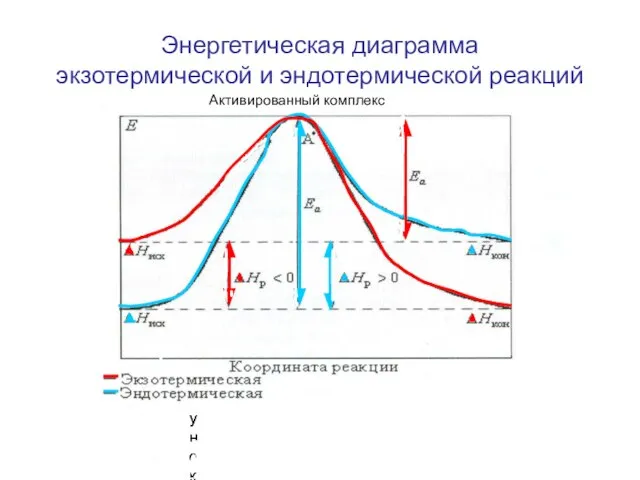
- 5. Энергетическая диаграмма экзотермической и эндотермической реакций Активированный комплекс
- 6. Зависимость скорости реакции от природы вещества CH2(ONO2)- CH2(ONO2) = 2CO2 + 2H2O + N2 Динитроэтиленгликоль Еа
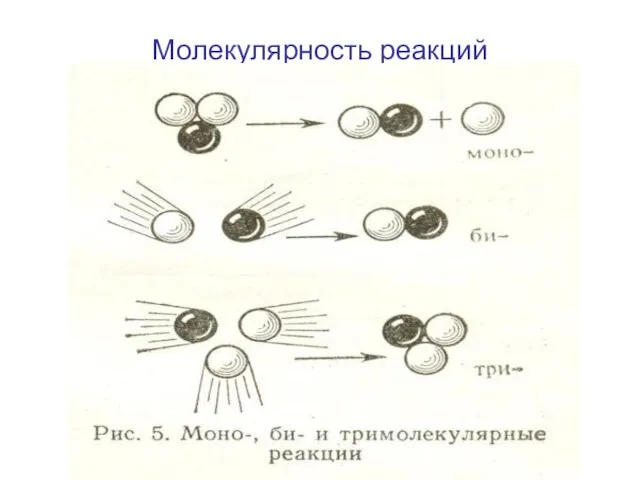
- 7. Молекулярность реакций
- 8. Кинетические уравнения реакций различных типов
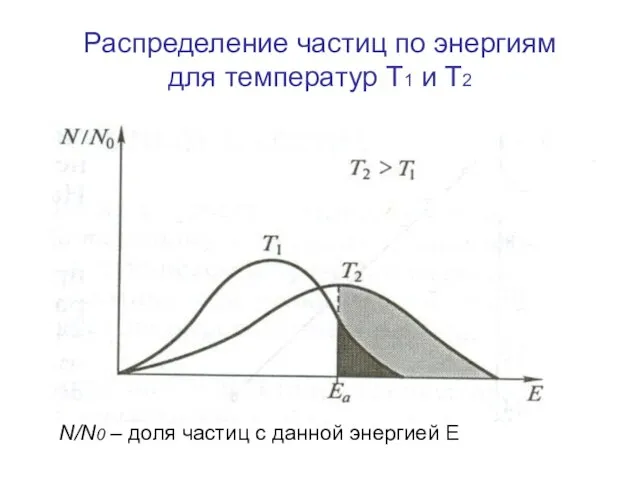
- 9. Распределение частиц по энергиям для температур Т1 и Т2 N/N0 – доля частиц с данной энергией
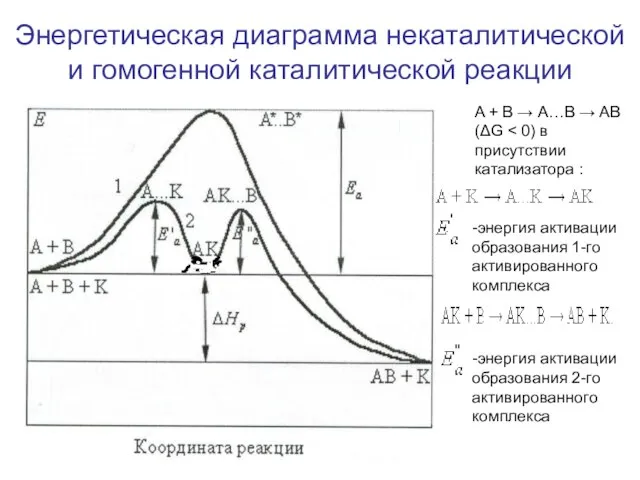
- 10. Энергетическая диаграмма некаталитической и гомогенной каталитической реакции A + B → А…B → AB (ΔG -энергия
- 11. Изменение Еа некоторых реакций в присутствии катализаторов, кДж/моль
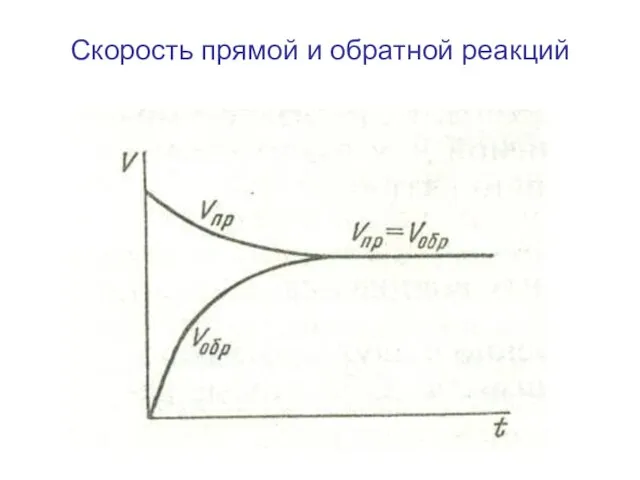
- 12. Скорость прямой и обратной реакций
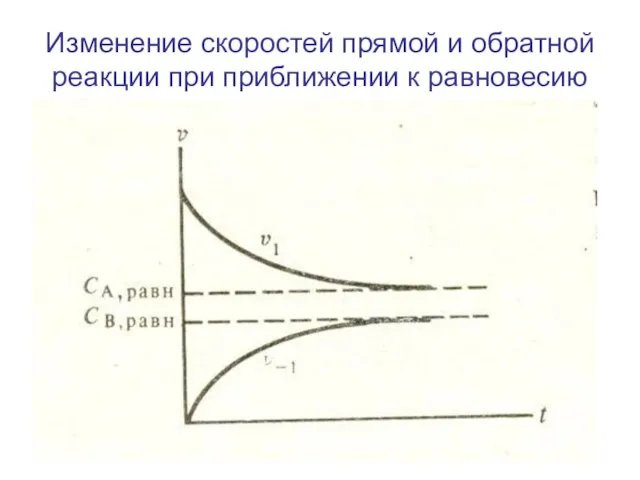
- 13. Изменение скоростей прямой и обратной реакции при приближении к равновесию
- 14. Энергетические эффекты фазовых и полиморфных превращений
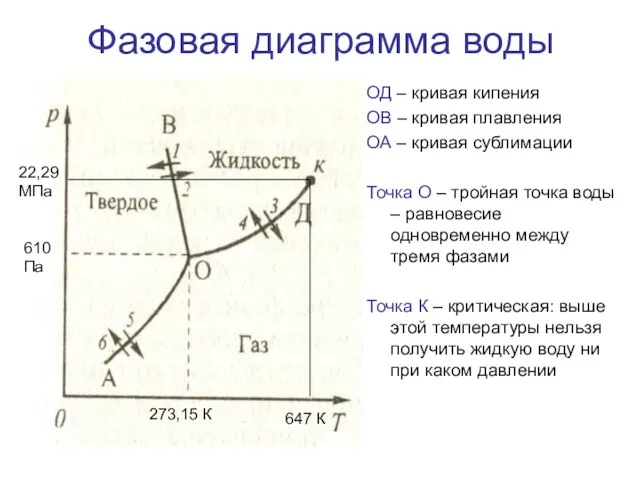
- 15. Фазовая диаграмма воды ОД – кривая кипения ОВ – кривая плавления ОА – кривая сублимации Точка
- 17. Скачать презентацию






 СЕВЕРО-ВОСТОК ПРОГУЛКА ПО УСАДЬБАМ
СЕВЕРО-ВОСТОК ПРОГУЛКА ПО УСАДЬБАМ Папка мои достижения
Папка мои достижения Динамическая антропометрия
Динамическая антропометрия Особенности физкультурно - оздоровительной работы в ДОУ
Особенности физкультурно - оздоровительной работы в ДОУ PPF ЗВЕЗДОЧКА
PPF ЗВЕЗДОЧКА 20140324_samyy_umnyy_7_klass
20140324_samyy_umnyy_7_klass Искусство делать комплименты
Искусство делать комплименты Отчет о работе проекта Кемерово ТЦ
Отчет о работе проекта Кемерово ТЦ Какие бывают животные ?
Какие бывают животные ? Функции планирования в управлении
Функции планирования в управлении Русский национальный характер в сказе Н.С. Лескова
Русский национальный характер в сказе Н.С. Лескова Что такое светская этика?
Что такое светская этика? Её величество осанка и портфель
Её величество осанка и портфель Не зря наш детский садик «Чудесинкой» зовут: Здесь утра прохлада и дома уют, Здесь радуга красок и творчества море, Таланты, как пти
Не зря наш детский садик «Чудесинкой» зовут: Здесь утра прохлада и дома уют, Здесь радуга красок и творчества море, Таланты, как пти Следы греха
Следы греха Конференц-Петербург умножает деловые коммуникации со всей Россией
Конференц-Петербург умножает деловые коммуникации со всей Россией Мой Английский язык
Мой Английский язык Наночастицы металлов.Часть 2.
Наночастицы металлов.Часть 2. Живопись Барокко
Живопись Барокко Политическое развитие страны 7 кл
Политическое развитие страны 7 кл Мы дети твои, Россия
Мы дети твои, Россия Методика обучения технике прыжков в высоту и длину
Методика обучения технике прыжков в высоту и длину Сущность и содержание оценки персонала. Тема 1
Сущность и содержание оценки персонала. Тема 1 Михаил Васильевич Ломоносов
Михаил Васильевич Ломоносов Товарные потери
Товарные потери Принцип работы Jenoptik Opticline
Принцип работы Jenoptik Opticline Духовный подвиг Архиепископа Самарского Александра (Трапицына)
Духовный подвиг Архиепископа Самарского Александра (Трапицына) 20170214_uchim_geografiyu_igraya
20170214_uchim_geografiyu_igraya