Содержание
- 2. Тест – экспресс 1) Электронная конфигурация атома углерода? 2) Разновидности простого вещества, образованные одним и тем
- 3. ОТВЕТЫ 1) Аллотропные видоизменения 2) 1s22s22p 3) Четыре 4) Метан СН4, силан SiH4 5) ЭО2 6)
- 4. Фокус-покус для народа: Стоит лишь подуть сквозь воду, Как она легко-легко Превратиться в молоко! СО2 +
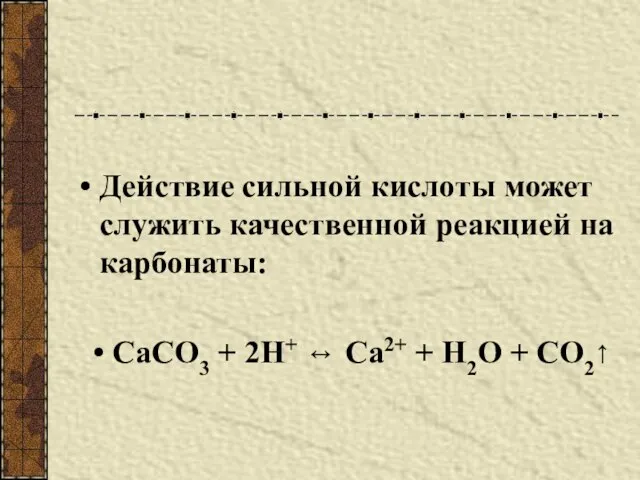
- 5. Действие сильной кислоты может служить качественной реакцией на карбонаты: СаСО3 + 2Н+ ↔ Са2+ + Н2О
- 6. Как можно собрать СО2 М(воздуха)=29, т.е. СО2 тяжелее воздуха Метод вытеснения воды невозможен из-за протекания реакции:
- 7. Угольная кислота диссоциирует ступенчато: 1.H2CO3 ↔ Н+ + HCO3- 2. HCO3- ↔ Н+ + CO32-
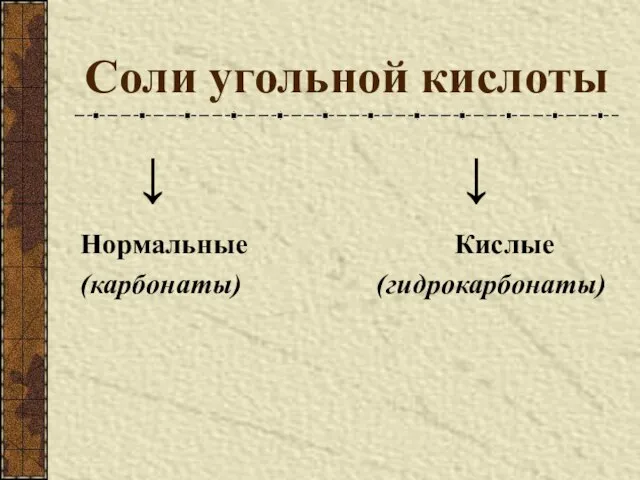
- 8. Соли угольной кислоты ↓ ↓ Нормальные Кислые (карбонаты) (гидрокарбонаты)
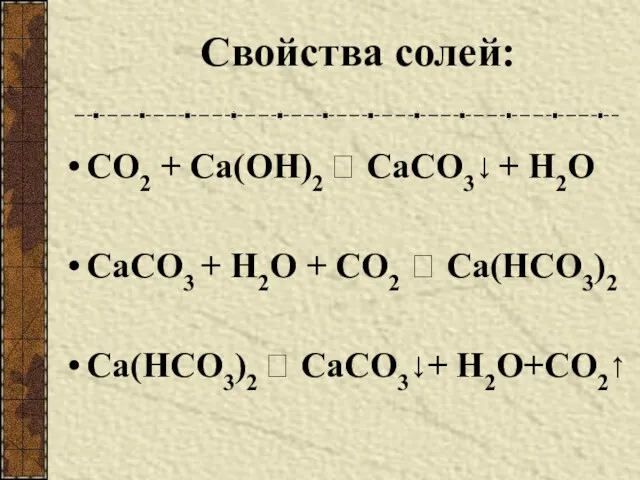
- 9. Свойства солей: СО2 + Са(ОН)2 ? СаСО3↓ + Н2О СаСО3 + Н2О + СО2 ? Са(НСО3)2
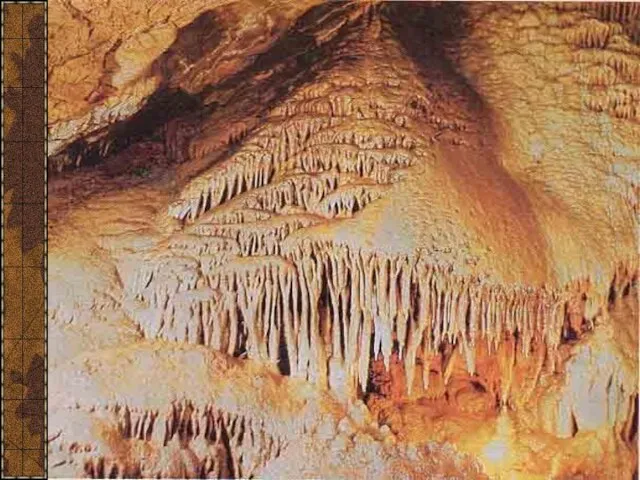
- 10. Красная пещера, или Кизил-Коба, самая крупная из 800 пещер Крыма. Она расположена в 3,5 км от
- 11. Сталагмиты
- 12. Сталактит «Пузатый»
- 13. Сталактит «Огненный»
- 17. Изучением карстовых пещер занимается наука – спелеология
- 18. Соли угольной кислоты: Мрамор, известняк, мел – СаСО3 На земле живут три брата Из семейства Карбонатов.
- 19. Доломит CaCO3. MgCO3 – обычно содержит глины и известняки, применяется для получения извести, солей магния, как
- 20. Сидерит FeCO3 – минерал бурого цвета, служит рудой для получения железа. Кальцинированная сода Na2CO3 – белый
- 21. Презентация разработки темы в курсе 9 класса. Подготовила учитель химии ОГРИНА СВЕТЛАНА ЮРЬЕВНА
- 23. Скачать презентацию




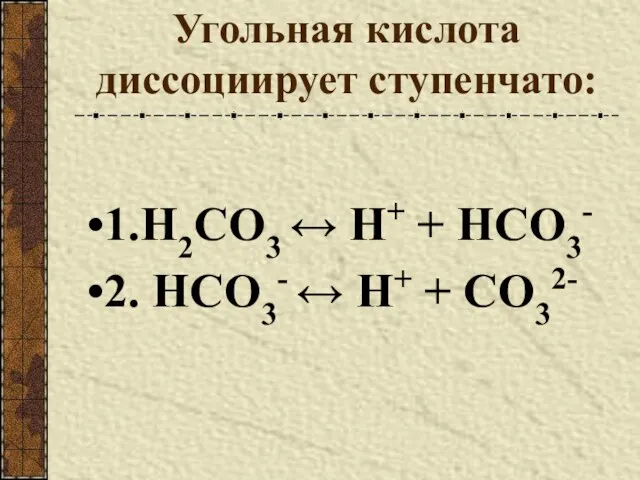











 Услуги и продукты: данные по Гл. Дорожному управлению
Услуги и продукты: данные по Гл. Дорожному управлению Дыхание растений
Дыхание растений Исследование аудиторий СМИ г. Сыктывкара
Исследование аудиторий СМИ г. Сыктывкара Отсчет до кубка конфедераций
Отсчет до кубка конфедераций Ты - предприниматель2012
Ты - предприниматель2012 Презентация на тему Белый цвет
Презентация на тему Белый цвет Количество студентов ИТ-специальностей в российских вузах и ссузах
Количество студентов ИТ-специальностей в российских вузах и ссузах STARTglobal
STARTglobal Государственно-общественное управление российским образованием
Государственно-общественное управление российским образованием Аналитическая биохимия
Аналитическая биохимия Русско-турецкая война 1877-1878 гг. глазами В.В. Верещагина
Русско-турецкая война 1877-1878 гг. глазами В.В. Верещагина Литература барокко. Драматургия Жана Расина. Творчество Жана де Лафонтена.Творчество Вольтера
Литература барокко. Драматургия Жана Расина. Творчество Жана де Лафонтена.Творчество Вольтера www.ratsp.ru
www.ratsp.ru Меры имущественной поддержки субъектов малого и среднего предпринимательства и самозанятых граждан в городе Кировске
Меры имущественной поддержки субъектов малого и среднего предпринимательства и самозанятых граждан в городе Кировске RT Channel 100 МИЛЛИОНОВ Число просмотров роликов RT на канале YOUTUBE достигло 100 МИЛЛИОНОВ В начале декабря RT стал САМЫМ ПРОСМАТРИВАЕМЫМ КА
RT Channel 100 МИЛЛИОНОВ Число просмотров роликов RT на канале YOUTUBE достигло 100 МИЛЛИОНОВ В начале декабря RT стал САМЫМ ПРОСМАТРИВАЕМЫМ КА ИППП сегодня!
ИППП сегодня! Презентация на тему Драгоценные камни
Презентация на тему Драгоценные камни Презентация на тему Слуховой анализатор Орган равновесия
Презентация на тему Слуховой анализатор Орган равновесия Интерференция света 9 класс
Интерференция света 9 класс Религиозно-рекреационный комплекс Шедруб линг в посёлке Косья
Религиозно-рекреационный комплекс Шедруб линг в посёлке Косья Заимствованные слова 6 класс
Заимствованные слова 6 класс Веселая Ярмарка для для настоящих мужчин и русских красавиц Туристического Комплекса «Ярославна»
Веселая Ярмарка для для настоящих мужчин и русских красавиц Туристического Комплекса «Ярославна» Предпринимательская деятельность граждан. Предпринимательская деятельность
Предпринимательская деятельность граждан. Предпринимательская деятельность Презентация на тему Использование энергии солнца на Земле
Презентация на тему Использование энергии солнца на Земле  Printsipy_organizatsii_sistemy_kontrolya_2022_mai_774_obschee
Printsipy_organizatsii_sistemy_kontrolya_2022_mai_774_obschee Алгоритмы циклическойструктуры, программирование на языке PascalЧасть 2
Алгоритмы циклическойструктуры, программирование на языке PascalЧасть 2 Презентация на тему Прощай, Азбука! 1 класс
Презентация на тему Прощай, Азбука! 1 класс Ланец Екатерина Артуровна Учитель начальных классов . Стаж работы в школе-32 года Закончила Серовское педагогическое училище в 197
Ланец Екатерина Артуровна Учитель начальных классов . Стаж работы в школе-32 года Закончила Серовское педагогическое училище в 197