Содержание
- 6. Классификация органических реакций I. По результату реакции делят на 1) реакции замещения , S , (substitution
- 7. 2. Реакции присоединения Ad (аddition присоединение): CH2=CH2 + Br2 CH2BrCH2Br H2C=O + HCN
- 8. 3. Реакции отщепления, E (El) (еlimination): CH2BrCH2Br + Zn CH2=CH2 + ZnBr2 .
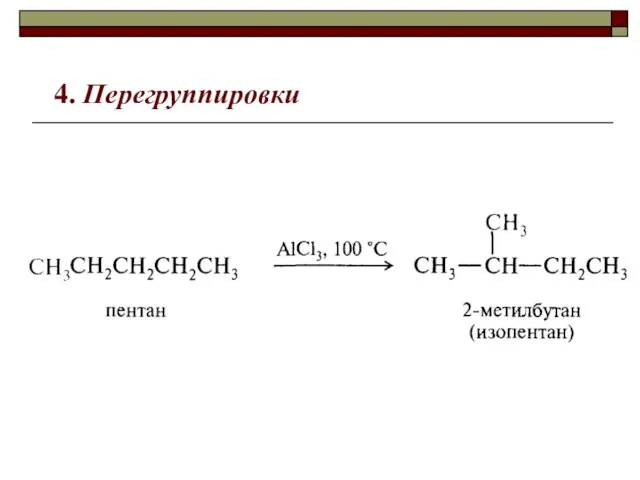
- 9. 4. Перегруппировки
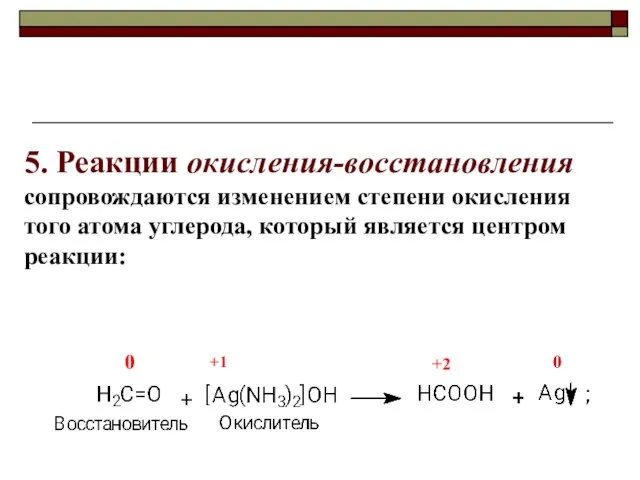
- 10. 5. Реакции окисления-восстановления сопровождаются изменением степени окисления того атома углерода, который является центром реакции: 0 +1
- 11. Степень окисления углерода Степень окисления атома углерода равна алгебраической сумме числа всех его связей с атомами
- 13. II. По механизму 1. Радикальные реакции, R• / •H R• + H• (гомолиз)
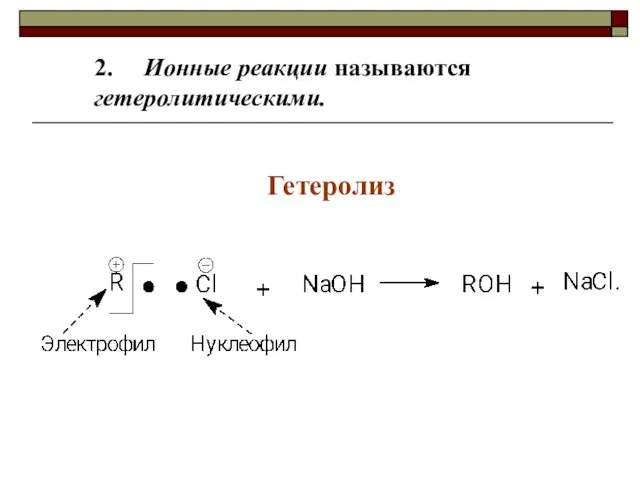
- 14. 2. Ионные реакции называются гетеролитическими. Гетеролиз
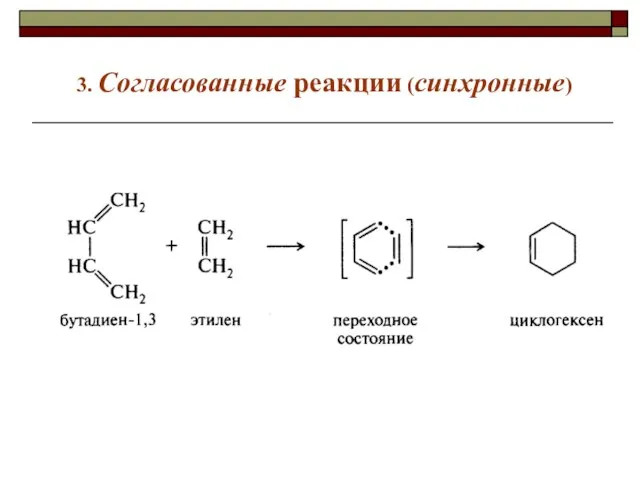
- 15. 3. Согласованные реакции (синхронные)
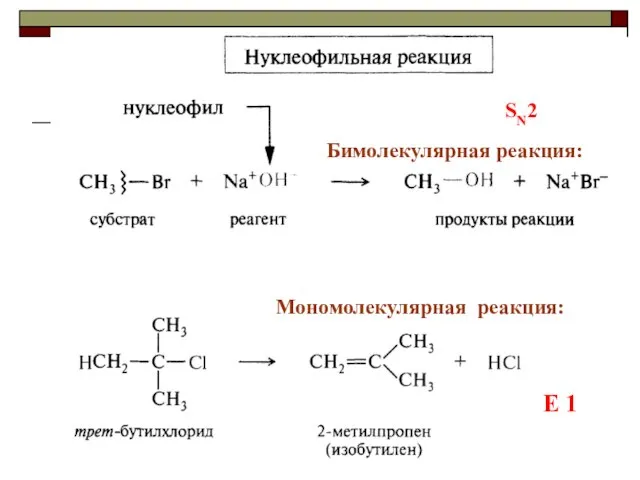
- 16. III. По молекулярности реакции делятся на мономолекулярные и бимолекулярные A + B AB Мономолекулярная реакция (диссоциативная):
- 17. Мономолекулярная реакция: Бимолекулярная реакция: E 1 SN2
- 18. Типы реагентов молекулы с сильно поляризованными связями
- 19. Электрофилы ( акцепторы электронов)
- 20. Нуклеофильный реагент
- 21. нуклеофилы
- 22. Радикальные реагенты Br . , CI ., HO ., CH3. , RO.
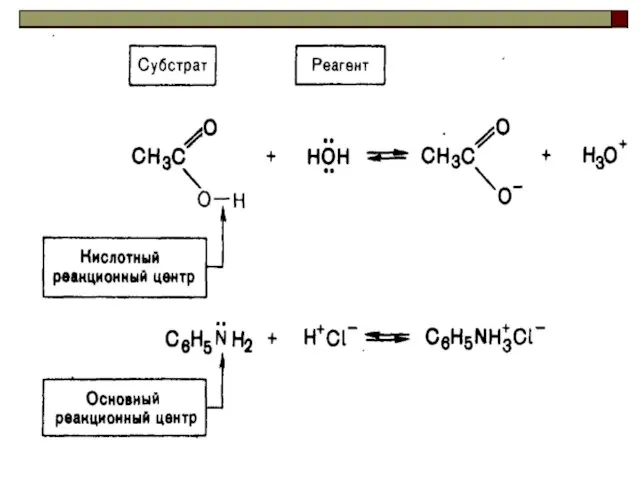
- 23. При оценке основности за субстрат принимают протон, при оценке нуклеофильности электронодефицитный атом углерода.
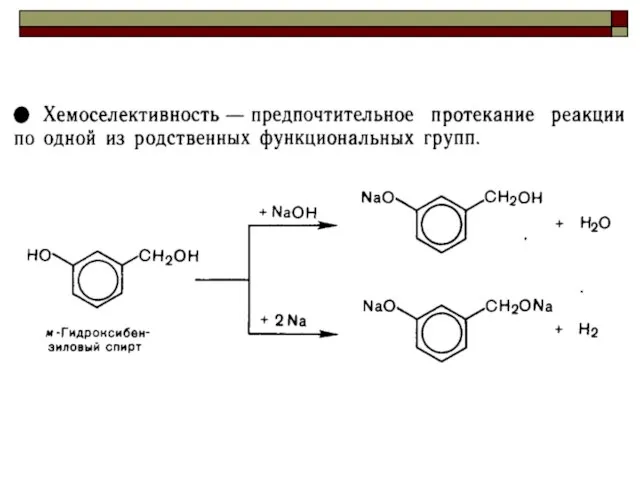
- 26. Селективность ( избирательность) химических превращений.
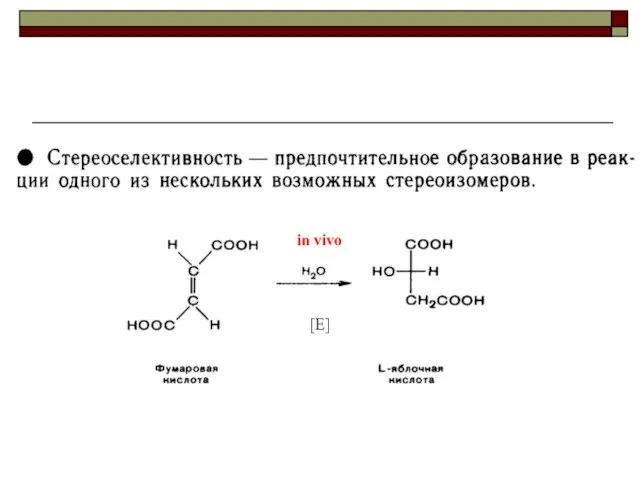
- 28. in vivo
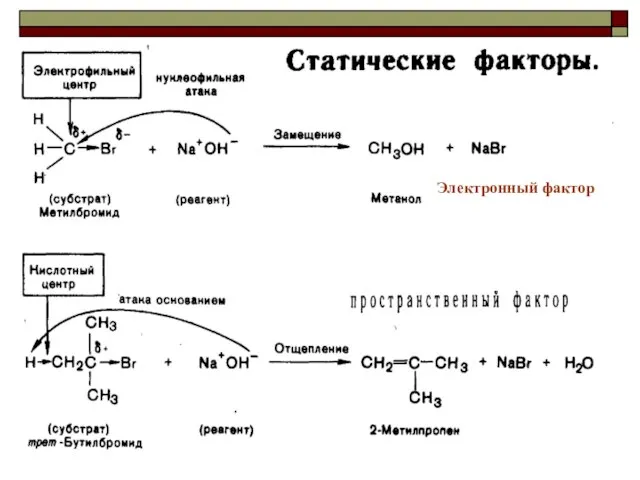
- 29. Факторы,определяющие реакционную способность Электронные факторы Пространственные факторы
- 30. Электронный фактор
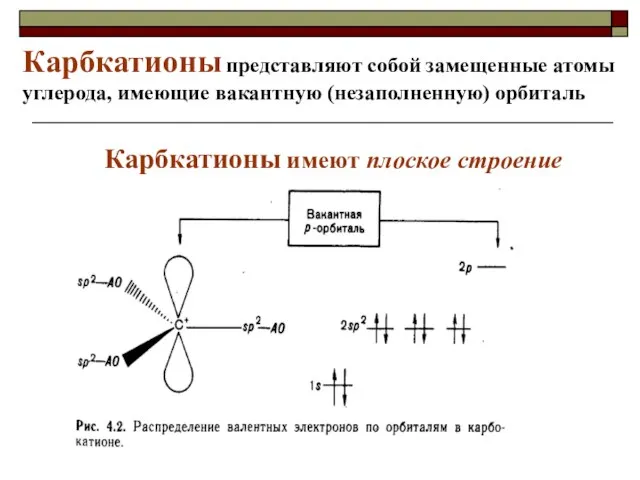
- 31. Интермедиаты делят на свободные радикалы, Карб(о)катионы и карбанионы.
- 32. Карбкатионы имеют плоское строение Карбкатионы представляют собой замещенные атомы углерода, имеющие вакантную (незаполненную) орбиталь
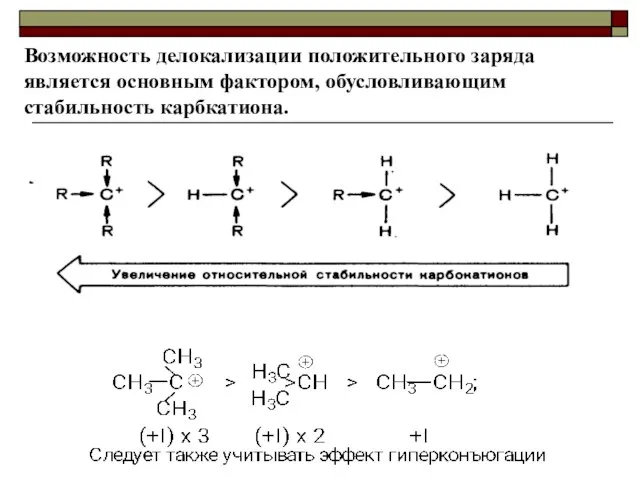
- 33. Возможность делокализации положительного заряда является основным фактором, обусловливающим стабильность карбкатиона.
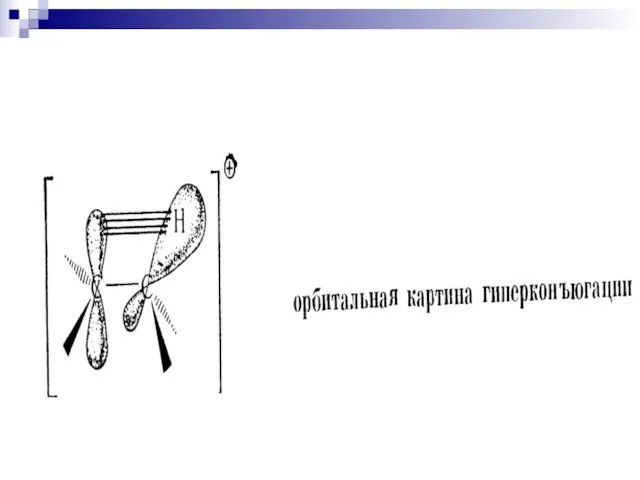
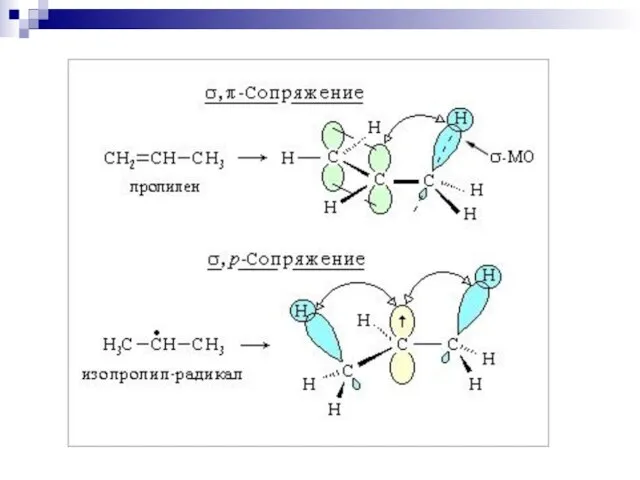
- 34. Сверхсопряжение (гиперконъюгация) (1935) 2-метилбутен-2 2-метилбутен-1 – стабилизация частично заполненной или свободной орбитали путём перекрывания с заполненной
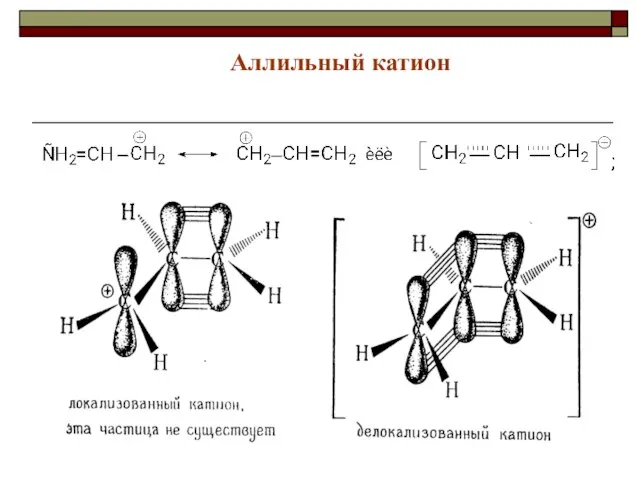
- 37. Аллильный катион
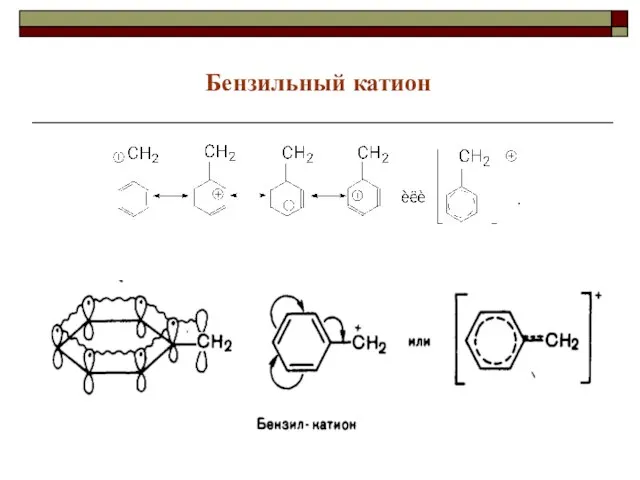
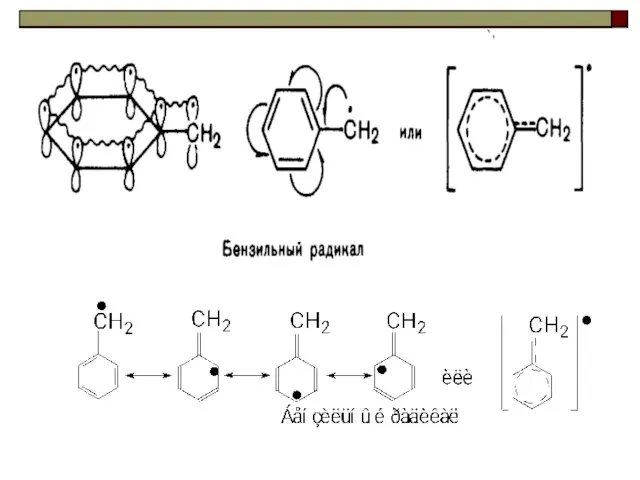
- 38. Бензильный катион
- 39. CH2=CH+ Винильный катион C6H5+ Фенильный катион
- 40. Ряд устойчивости катионов: Бензильный, аллильный > третичный > вторичный > первичный > метильный > винильный >
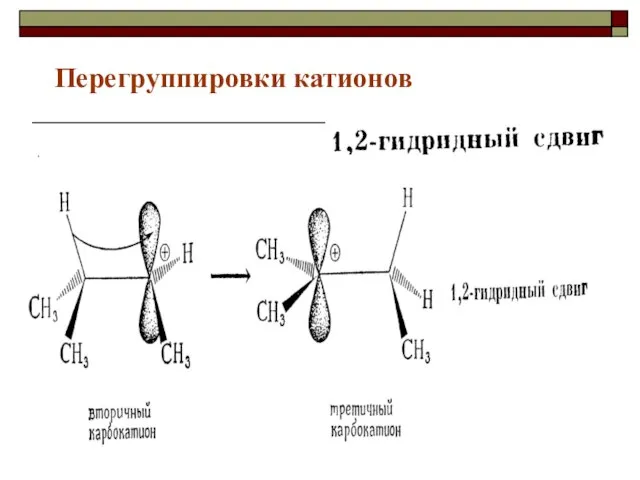
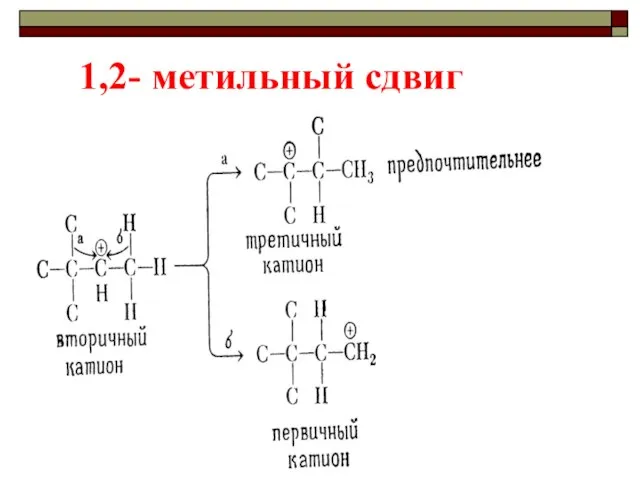
- 41. Перегруппировки катионов
- 42. 1,2- метильный сдвиг
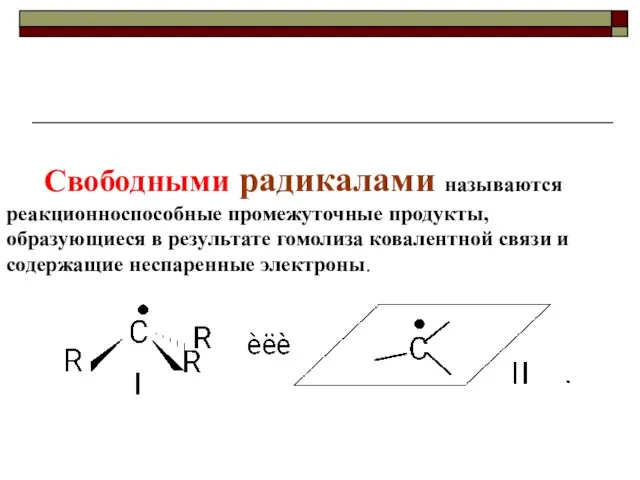
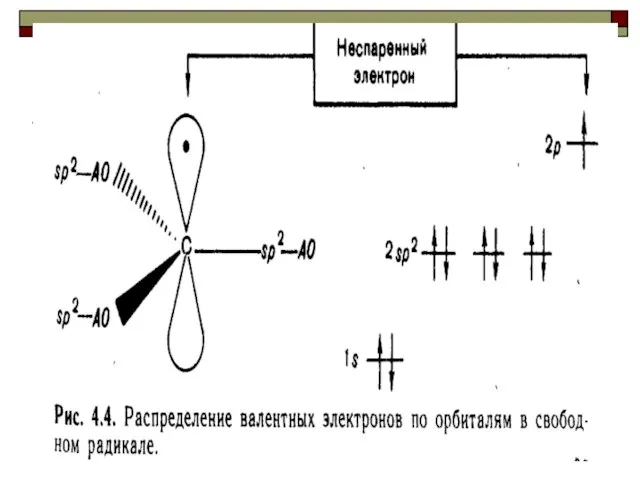
- 43. Свободными радикалами называются реакционноспособные промежуточные продукты, образующиеся в результате гомолиза ковалентной связи и содержащие неспаренные электроны.
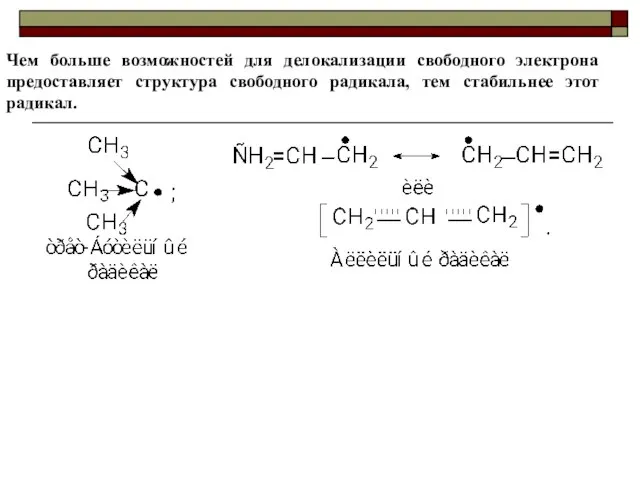
- 45. Чем больше возможностей для делокализации свободного электрона предоставляет структура свободного радикала, тем стабильнее этот радикал.
- 47. C6H5• Ряд увеличения стабильности свободных радикалов: (нужны электронодонорные заместители)
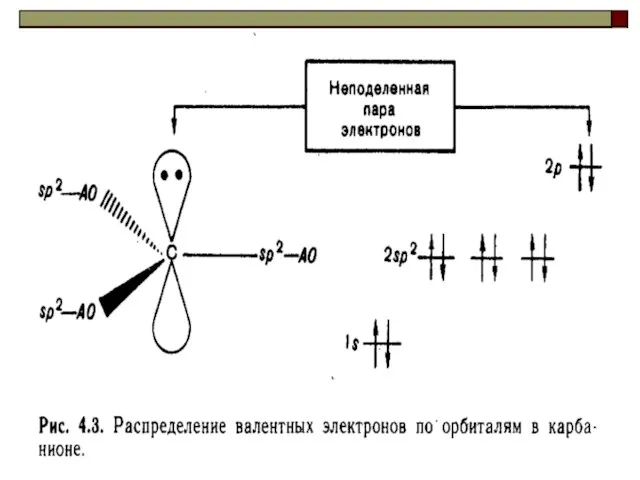
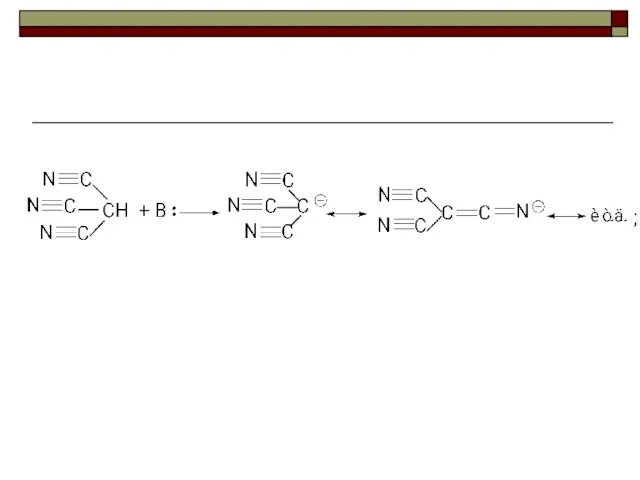
- 48. Карбанионы образуются в результате отщепления протона от тех соединений, которые функционируют как СН-кислоты. HCCH + Na+NH2
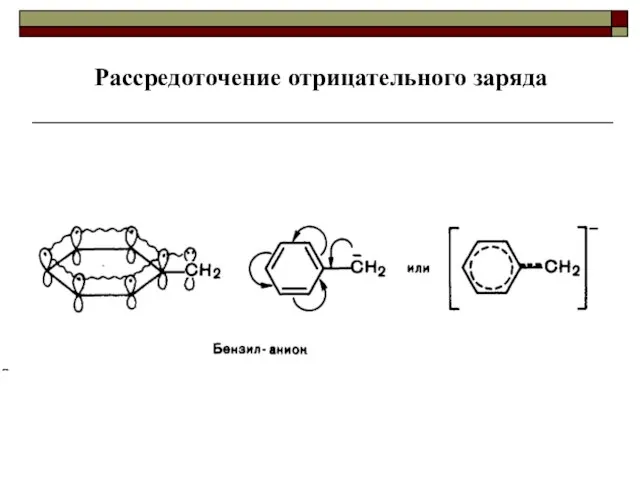
- 50. Рассредоточение отрицательного заряда
- 52. Ряд устойчивости анионов: Бензильный, аллильный > ацетиленовый > метильный > первичный> вторичный > третичный > фенильный
- 53. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. № 4
- 54. Теория Брёнстеда-Лоури. (1923). Датский физикохимик Йоханнес Николаус Брёнстед, 1879-1947 Английский химик Томас Мартин Лоури, 1874-1936
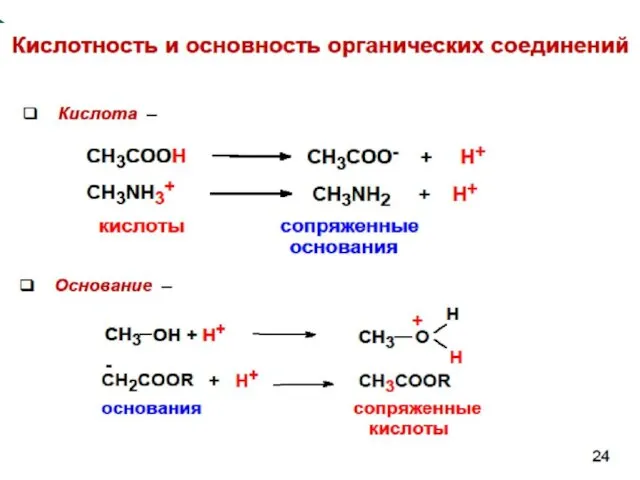
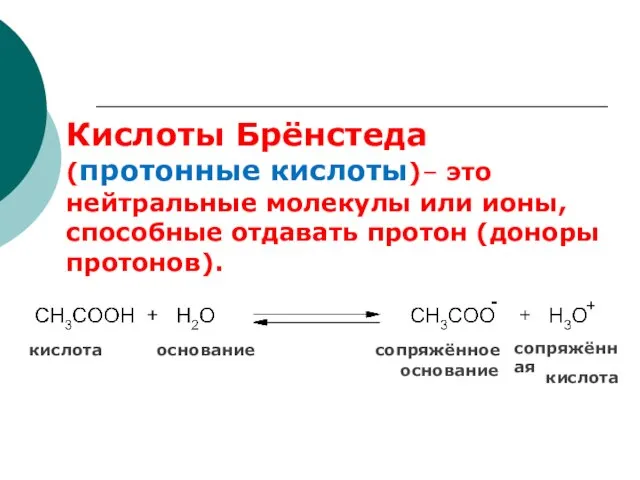
- 56. Кислоты Брёнстеда (протонные кислоты)– это нейтральные молекулы или ионы, способные отдавать протон (доноры протонов). сопряжённая кислота
- 57. Кислотность по Брёнстеду Органические кислоты классифицируют по природе кислотного центра: ОН-кислоты: спирты, фенолы, карбоновые кислоты, сульфокислоты,
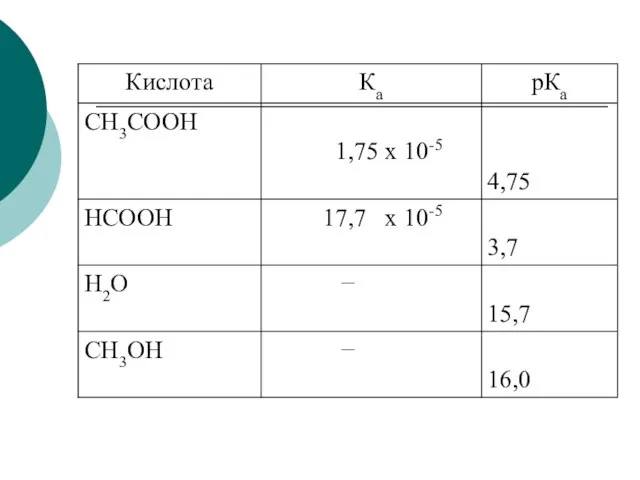
- 58. Константа кислотности (Ка) pKa = - lg Ka. Чем меньше рКа, тем больше кислотность
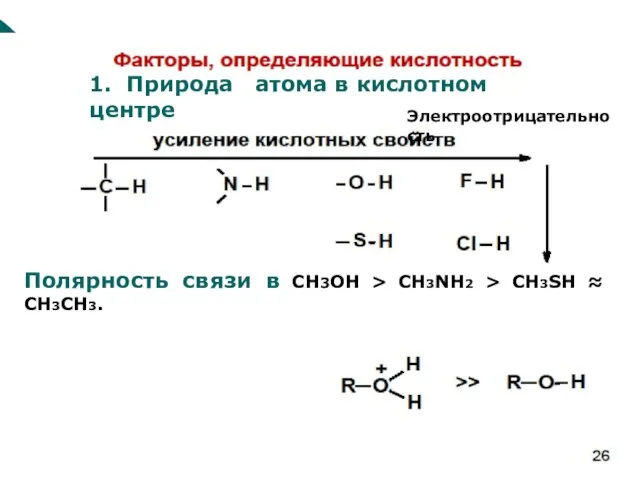
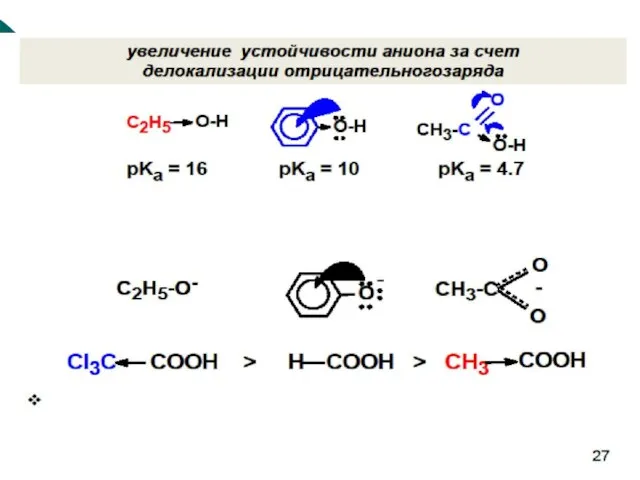
- 60. Стабильность аниона зависит от: 1. природы атома в кислотном центре 2. возможности стабилизации аниона за счет
- 61. 1. Природа атома в кислотном центре Полярность связи в CH3OH CH3NH2 CH3SH ≈ СН3CH3.
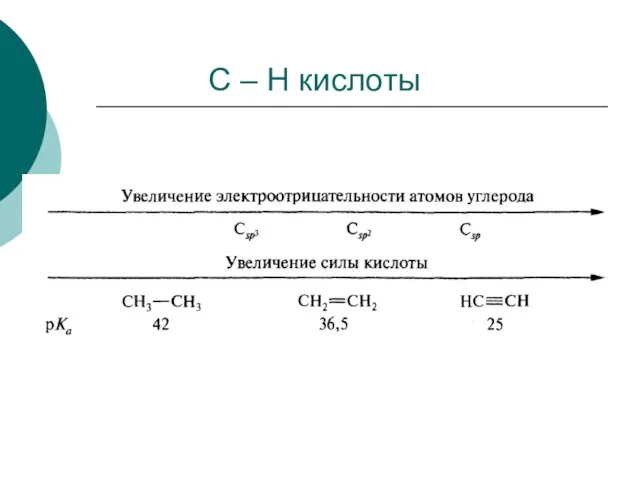
- 62. С – Н кислоты
- 63. По группам При одинаковых радикалах кислотность уменьшается в ряду: -SH >-OH > -NH > -CH. (Поляризуемость)
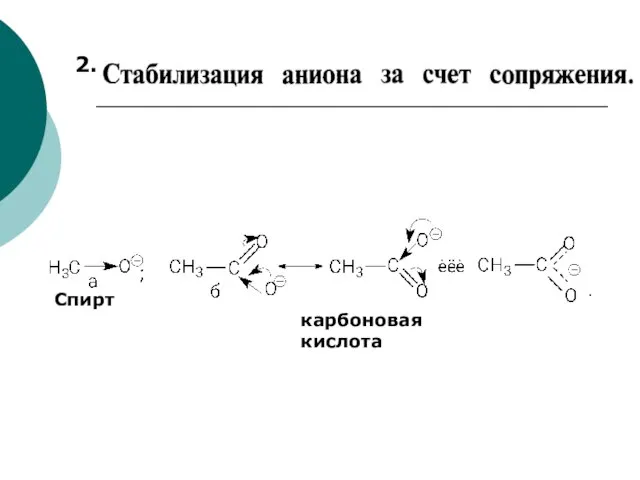
- 64. 2. Спирт карбоновая кислота
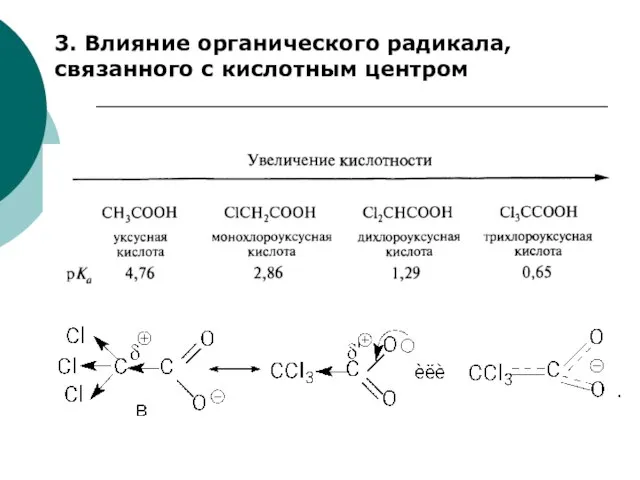
- 65. 3. Влияние органического радикала, связанного с кислотным центром
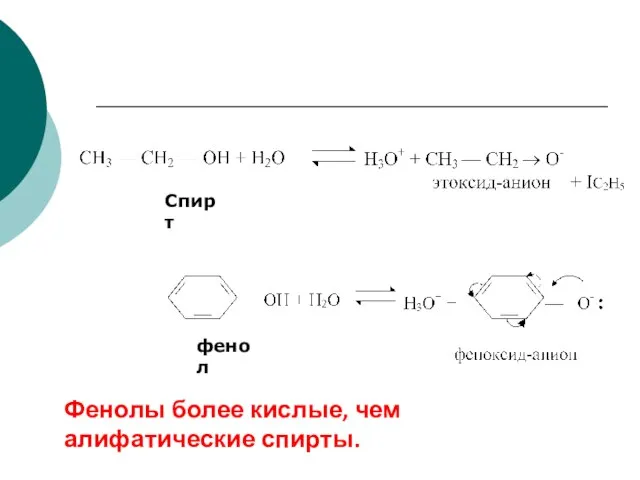
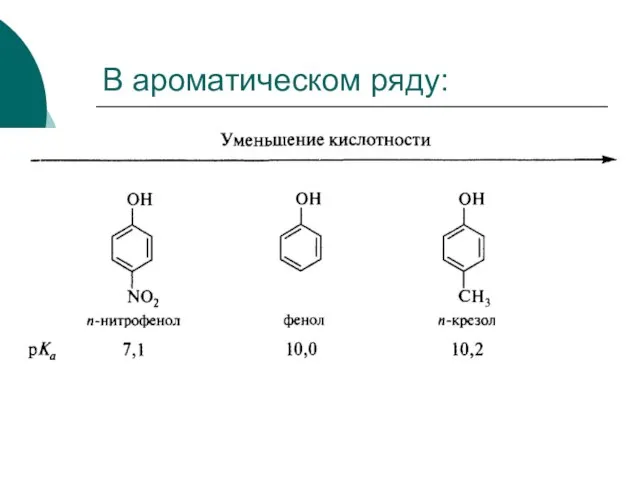
- 67. Спирт фенол Фенолы более кислые, чем алифатические спирты.
- 68. В ароматическом ряду:
- 69. 4. Влияние растворителя. Эффект сольватации (гидратации). лучше гидратируются небольшие по размеру ионы с низкой степенью делокализации
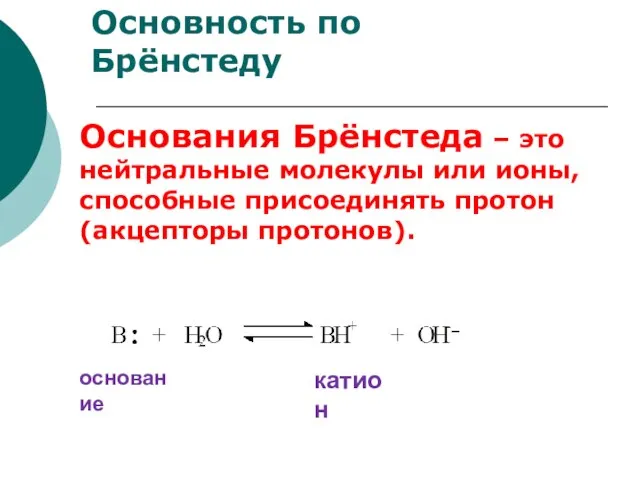
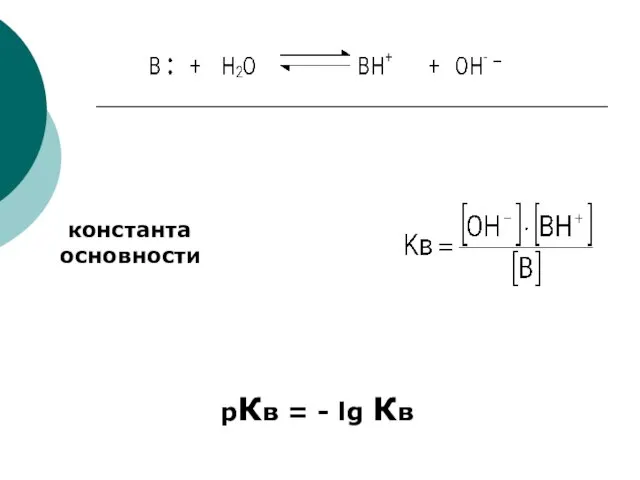
- 71. Основность по Брёнстеду Основания Брёнстеда – это нейтральные молекулы или ионы, способные присоединять протон (акцепторы протонов).
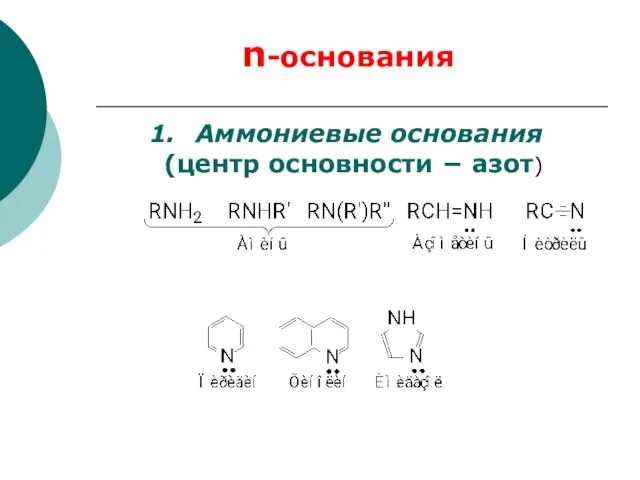
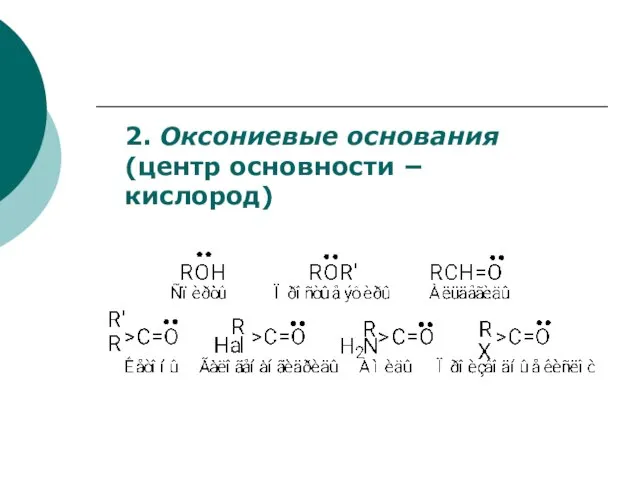
- 72. Аммониевые основания (центр основности азот) n-основания
- 73. 2. Оксониевые основания (центр основности кислород)
- 74. 3. Сульфониевые основания (центр основности сера) :
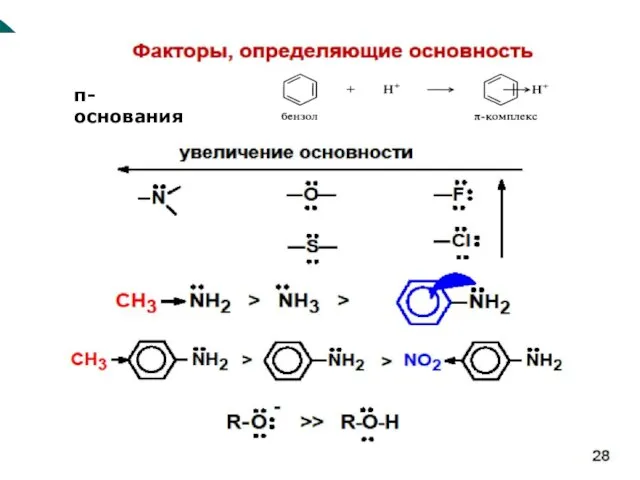
- 75. Основность тем выше, чем выше концентрация отрицательного заряда на атоме Сила n-оснований с одинаковыми радикалами уменьшается
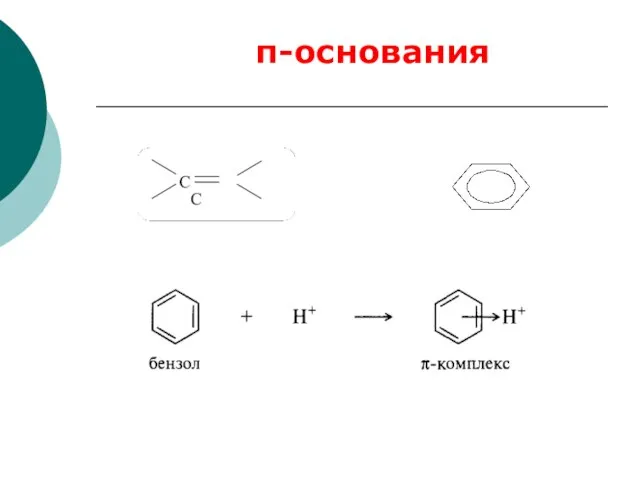
- 76. -основания
- 77. рКв = - lg Кв константа основности _
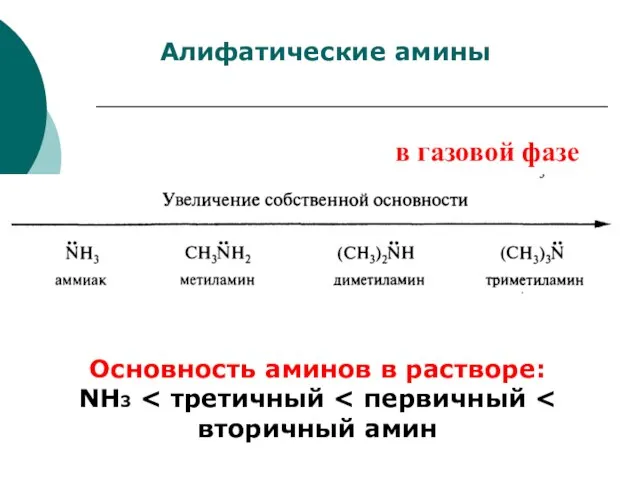
- 78. Алифатические амины Основность аминов в растворе: NH3 третичный первичный вторичный амин в газовой
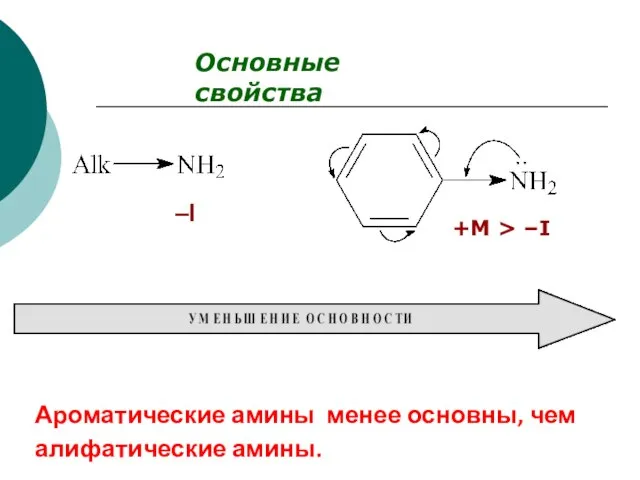
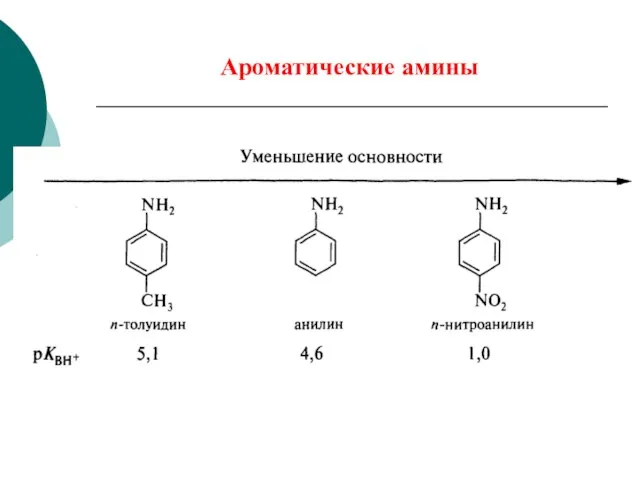
- 79. Основные свойства –I +M > –I Ароматические амины менее основны, чем алифатические амины.
- 80. Ароматические амины
- 81. -основания
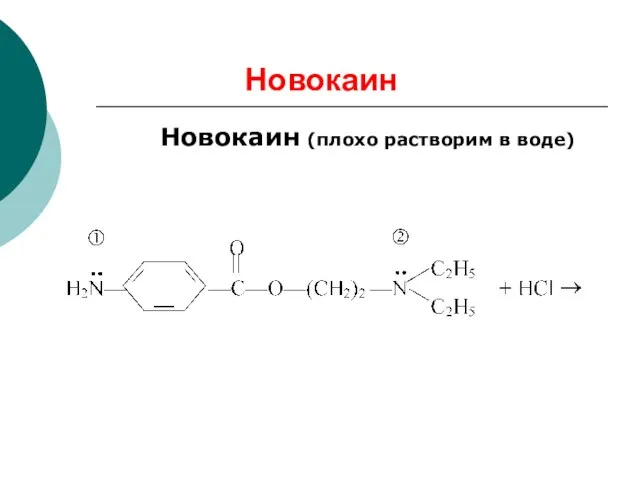
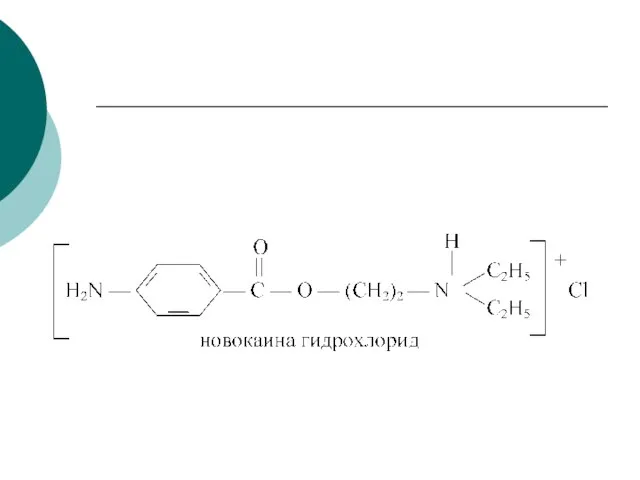
- 82. Новокаин Новокаин (плохо растворим в воде)
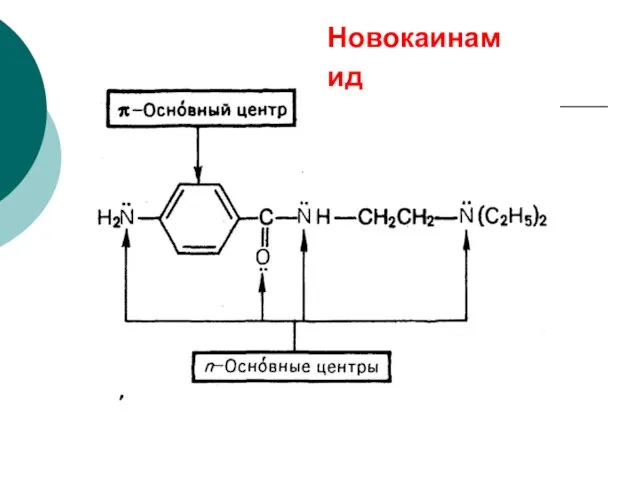
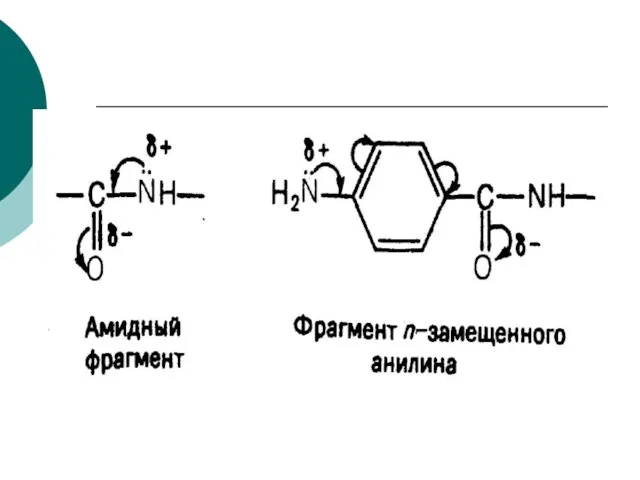
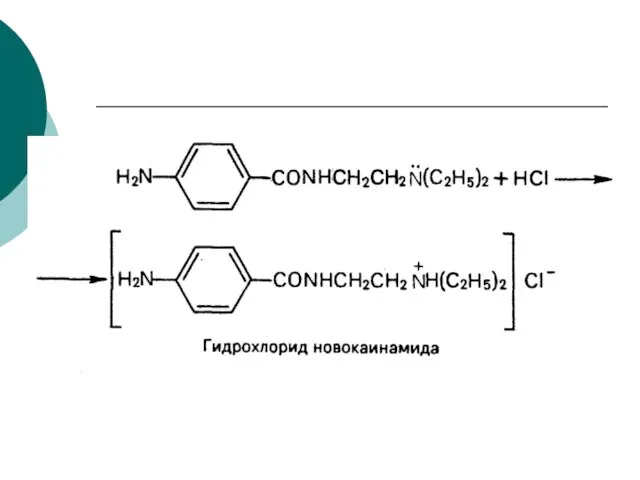
- 84. Новокаинамид
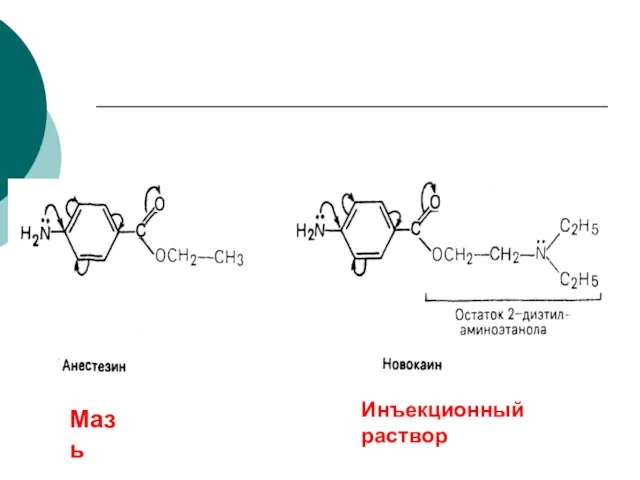
- 87. Мазь Инъекционный раствор
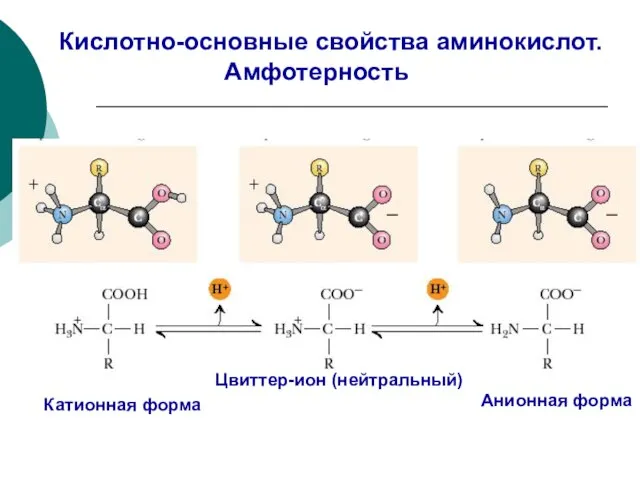
- 88. Кислотно-основные свойства аминокислот. Амфотерность Катионная форма Цвиттер-ион (нейтральный) Анионная форма
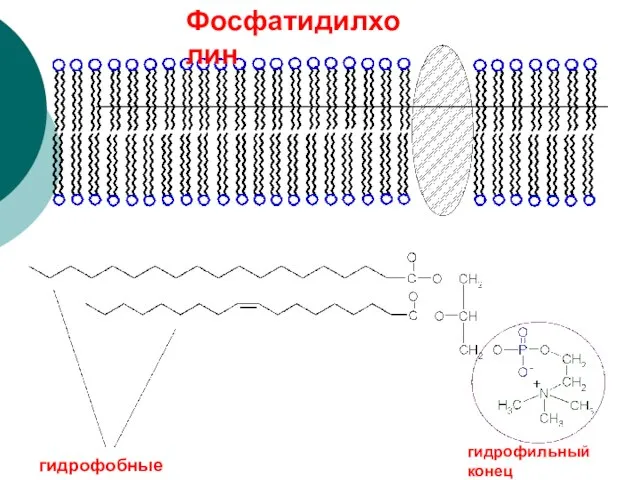
- 89. гидрофобные концы гидрофильный конец Фосфатидилхолин
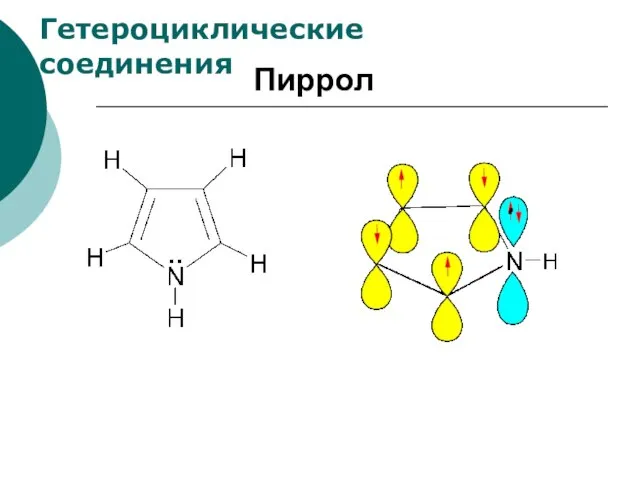
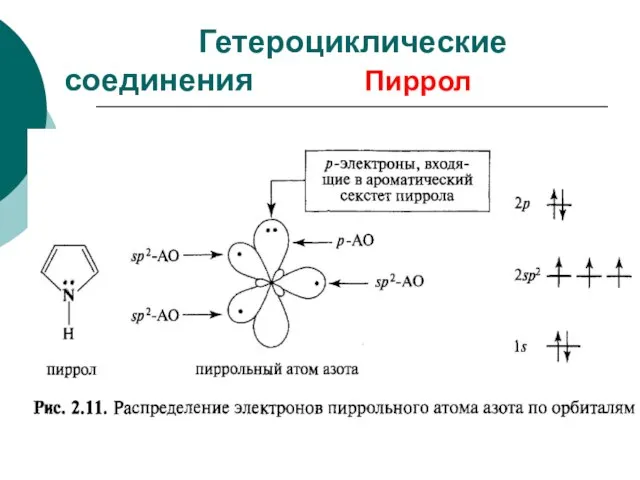
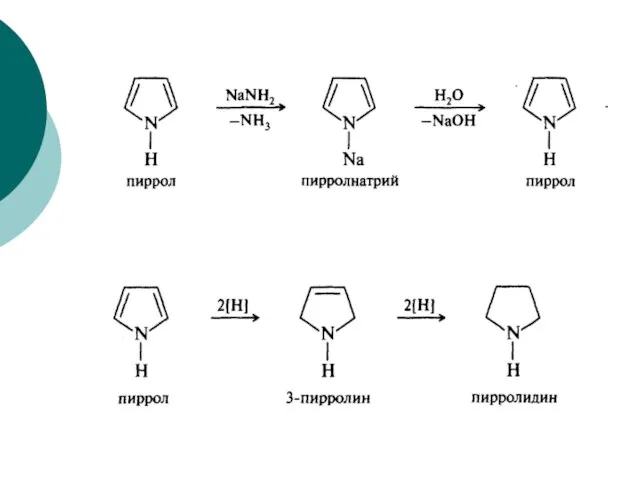
- 90. Пиррол Гетероциклические соединения
- 91. Гетероциклические соединения Пиррол
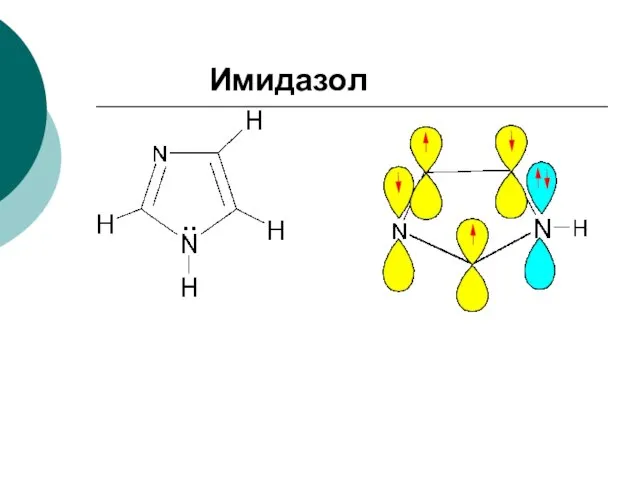
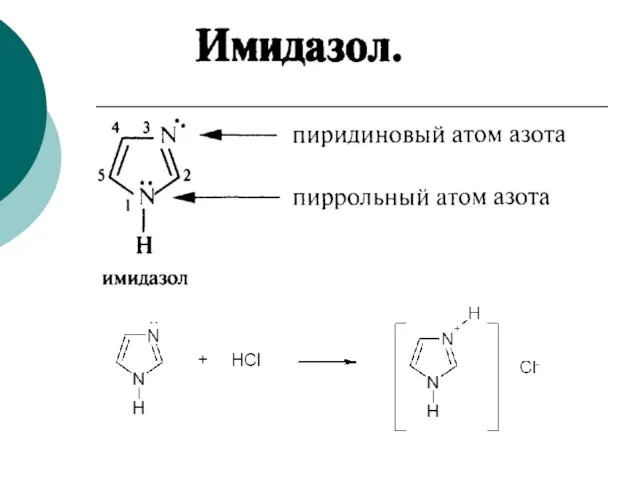
- 93. Имидазол
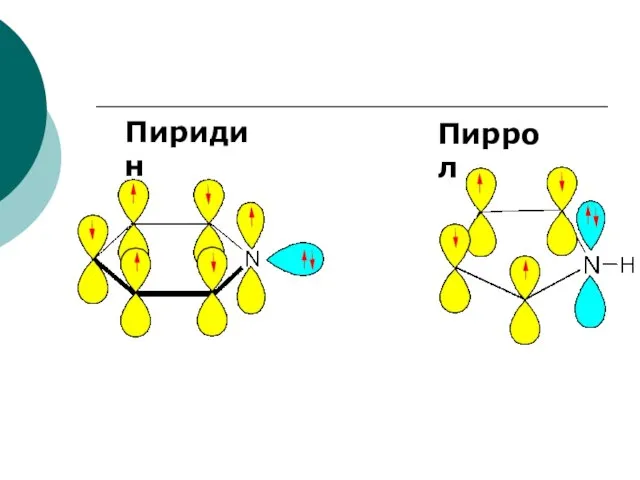
- 95. Пиридин Пиррол
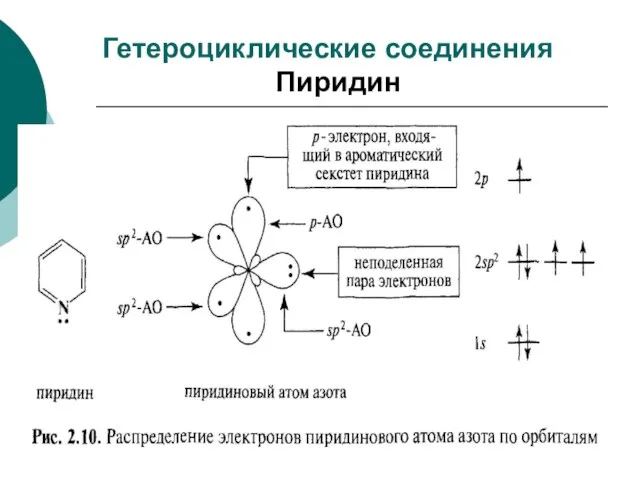
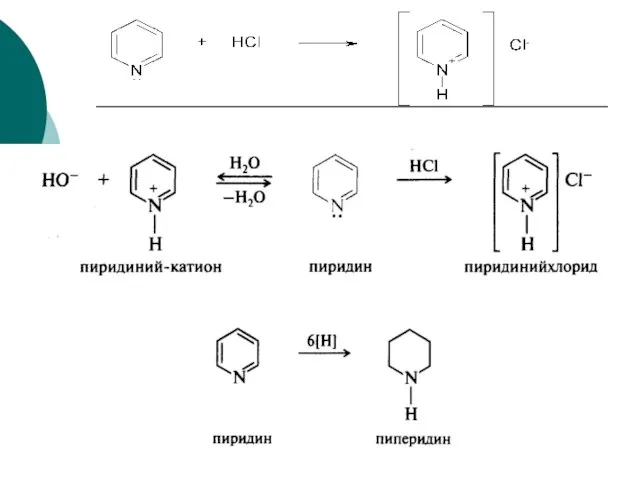
- 96. Гетероциклические соединения Пиридин
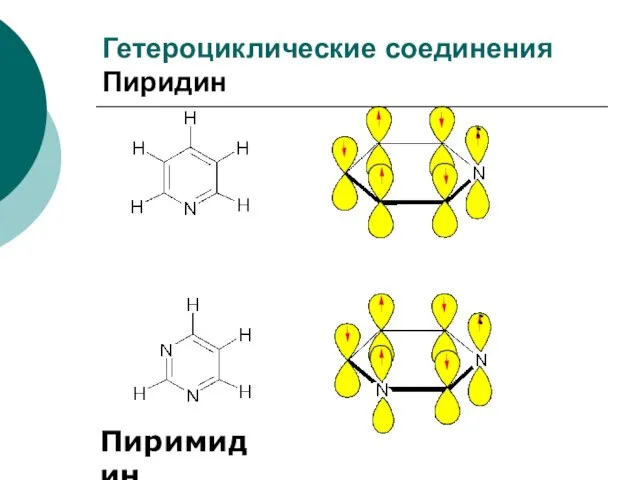
- 97. Гетероциклические соединения Пиридин Пиримидин
- 99. кислота это акцептор пары электронов, основание это донор электронной пары. Теория Льюиса (1923) Кислотно-основный
- 100. ЛЬЮИС (Lewis), Джилберт Ньютон Американский физикохимик 23 октября 1875 г. – 23 марта 1946 г.
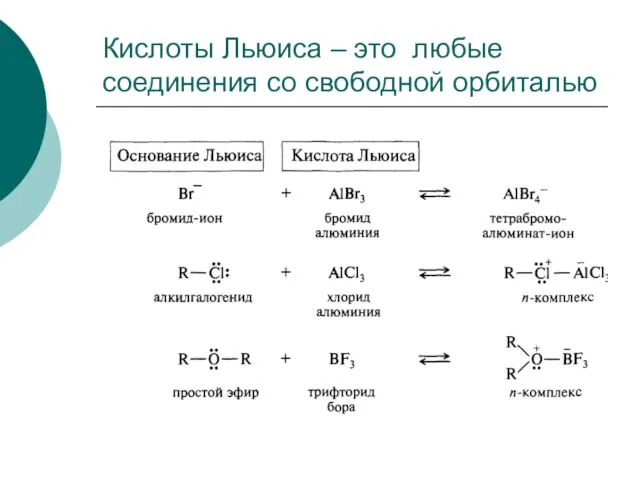
- 101. Кислоты Льюиса – это любые соединения со свободной орбиталью
- 102. Теория Льюиса
- 105. Скачать презентацию








































 NATIONAL MONITORING SYSTEM AND DEPARTMENTAL RESOURCES
NATIONAL MONITORING SYSTEM AND DEPARTMENTAL RESOURCES Физико-механические свойства горных пород
Физико-механические свойства горных пород Выполнила: Лупанова Эмилия ученица 4 «В» класса Руководитель: Кириченко Н. М. Муниципальное общеобразовательное учреждение «Гимна
Выполнила: Лупанова Эмилия ученица 4 «В» класса Руководитель: Кириченко Н. М. Муниципальное общеобразовательное учреждение «Гимна Основы геймификации. Путь героя
Основы геймификации. Путь героя Студия “Азбука счастья”. Золотая осень
Студия “Азбука счастья”. Золотая осень Презентация на тему ПРЕДМЕТ И МЕТОД ЭКОНОМИКИ»
Презентация на тему ПРЕДМЕТ И МЕТОД ЭКОНОМИКИ»  КОММЕРЧЕСКОЕ ПРЕДЛОЖЕНИЕ
КОММЕРЧЕСКОЕ ПРЕДЛОЖЕНИЕ Николай Алексеевич Заболоцкий
Николай Алексеевич Заболоцкий Деятельностный подход
Деятельностный подход Волейбол
Волейбол ФГОС общего образования механизмы реализации
ФГОС общего образования механизмы реализации Abidas. Спортивная одежда
Abidas. Спортивная одежда Зал Воинской славы
Зал Воинской славы АТС – ЭТО ТОЛЬКО НАЧАЛО!
АТС – ЭТО ТОЛЬКО НАЧАЛО! ТЕМА №3: Эмоции и психические состояния.Свойства личности
ТЕМА №3: Эмоции и психические состояния.Свойства личности Презентация без названия
Презентация без названия Оценочные кулинарные системы мира
Оценочные кулинарные системы мира В подводном царстве
В подводном царстве Поведение во время грозы
Поведение во время грозы Новое название СУИ
Новое название СУИ Информационная аналитическая система «1C:КОНСАЛТИНГ. СТАНДАРТ»П Р Е З Е Н Т А Ц И Я С И С Т Е М Ы
Информационная аналитическая система «1C:КОНСАЛТИНГ. СТАНДАРТ»П Р Е З Е Н Т А Ц И Я С И С Т Е М Ы Жан-Бати́ст Ками́ль Коро́
Жан-Бати́ст Ками́ль Коро́ Интернет-магазин – это большой рынок, состоящий из кучи лотков. Тут покупателю легко потеряться и забыть, за чем он пришел. Платфор
Интернет-магазин – это большой рынок, состоящий из кучи лотков. Тут покупателю легко потеряться и забыть, за чем он пришел. Платфор body language
body language  NEW清关随车文件022HJ003-081901 (1)
NEW清关随车文件022HJ003-081901 (1) Pandora DX-90BT. Базовый блок системы
Pandora DX-90BT. Базовый блок системы Классификация национальных систем учета. Причины классификации
Классификация национальных систем учета. Причины классификации Technology
Technology