Слайд 2Определение
Предельные углеводороды - это органические вещества, состоящие только из углерода и водорода,

соответствующие общей формуле Сn Н2n +2.
У этих веществ только простые одинарные связи между атомами углерода, которые соединяются с максимально возможным количеством числом атомов водорода. Их поэтому называют предельными или насыщенными.
Слайд 3Изомеры
Изомеры - это вещества, имеющие одинаковый качественный и количественный состав, но отличающиеся

по своему строению и свойствам
Изомерия- это явление существования веществ с одинаковым качественным и количественным составом, но отличающимся по своему строению и свойствам
Слайд 4
Примеры изомеров
Для вещества с общей молекулярной формулой С4Н10 существуют 2 изомера:

СН3-СН2-СН2-СН3 (н - бутан, t кип.=-0,50С)
СН3- СН -СН3 (изобутан, t кип.=-11,70С)
|
СН3
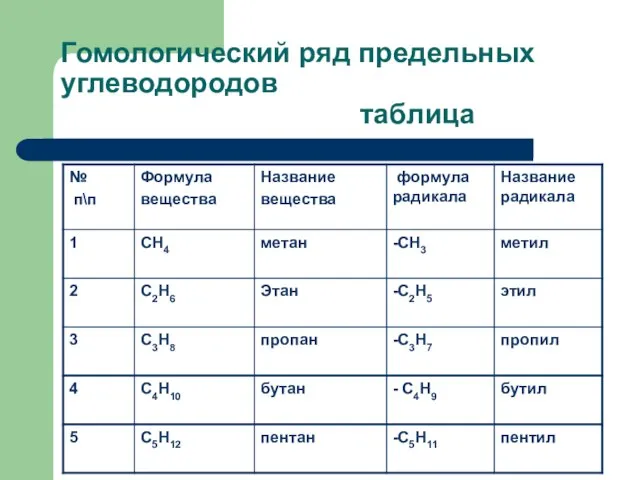
Слайд 5Гомологический ряд предельных углеводородов
таблица
Слайд 7Гомологи
Гомологи – вещества, расположенные в порядке возрастания относительных молекулярных масс, сходных по

строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп -СН2-
Гомологический ряд- ряд веществ, расположенных в порядке возрастания относительных молекулярных масс, сходных по строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп -СН2-
Слайд 8Физические свойства предельных углеводородов
Агрегатное состояние: первые четыре члена гомологического ряда(С1-С4) – газы,

С5-С15- жидкости, С16 и более тяжелые – твердые вещества
Температура кипения и плавления постепенно увеличиваются с ростом молекулярной массы вещества
Растворимость в воде - плохая
Слайд 9Нахождение в природе и получение предельных углеводородов
Предельные углеводороды встречаются:
√ в природном

газе (98%- метан);
√ в попутном нефтяном газе (С1-С6);;
√ в нефти (С5-С50);
√ в каменном угле
Получают их из природного сырья.
Слайд 10Химические свойства предельных углеводородов
Для предельных углеводородов характерны следующие химические реакции:
√ замещения (по

свободно-радикальному механизму);
√ окисления (полное и неполное);
√ разложения (крекинг, дегидрирование);
√ изомеризации.
Для предельных углеводородов совсем не характерны реакции присоединения.
Слайд 11Реакции замещения
1. Реакция хлорирования на свету
1 2 3 4
СН4 →СН3 Сl →СН2

Сl 2 →СН Сl 3 →С Сl 4
СН4 +Cl2 → СН3 Сl (первая стадия)
хлорметан
2. СН3 Сl +Cl2 → СН2 Сl 2 (вторая стадия)
дихлорметан
3. СН2 Сl 2 +Cl2 → СН Сl 3 (третья стадия)
тр ихлорметан
4. СН Сl 3 +Cl2 → С Сl 4 (четвертая стадия)
тетрахлорметан
2. Реакция нитрования(реакция Коновалрва)
СН4 +НNO3→ СН3 NO2 +H2O
Слайд 12Реакции окисления
Полное окисление – горение
СН4 + 2О 2→СО 2 +2Н2О +Q
2. Неполное

окисление
СН4 + [О] →метиловый спирт, м метаналь (формальдегид),
метановая (муравьиная)кислота
Слайд 13Реакции разложения
1. крекинг (реакции идут при нагревании с разрывом углеродной цепи)
15000С
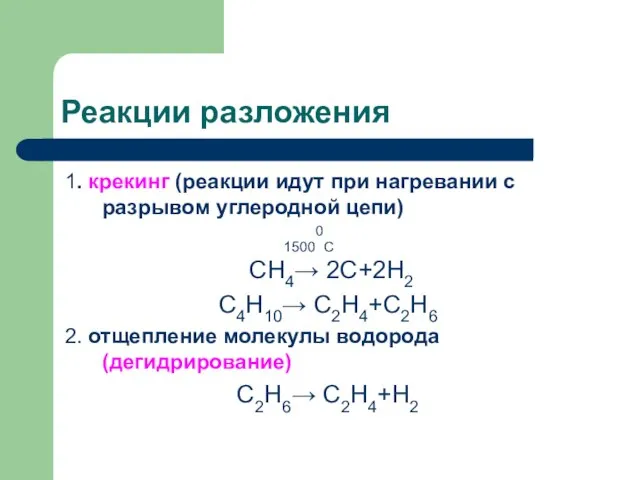
СН4→ 2С+2Н2
С4Н10→ С2Н4+С2Н6
2. отщепление молекулы водорода (дегидрирование)
С2Н6→ С2Н4+Н2
Слайд 14Реакции изомеризации
В реакциях изомеризации не меняется количественный и качественный состав веществ, меняется
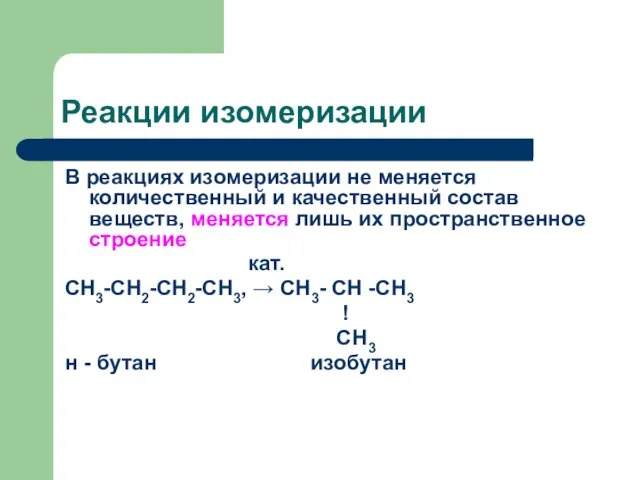
лишь их пространственное строение
кат.
СН3-СН2-СН2-СН3, → СН3- СН -СН3
!
СН3
н - бутан изобутан












 Russian Rock Music: A Sociocultural Perspective
Russian Rock Music: A Sociocultural Perspective Православные храмы камчатского края
Православные храмы камчатского края Рисование клоуна с элементами аппликации
Рисование клоуна с элементами аппликации Правительственная программа «Английский язык для Республики Татарстан»
Правительственная программа «Английский язык для Республики Татарстан» Enchanté
Enchanté Фотосессия на День Святого Валентина
Фотосессия на День Святого Валентина Анализ и совершенствование рекламной деятельности гостиничного предприятия
Анализ и совершенствование рекламной деятельности гостиничного предприятия Склонение имён существительных в русском языке
Склонение имён существительных в русском языке Туристическое снаряжение
Туристическое снаряжение матиматикония
матиматикония Obstetrics and Gynecology
Obstetrics and Gynecology Презентация на тему Обеспечение
Презентация на тему Обеспечение Проект технічного оснащення м’ясопереробного підприємства
Проект технічного оснащення м’ясопереробного підприємства Презентация на тему профилактика курения
Презентация на тему профилактика курения  Тема: Реальдо Коломбо: описание циркуляции крови через лёгкие.
Тема: Реальдо Коломбо: описание циркуляции крови через лёгкие. Украинская АссоциацияИнтернет Рекламы
Украинская АссоциацияИнтернет Рекламы Новые организационно-правовые формы учреждений дополнительного образования
Новые организационно-правовые формы учреждений дополнительного образования Сертификаты соответствия на продукцию
Сертификаты соответствия на продукцию Информационно-справочная система Предприятие средств диспетчерского и технологического управления РУП Гродноэнерго
Информационно-справочная система Предприятие средств диспетчерского и технологического управления РУП Гродноэнерго Где логика? Интерактивная игра. Человеческие органы
Где логика? Интерактивная игра. Человеческие органы Осторожно: клещи
Осторожно: клещи ДП «Укрметртестстандарт» Науково-технічний семінар-нарада «Проблеми підвищення рівня метрологічного забезпечення вимірювань
ДП «Укрметртестстандарт» Науково-технічний семінар-нарада «Проблеми підвищення рівня метрологічного забезпечення вимірювань Предвыборная программа
Предвыборная программа Логические основы построения компьютера. Основные понятия алгебры логики Алгебра логики – это раздел математики, изучающий выск
Логические основы построения компьютера. Основные понятия алгебры логики Алгебра логики – это раздел математики, изучающий выск Нерентабельные салоны. Определение причин
Нерентабельные салоны. Определение причин Информационное обеспечение учебного процесса на основе портальных технологий
Информационное обеспечение учебного процесса на основе портальных технологий Портфолио. Биография
Портфолио. Биография На какую систему налогообложения перейти?
На какую систему налогообложения перейти?