Слайд 2Изучение общих закономер-ностей реакционной способ-ности биоорганических соединений является осно-вой понимания механизмов их

биологического функцио-нирования
Слайд 3Классификация химических реакций
1. По результату химического взаимодействия. Различают реакции замещения, присоединения, элиминирования,

окисления, восстановления, кислотно-основные взаимодействия, лигандообменные процессы.
2. По механизму реакции, определяемому природой активных частиц, ведущих химический процесс. Выделяют реакции электрофильного, нуклеофильного замещения и присоединения, свободнорадикальные процессы.
3. По числу молекул, принимающих участие в элементарном акте (моно-, ди-, тримолекулярные реакции).
Слайд 4В ходе биохимических и химических процессов превращению подвергается не вся молекула, а

лишь какая-либо часть (фрагмент) достаточно сложной структуры. Отсюда вытекает понятие реакционного центра.
Отдельные части молекулы могут выполнять роль реакционного центра в совершенно разных реакциях, реагировать с определенными активными частицами и реагентами.
Слайд 5Понятие реагента и субстрата
Реагентом считают соединение, из которого образуется актив-ная частица.
Субстратом называют

молеку-лу, которая превращается в хо-де химического процесса, пре-доставляя для взаимодействия атомы С, Р, N и др.
Слайд 6Реагент, который генерирует в ходе реакции электрофильные частицы (Е+), называется электрофильным.
Реагент,

который предоставляет отрицательно заряженные частицы (Nu-), называется нуклеофильным.
Активные частицы, имеющие неспа-ренные или валентные электроны, называются свободными радика-лами (R•).
Слайд 7Типы разрыва связи
Свободнорадикальные частицы образуются при гомолитическом разрыве ковалентной связи
Е •|• Y

→ E• + Y •
Электрофильные и нуклеофильные реагенты образуются при гетероли-тическом разрыве ковалентной связи
Е | •• Y → E+ + Y -
Слайд 8Природа активных частиц
Свободнорадикальные частицы (имеют неспаренный или валентный электрон)
(ОH•, Br •,Cl •,

CH3 •, RO2 •и т.д.)
Электрофильные частицы (имеют не заполненный электронный уровень)
NO2+,SO3H+,CH3+, CH3 CO+, Сl+, Br+
Нуклеофильные частицы (имеют неподеленную электронную пару на внешнем электронном уровне или являются анионом)
ОН-, OCH3, NH3, NH2-, CN- и др.
Слайд 9Классификация органических реакций
1. Реакции замещения (Substitution)
SR – радикального замещения
SЕ – электрофильного замещения
SN

– нуклеофильного замещения
2. Реакции присоединения (Addition)
АR – радикального присоединения
АЕ – электрофильного присоединения
АN – нуклеофильного присоединения
Слайд 10Классификация органических реакций
3. Реакции элиминирования (отщепления) (eliminination) (E)
4. Окислительно-восстановительные реакции (Oxidation-reduction) (реакции

эпоксидирования, гидроксилирования)
5. Кислотно-основные взаимодействия
6. Лигандообменные процессы
7. Перегруппировки
Слайд 11Реакции электрофильного присоединения
Субстратом реакций AE являются алкены, алкины, реакции протекают по реакционному

центру, представляю-щему собой кратную связь. [ Н+ ]
НООС- СН=СН- СООН + НОН ─→
Фумаровая кислота [ О ]
НООС- СН – СН2- СООН → НООС-С-СН2СООН
| ||
ОН О
Яблочная кислота Щавелевоуксусная
Слайд 12Пример реакции АЕ
СООН [ Н+ ]
НООС-СН2 –С=СН-СООН + НОН ─→
Цис-аконитовая кислота
СООН
![Пример реакции АЕ СООН [ Н+ ] НООС-СН2 –С=СН-СООН + НОН ─→](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/278931/slide-11.jpg)
НООС-СН2 – CH - СН-СООН
ОН
Изолимонная кислота
Слайд 13Пример реакции АЕ
СН3-(СН2)7 -СН=СН- (СН2)7-СООН + Br2 →
Олеиновая кислота
СН3-(СН2)7 -СН─СН- (СН2)7-СООН
|

|
Br Br
Слайд 14Механизм реакций АЕ
Образование электрофильной частицы
HOBr → OH- + Br+ (E+)
2. Образование пи-комплекса
СН2=СН2
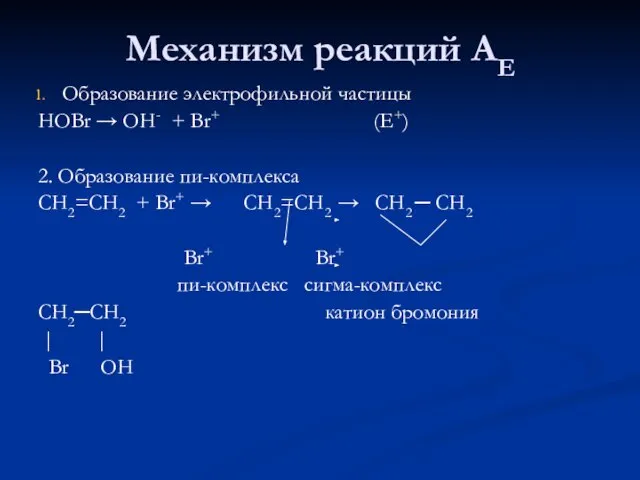
+ Br+ → СН2=СН2 → СН2 ─ СН2
Br+ Br+
пи-комплекс сигма-комплекс
СН2─СН2 катион бромония
| |
Br OH
Слайд 15Механизм реакций АЕ
Реакция бромирования
2. Образование пи-комплекса
СН2=СН2 + Br2 (Br+-Br-) → СН2=СН2
Br+-Br-
пи-комплекс
→

СН2 ─ СН2 + Br- → СН2─СН2
Br+ | |
сигма-комплекс - Br Br
катион бромония 1,2-дибромэтан
Слайд 16Реакция гидратации алкенов
(с водой)
Является наиболее важной в медико-биологическом отношении. Реакция проходит в

присутствии минеральных кислот Н2SO4, H3PO4, присутствующих в организме НОН
СН2=СН2 + Н+ →СН3-СН2+
карбкатион
+
СН3-СН2-О-Н → СН3-СН2-ОН
Н -Н+ (возврат катализатора)
Слайд 17Правило Марковникова
Нессиметричные алкены.
Реакция гидрогалогенирования, гидратации протекает таким образом, что протон присоединяется

к наиболее гидрированному атому углерода.
Акролеин. Реакция протекает против правила Марковникова, что связано с мезомерным эффектом карбонильной группы
Слайд 18Скорость и направление реакций АЕ
Определяется двумя факторами: статическим и динамическим. Статический фактор

связан с электронным эффектом заместителей, а динамический – с устойчивостью образующихся карбокатионов.
СН2=С-СН3> СН3- СН=СН-СН3> СН2=С-СН3
СН3
СН2=СН2
Электронодоноры увеличивают, а электроно- акцепторы уменьшают стабильность карбкатионов (сигма – комплексов)
-СН3, -СН2-СН3; (электронодоноры)
+
-СООН; -СF3; -NO2; -С≡N; -N(CH3)3 (электроноакцепторы)
Слайд 19Особенности присоединения к сопряженным диенам
Реакция идет по двум направлениям (1-2 и 1,4

присоединение), что связано с эффектом сопряжения в этих структурах.
СН2=СН-СН=СН2 + НBr →
СН2 - СН-СН=СН2 + СН2 – СН=СН - СН2
| | | |
Br Br Br Br
3,4-дибром-бутен-1 1,4-дибром-бутен-2
(20%) (80%)
Слайд 20Реакции электрофильного замещения (SE)
Реакция образования электрофильной частицы
1.1 Реакция алкилирования
СН3Сl + AlCl3

→ CH3+ + AlCl4-
1.2 Реакция ацилирования
СН3СOCl + AlCl3 → CH3CO+ + AlCl4-
1.3 Реакция нитрования
НNO3+2 H2SO4→ NO2+ + H3O+ + 2 HSO3-
1.4 Реакция сульфирования
Н2SO4 → HSO3+ + OH-
3










![Пример реакции АЕ СООН [ Н+ ] НООС-СН2 –С=СН-СООН + НОН ─→](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/278931/slide-11.jpg)








 как автомобиль появился в нашей жизни (старшая группа)
как автомобиль появился в нашей жизни (старшая группа) Жизнь или студёный ад – определяет Высшая Сила по произведению Александра Костюнина «Колежма»
Жизнь или студёный ад – определяет Высшая Сила по произведению Александра Костюнина «Колежма» Прием заявлений в школу в электронном виде
Прием заявлений в школу в электронном виде Презентация на тему Броуновское движение. Строение вещества (10 класс)
Презентация на тему Броуновское движение. Строение вещества (10 класс) ВКР: Особенности развития нагляднообразного мышления детей 3-4 летнего возраста
ВКР: Особенности развития нагляднообразного мышления детей 3-4 летнего возраста Эмбриональный период развития
Эмбриональный период развития Лекарственный отдел
Лекарственный отдел Выполнение сердечно-легочной реанимации (СЛР)
Выполнение сердечно-легочной реанимации (СЛР) СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ЭФФЕКТИВНОСТИ ГУМИНОВЫХ УДОБРЕНИЙ РАЗЛИЧНОЙ ПРИРОДЫ
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ЭФФЕКТИВНОСТИ ГУМИНОВЫХ УДОБРЕНИЙ РАЗЛИЧНОЙ ПРИРОДЫ Финансовая документация
Финансовая документация Биометрические технологии
Биометрические технологии  Автономные радионавигационные системы летательных аппаратов. Радиовысотомер
Автономные радионавигационные системы летательных аппаратов. Радиовысотомер General Livestock Feeding
General Livestock Feeding  Формирование письменных коммуникативных компетентностей на уроках русского языка в начальной школе
Формирование письменных коммуникативных компетентностей на уроках русского языка в начальной школе История денежных средств
История денежных средств Сергей Есенин (1895 – 1926)
Сергей Есенин (1895 – 1926) Симфония расчета И мечты
Симфония расчета И мечты 1 планируемые и достигаемые результаты ресурсы и условия организация и содержание К результатам освоения основных образовательны
1 планируемые и достигаемые результаты ресурсы и условия организация и содержание К результатам освоения основных образовательны Степенная функция
Степенная функция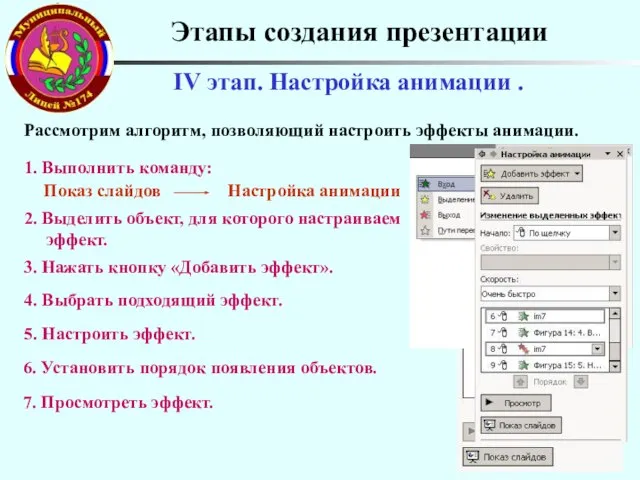 Этапы создания презентации
Этапы создания презентации Путешествие из Петербурга в Москву
Путешествие из Петербурга в Москву Количество вещества
Количество вещества Карта деловых поездок АТЭС, APEC business travel card, ABTC
Карта деловых поездок АТЭС, APEC business travel card, ABTC Автор презентации: Семёнова Ольга Юрьевна
Автор презентации: Семёнова Ольга Юрьевна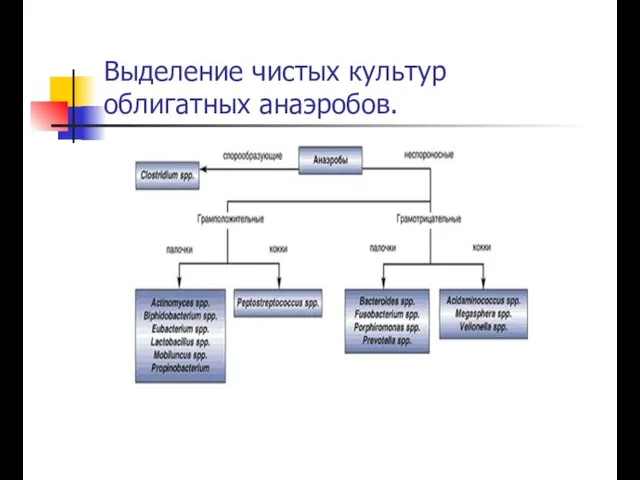 Выделение чистых культур облигатных анаэробов.
Выделение чистых культур облигатных анаэробов. Shopping in London
Shopping in London Разработка и создание интернет – проектов, Объявления, Работа, Продвижение.
Разработка и создание интернет – проектов, Объявления, Работа, Продвижение. Презентация на тему Пропорциональность величин (6 класс)
Презентация на тему Пропорциональность величин (6 класс)