Презентация на тему: Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода)
Содержание
- 2. Строение атома
- 3. КИСЛОРОД Кислород O2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.) Самый распространенный элемент на Земле;
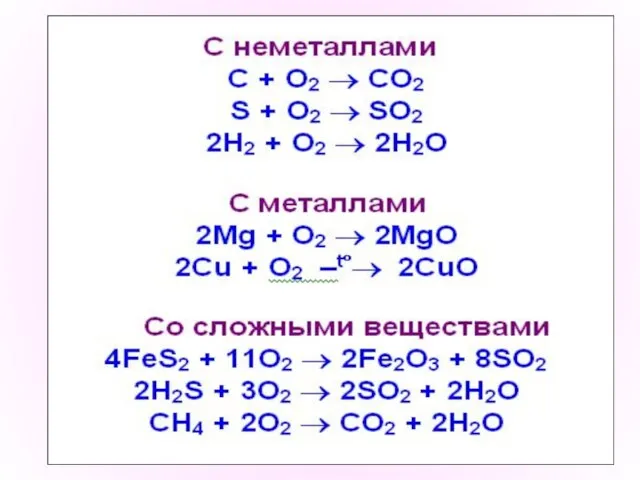
- 4. Химические свойства О2 Взаимодействие веществ с кислородом называется окислением. С кислородом реагируют все элементы, кроме Au,
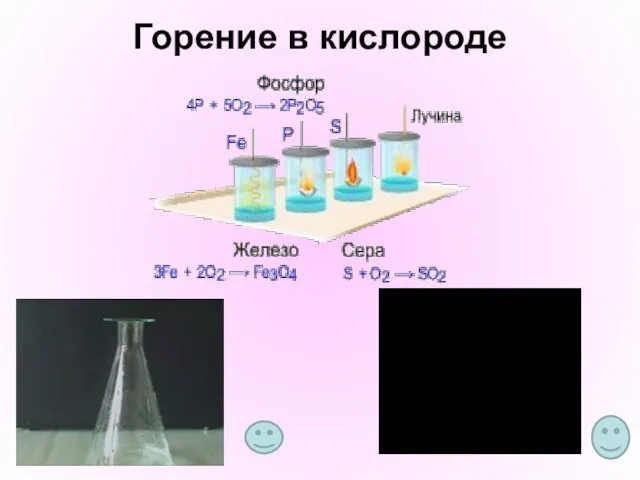
- 6. Горение в кислороде
- 7. СЕРА S Физические свойства - Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается
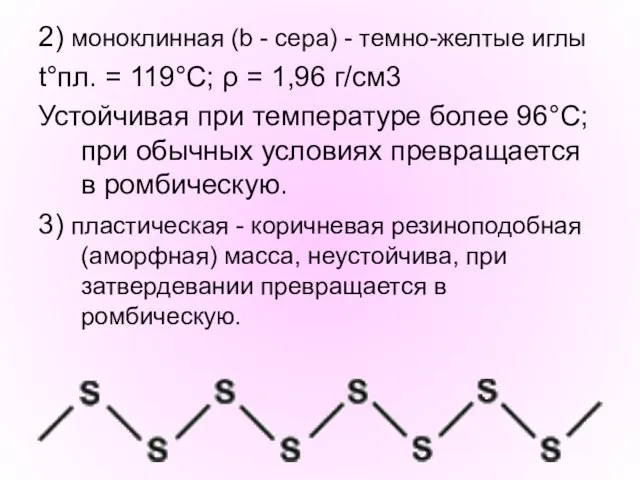
- 8. 2) моноклинная (b - сера) - темно-желтые иглы t°пл. = 119°C; ρ = 1,96 г/см3 Устойчивая
- 9. Химические свойства
- 11. Соединения серы Сероводород и сульфиды H2S Оксид серы (IV) SO2 Сернистая кислота H2SO3 Сульфиты и гидросульфиты
- 12. Серная кислота и ее соли H2SO4
- 14. Техника безопасности при работе с серной кислотой Правила ТБ при работе с кислотами Правила разбавления серной
- 15. Свойства разбавленной серной кислоты Серная кислота – сильный электролит, поэтому хорошо диссоциирует в воде на ионы
- 16. Свойства разбавленной серной кислоты С Металлами до Н С основными оксидами С растворимыми основаниями С нерастворимыми
- 18. Скачать презентацию












 Facebook
Facebook Клуб сравнительного правоведения MGIMO
Клуб сравнительного правоведения MGIMO Усроиство компьютера
Усроиство компьютера Презентация на тему Ознакомление с окружающим миром: зимующие птицы нашего края
Презентация на тему Ознакомление с окружающим миром: зимующие птицы нашего края  11 класс-это МЫ
11 класс-это МЫ Этнос: нации и народности
Этнос: нации и народности  Счастье
Счастье «Я – учитель Нашей новой школы»
«Я – учитель Нашей новой школы» День России
День России Райх. Вегетотерапия и телесный анализ
Райх. Вегетотерапия и телесный анализ архитектура пк
архитектура пк Фальсификации науки и конспирология
Фальсификации науки и конспирология Если случится беда…
Если случится беда… Страхование в предпринимательстве
Страхование в предпринимательстве Презентация на тему Тайна Бермудского треугольника
Презентация на тему Тайна Бермудского треугольника Коктейль Кровавая Мэри
Коктейль Кровавая Мэри Менеджмент разработки программных изделий (руководство командой и управление проектом)Скопин И.Н.
Менеджмент разработки программных изделий (руководство командой и управление проектом)Скопин И.Н. Презентация на тему Сохранить планету для людей
Презентация на тему Сохранить планету для людей  Второй фотокросс
Второй фотокросс WAZ Mediengruppe – один из лидеров издательского бизнеса в Германии, работающий в девяти странах Европы, развивающий медиа- бизнес в Росси
WAZ Mediengruppe – один из лидеров издательского бизнеса в Германии, работающий в девяти странах Европы, развивающий медиа- бизнес в Росси Huawei P30 lite vs Samsung А50
Huawei P30 lite vs Samsung А50 Презентация на тему Отношения и пропорции 6 класс
Презентация на тему Отношения и пропорции 6 класс  Время остановить нельзя, а измерить?
Время остановить нельзя, а измерить? Советская лунная программа
Советская лунная программа Катализ
Катализ Презентация на тему Песнь о вещем Олеге
Презентация на тему Песнь о вещем Олеге  Мировая история Баллов
Мировая история Баллов Специальная (коррекционная) общеобразовательная школаVIII вида № 107 e-mail:
Специальная (коррекционная) общеобразовательная школаVIII вида № 107 e-mail: