Содержание
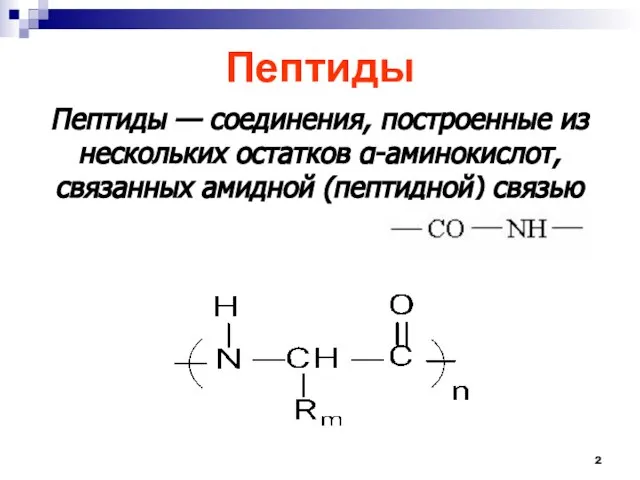
- 2. Пептиды Пептиды — соединения, построенные из нескольких остатков -аминокислот, связанных амидной (пептидной) связью
- 3. (греч. Πεπτος, peptós — сваренный, переваренный, питательный). Термин «пептиды» был предложен известным химиком Эмилем Фишером. Слово
- 4. Классификация пептидов. В зависимости от числа аминокислотных остатков различают ди-, три-, тетра-, пента- и тому подобные
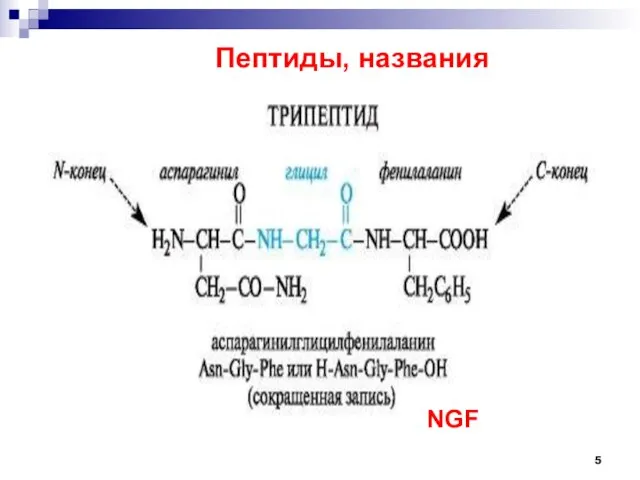
- 5. Пептиды, названия NGF
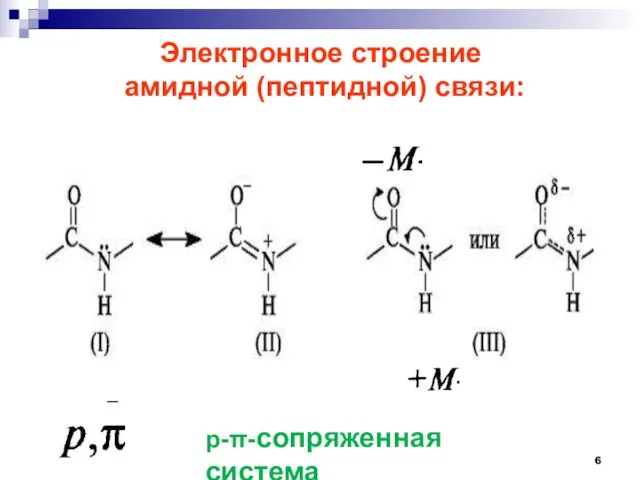
- 6. Электронное строение амидной (пептидной) связи: р--сопряженная система
- 7. ЭЛЕКТРОННОЕ И ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПЕПТИДНОЙ СВЯЗИ. р--сопряженная система барьер вращения Составляет 63-84 кДж/моль (С=О 0,121 нм)
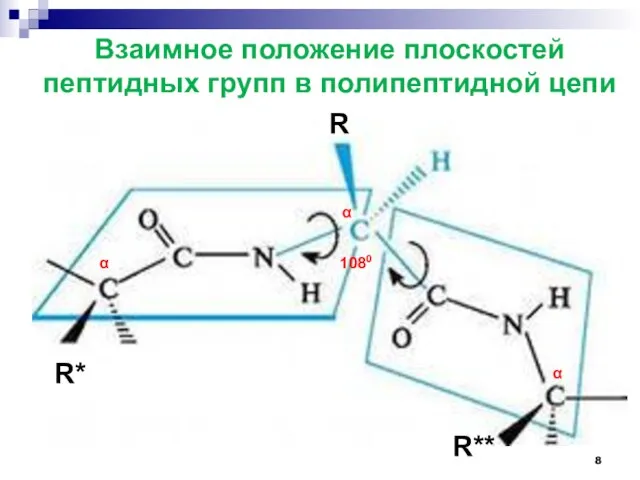
- 8. Взаимное положение плоскостей пептидных групп в полипептидной цепи α α α R R* R** 1080
- 9. Основные функции пептидов: регуляторная (рилизинг-факторы или либерины, нейромедиаторы); гормональная (окситоцин, вазопрессин, брадикинин, гастрин и др.); антибиотическая
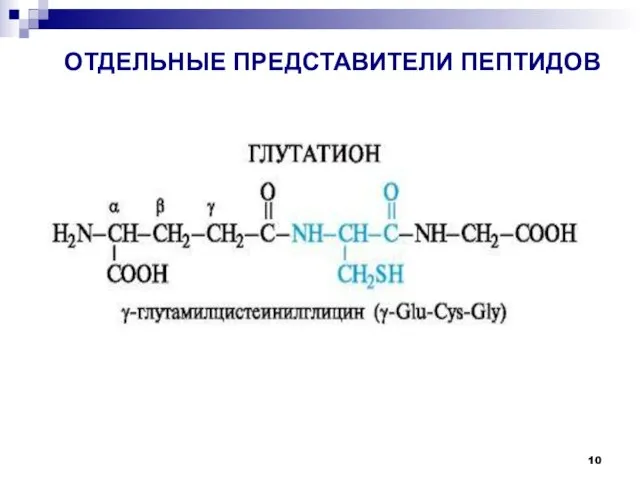
- 10. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПЕПТИДОВ
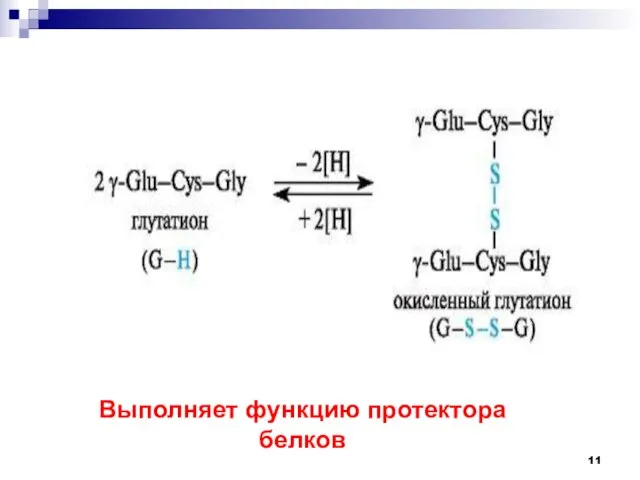
- 11. Выполняет функцию протектора белков
- 12. Тафтсин Селанк — (Thr-Lys-Pro-Arg-Pro-Gly-Pro, лекарственный препарат, обладающий наиболее выраженной анксиолитической активностью (противотревожным действием).
- 13. Селанк – первый в мире пептидный анксиолитик с уникальным сочетанием психотропной активности: антидепрессивной, антиастенической и ноотропной
- 14. Нейропептиды (опиатные пептиды). пептиды, содержащиеся в головном мозге. 1975 г. TyrGlyGlyPheMet метионин-энкефалин TyrGlyGlyPheLeu лейцин-энкефалин Эти пептиды
- 15. Вазопрессин (от лат. vas – cocyд и presso – давлю), гормон, выделяемый задней долей гипофиза,вызывает сужение
- 16. Окситоцин (1954) вызывает сокращение гладких мышц матки и в меньшей степени — мышц мочевого пузыря и
- 17. Даларгин - синтетический аналог энкефалинов,биологически активных веществ из класса эндогенных опиоидных пептидов, оказывающих влияние практически на
- 18. Применяется Даларгин при обострении язвенной болезни желудка и двенадцатиперстной кишки, ускоряет заживление язвы; панкреатите, панкреанекрозе. а
- 19. Семакс. гептапептид метионил-глутамил-гистидил-фенилаланил-пролил-глицил-пролин, MetGluHisPheProGlyPro , — лекарственное средство, оказывающее ноотропное и нейропротективное действие
- 20. Пептид АКТГ4-10 («Семакс») обладает нейроспецифическим эффектом в отношении ЦНС, влияет на процессы, связанные с формированием памяти
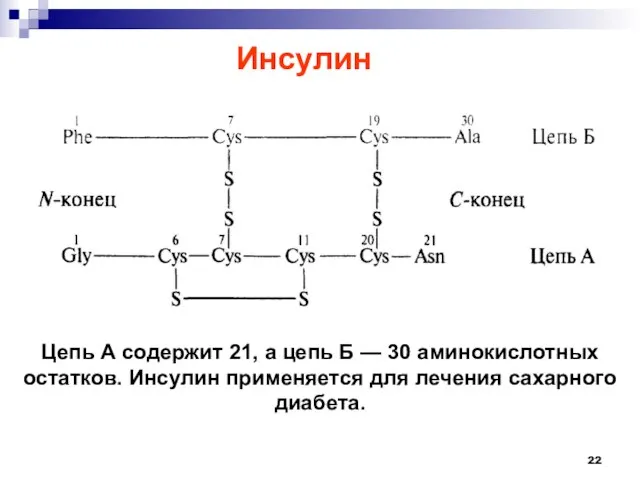
- 21. Инсулин (от лат. insula — остров) — гормон, ответственный за контроль метаболизма углеводов, жиров и белков,
- 22. Цепь А содержит 21, а цепь Б — 30 аминокислотных остатков. Инсулин применяется для лечения сахарного
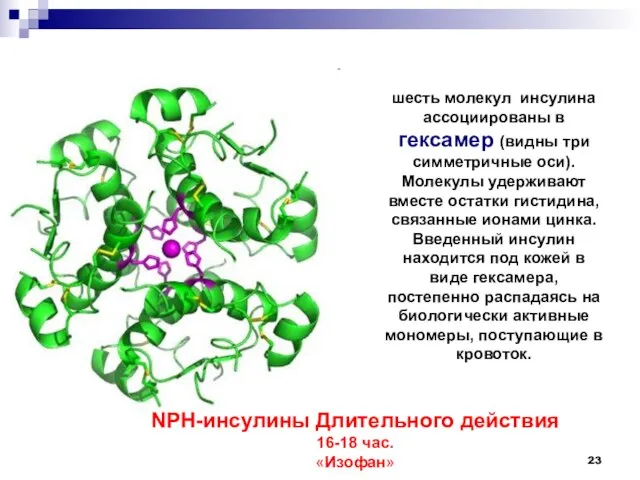
- 23. шесть молекул инсулина ассоциированы в гексамер (видны три симметричные оси). Молекулы удерживают вместе остатки гистидина, связанные
- 24. Биолан комплекс веществ пептидной группы, природных нейропротекторных аминокислот и пептидов, оптимально сбалансированных и необходимых для нормального
- 25. при стрессе и заболеваниях нервной системы; при хронической усталости, депрессии, раздражительности, бессоннице; в экстремальных ситуациях; для
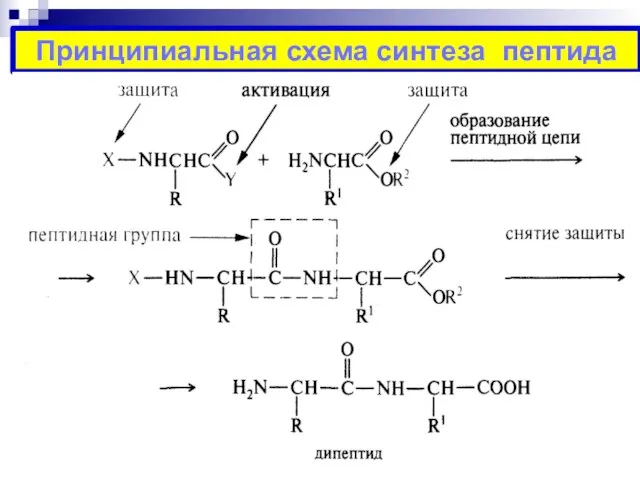
- 26. Принципиальная схема синтеза пептида
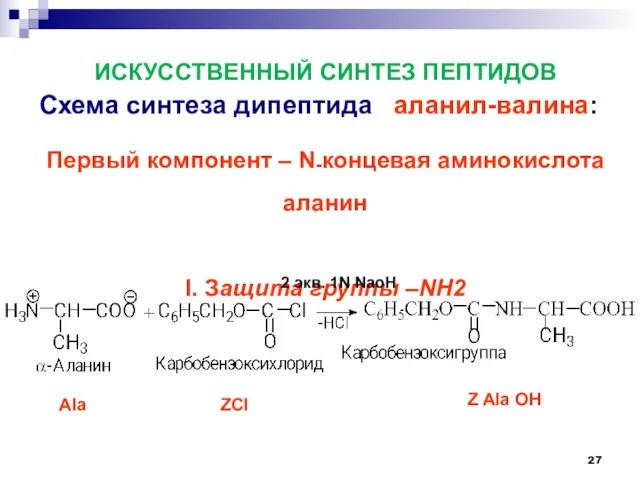
- 27. ИСКУССТВЕННЫЙ СИНТЕЗ ПЕПТИДОВ Схема синтеза дипептида аланил-валина: Первый компонент – N-концевая аминокислота аланин I. Защита группы
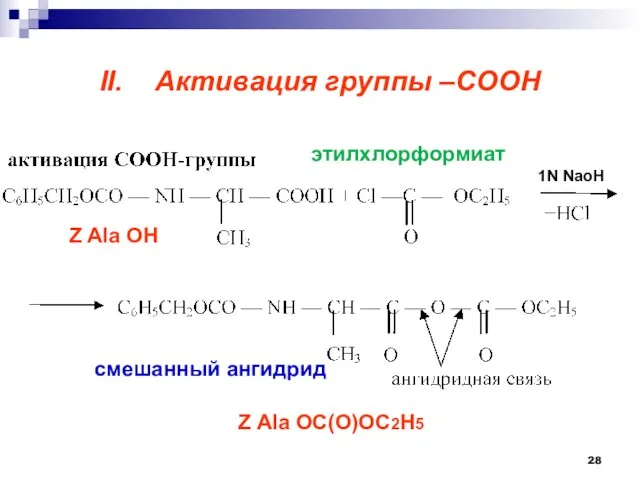
- 28. II. Активация группы –СООН этилхлорформиат Z Ala OH Z Ala OC(O)OC2H5 1N NaoH смешанный ангидрид
- 29. Второй компонент – С-концевая аминокислота валин III. Защита группы –СООН Val Val OEt 1 экв.1N NaOH
- 30. IV. Образование амидной связи Z Ala OC(O)OC2H5 O Val OEt Z Ala Val OEt
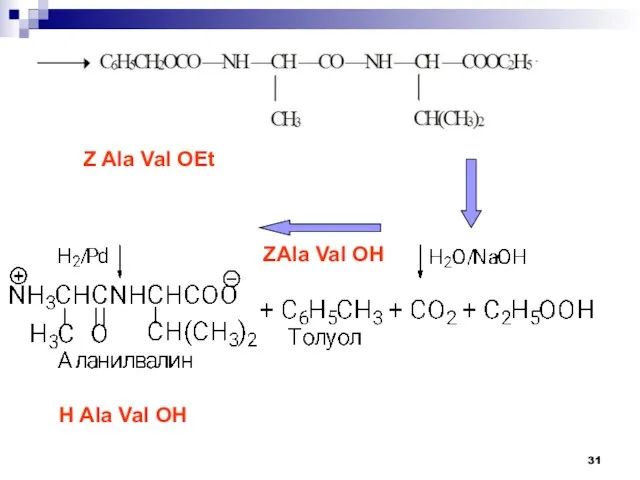
- 31. Z Ala Val OEt ZAla Val OH H Ala Val OH
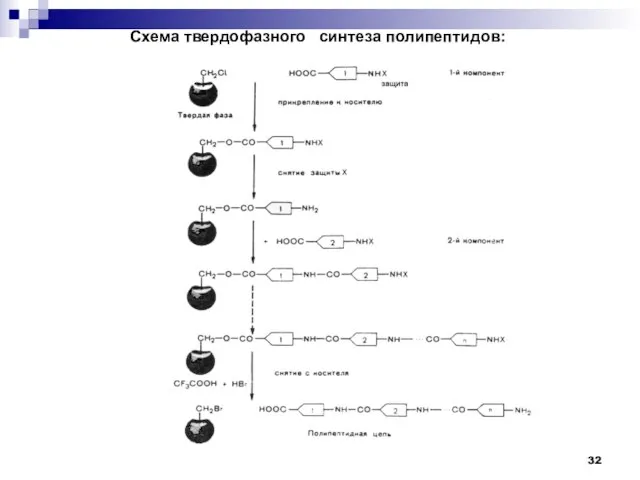
- 32. Схема твердофазного синтеза полипептидов:
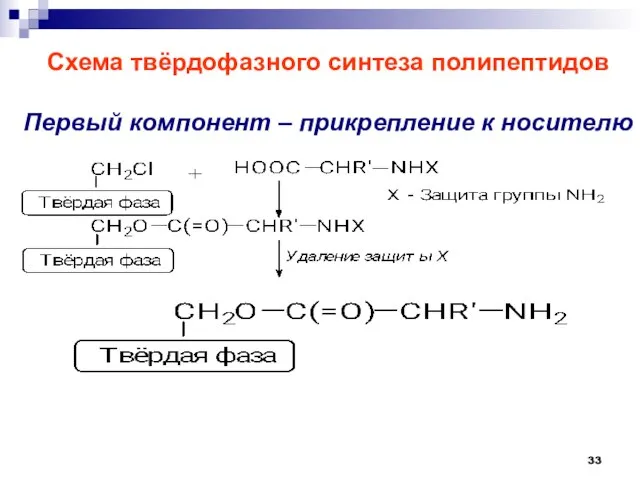
- 33. Схема твёрдофазного синтеза полипептидов Первый компонент – прикрепление к носителю
- 34. Второй компонент (и дальнейшее наращивание цепи) Снятие с носителя
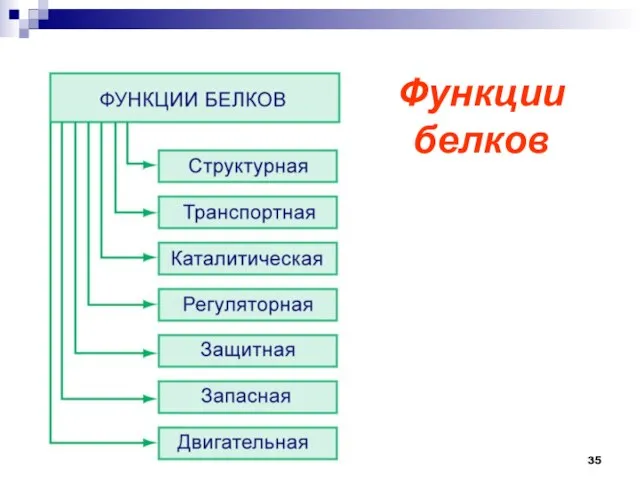
- 35. Функции белков
- 36. Строительная (пластическая) – белки участвуют в образовании оболочки клетки, органоидов и мембран клетки. Каталитическая – все
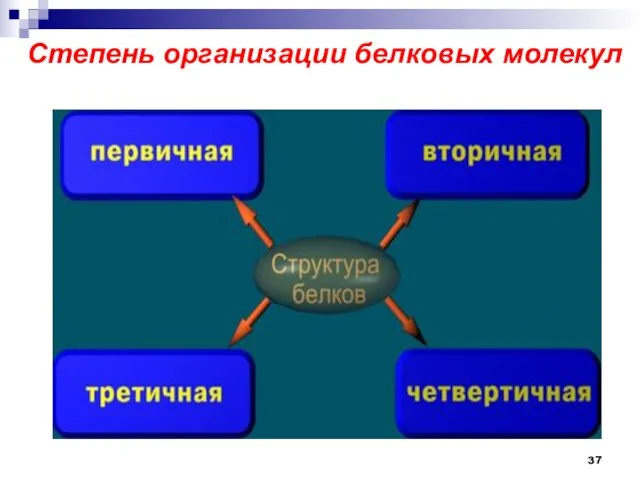
- 37. Степень организации белковых молекул
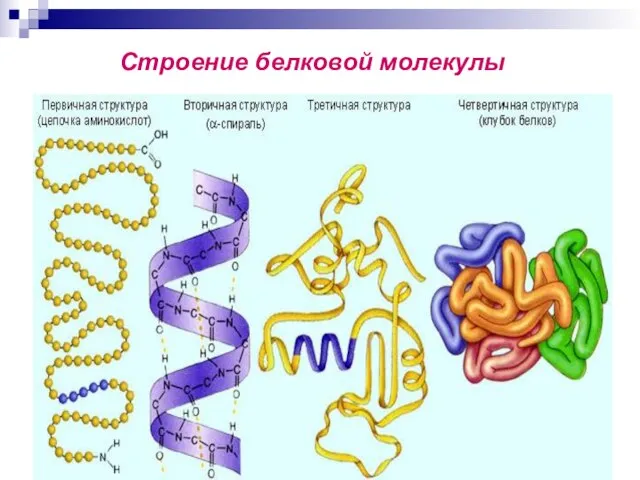
- 38. Первичная структура пептидов и белков. Аминокислотный состав пептидов и белков - это природа и количественное соотношение
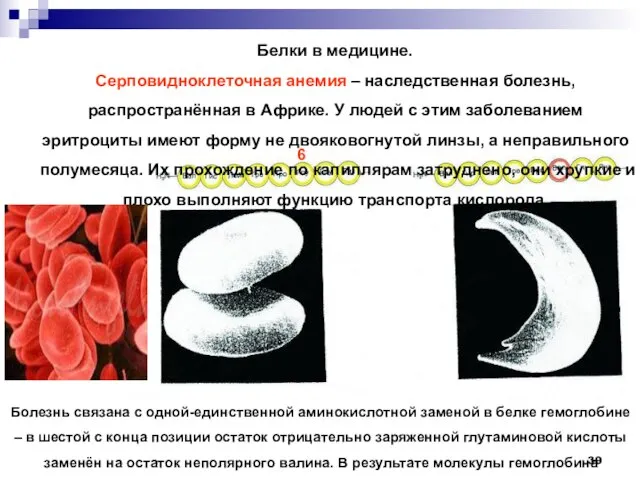
- 39. Белки в медицине. Серповидноклеточная анемия – наследственная болезнь, распространённая в Африке. У людей с этим заболеванием
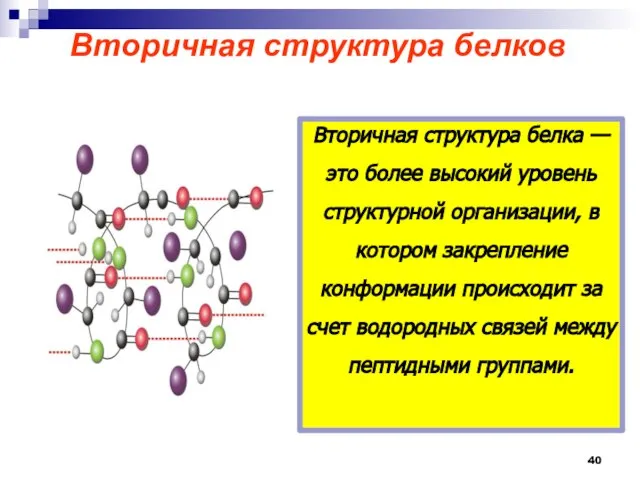
- 40. Вторичная структура белков Вторичная структура белка — это более высокий уровень структурной организации, в котором закрепление
- 41. Лайнус Карл Полинг 1901—1994 выдающийся американский химик и физик, общественный деятель. Нобелевская премия по химии (1954),
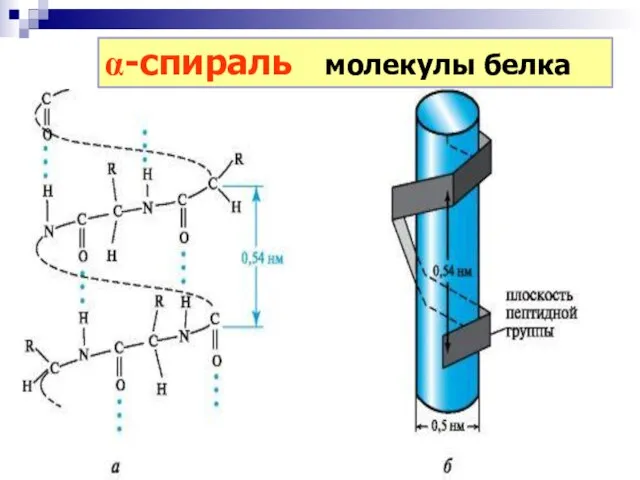
- 42. a-спираль молекулы белка
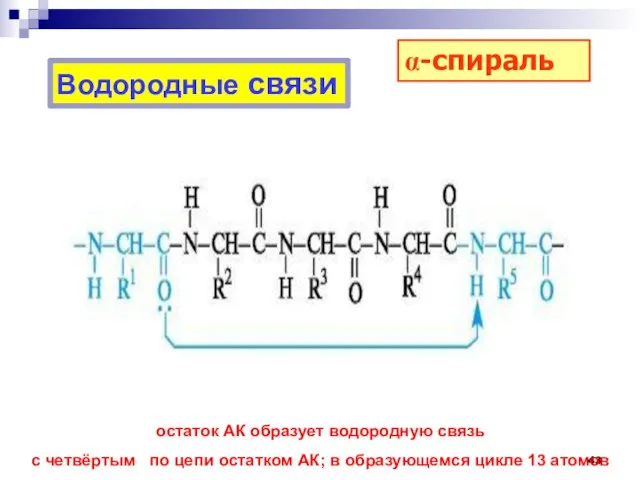
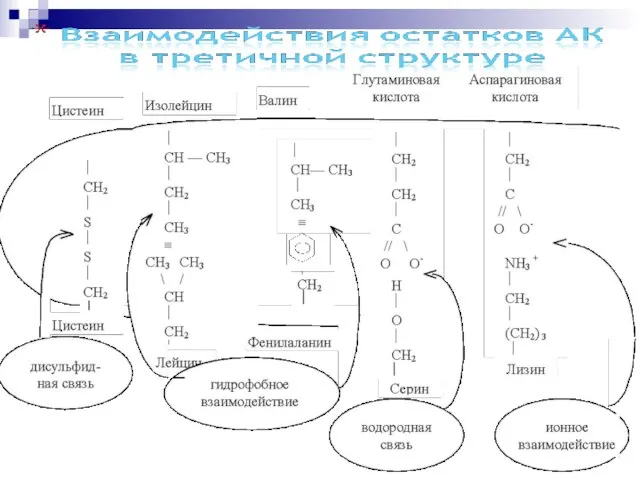
- 43. Водородные связи остаток АК образует водородную связь с четвёртым по цепи остатком АК; в образующемся цикле
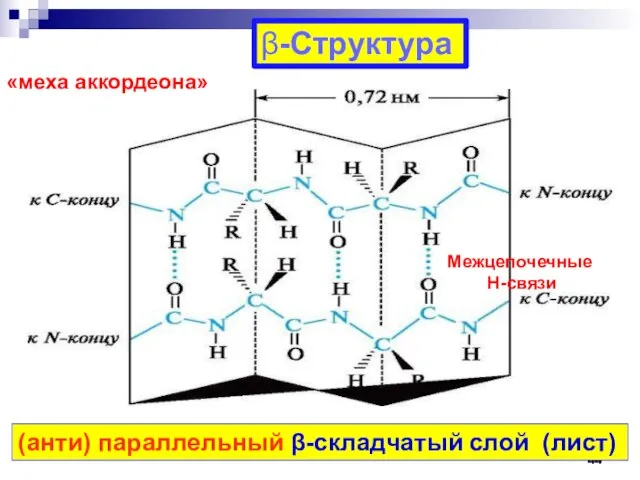
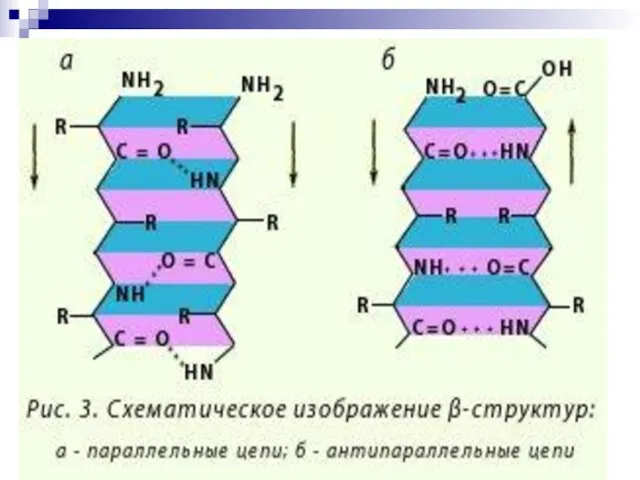
- 44. -Структура (анти) параллельный -складчатый слой (лист) «меха аккордеона» Межцепочечные Н-связи
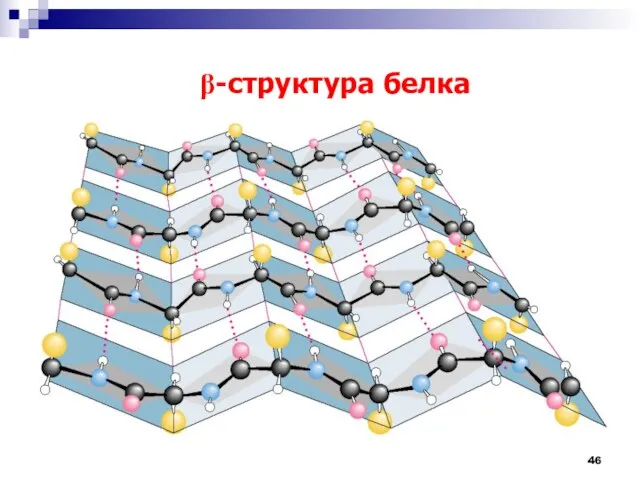
- 46. b-структура белка
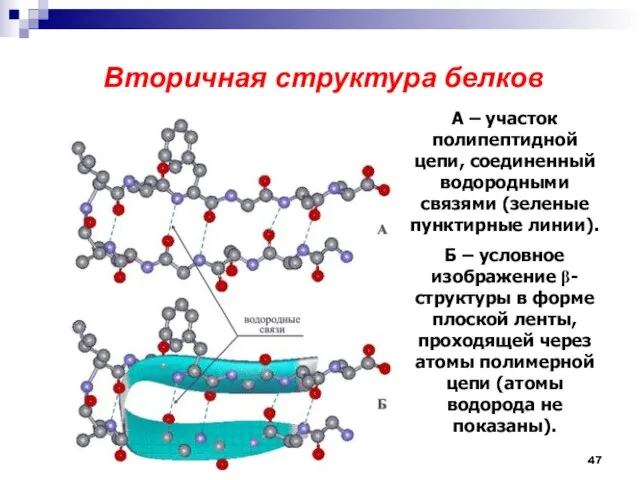
- 47. Вторичная структура белков А – участок полипептидной цепи, соединенный водородными связями (зеленые пунктирные линии). Б –
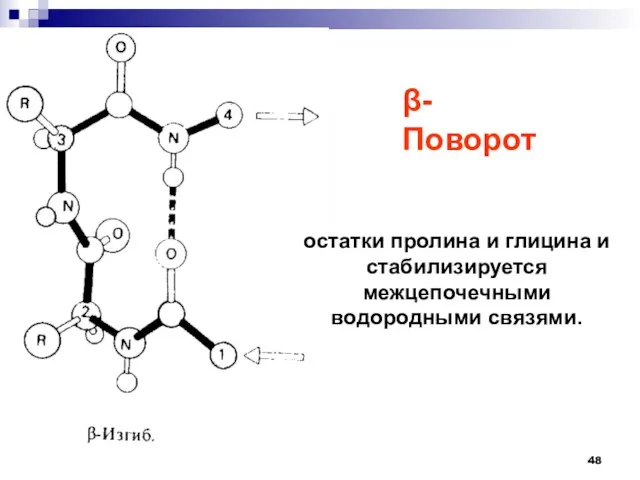
- 48. остатки пролина и глицина и стабилизируется межцепочечными водородными связями. -Поворот
- 49. Домены – глобулярные области в пределах одной белковой молекулы Домены соединены шарнирным участком Доменная структура NAD+-зависимой
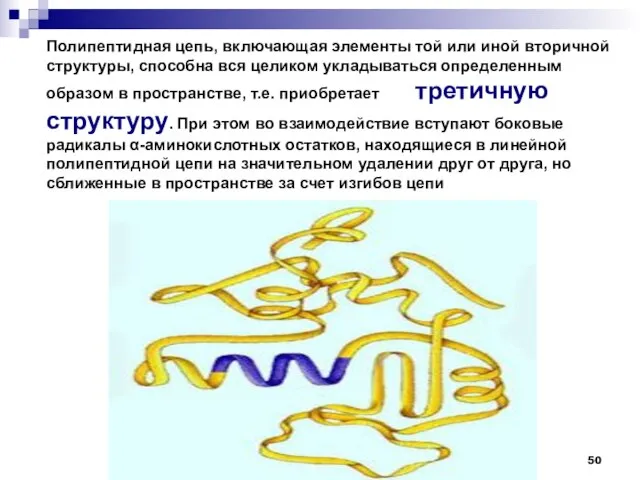
- 50. Полипептидная цепь, включающая элементы той или иной вторичной структуры, способна вся целиком укладываться определенным образом в
- 51. молекула приобретает форму компактного клубка – глобулярные белки (globules, лат. шарик, эллипсоид вращения), мало Н-связей, растворимы
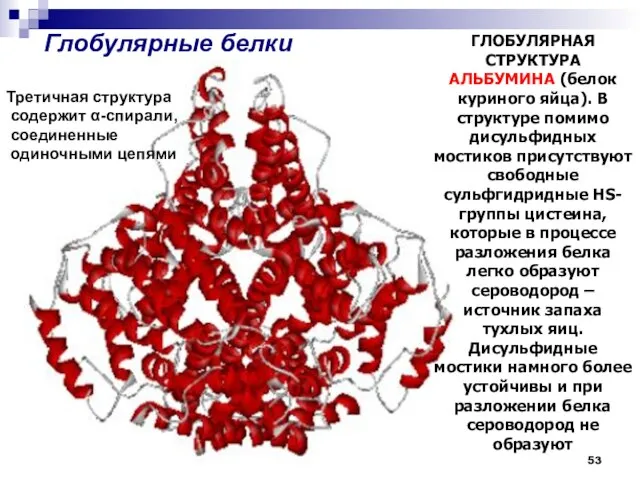
- 53. Глобулярные белки ГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА (белок куриного яйца). В структуре помимо дисульфидных мостиков присутствуют свободные сульфгидридные
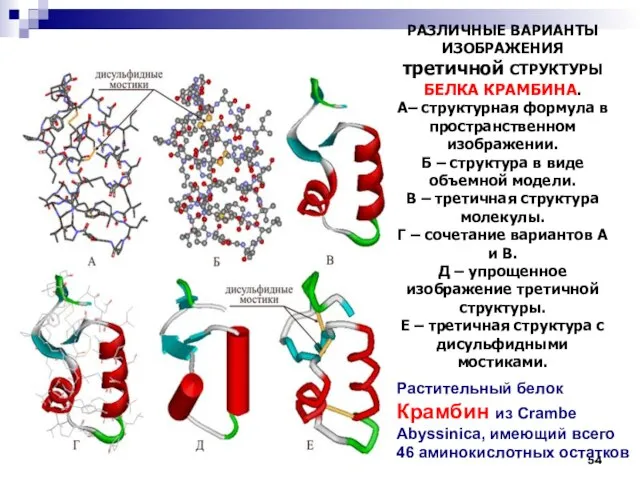
- 54. РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ третичной СТРУКТУРЫ БЕЛКА КРАМБИНА. А– структурная формула в пространственном изображении. Б – структура
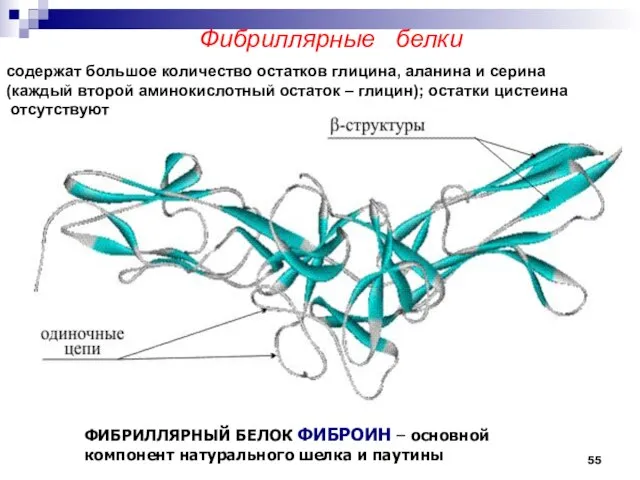
- 55. Фибриллярные белки ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН – основной компонент натурального шелка и паутины содержат большое количество остатков
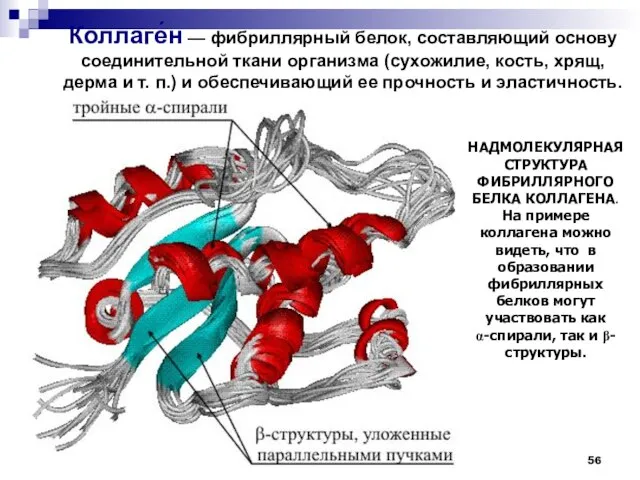
- 56. НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА. На примере коллагена можно видеть, что в образовании фибриллярных белков могут
- 57. Молекула коллагена представляет собой правозакрученную спираль из 3 α-цепей (тропоколлаген). Один виток спирали α-цепи содержит три
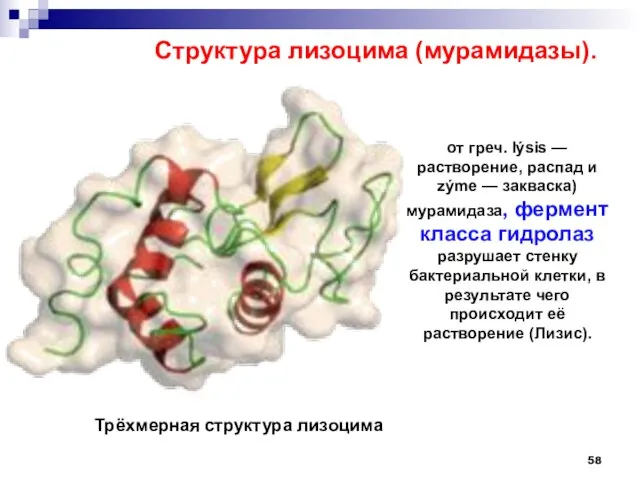
- 58. от греч. lýsis — растворение, распад и zýme — закваска) мурамидаза, фермент класса гидролаз разрушает стенку
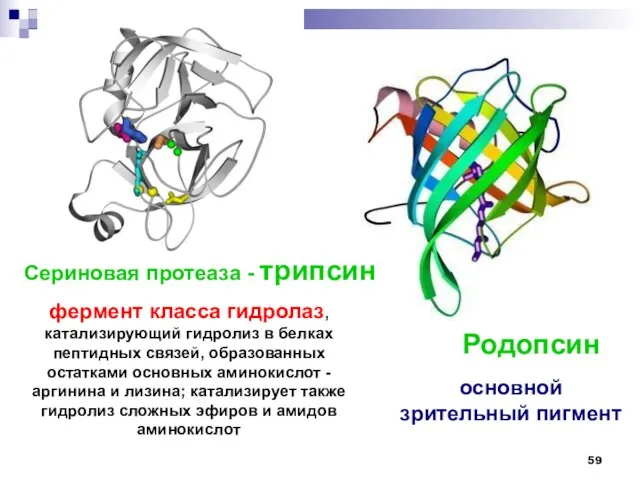
- 59. Сериновая протеаза - трипсин Родопсин фермент класса гидролаз, катализирующий гидролиз в белках пептидных связей, образованных остатками
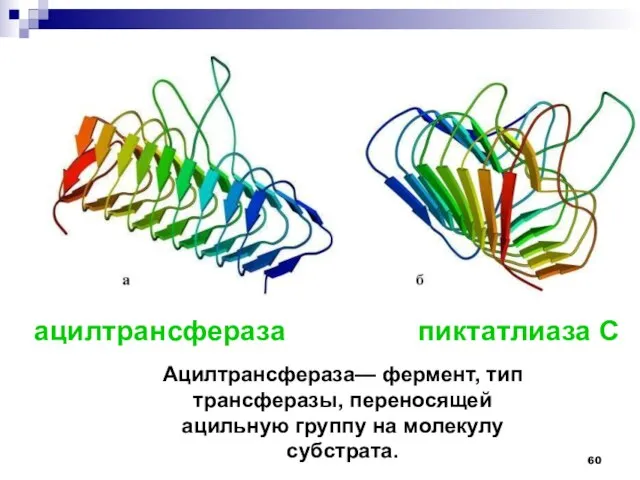
- 60. ацилтрансфераза пиктатлиаза С Ацилтрансфераза— фермент, тип трансферазы, переносящей ацильную группу на молекулу субстрата.
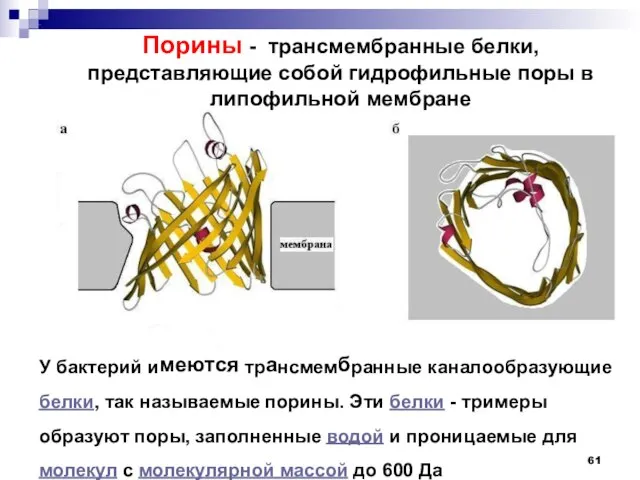
- 61. У бактерий имеются трансмембранные каналообразующие белки, так называемые порины. Эти белки - тримеры образуют поры, заполненные
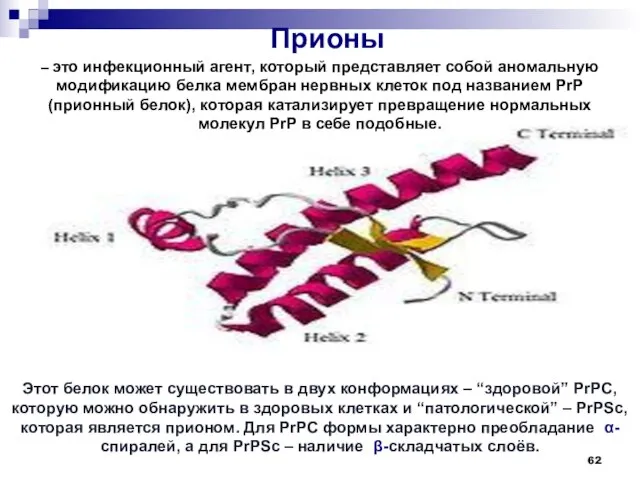
- 62. Этот белок может существовать в двух конформациях – “здоровой” PrPC, которую можно обнаружить в здоровых клетках
- 63. Губчатые энцефалопатии * Синдром Крейцфельда-Якоба * синдром Герсманна–Штройслера–Шейнкера * хроническая семейная бессонница, * болезнь куру (связана
- 64. Проявляется болезнь медленно прогрессирующими нарушениями памяти и мыслительных функций (деменцией), которые в итоге приводят к смерти.
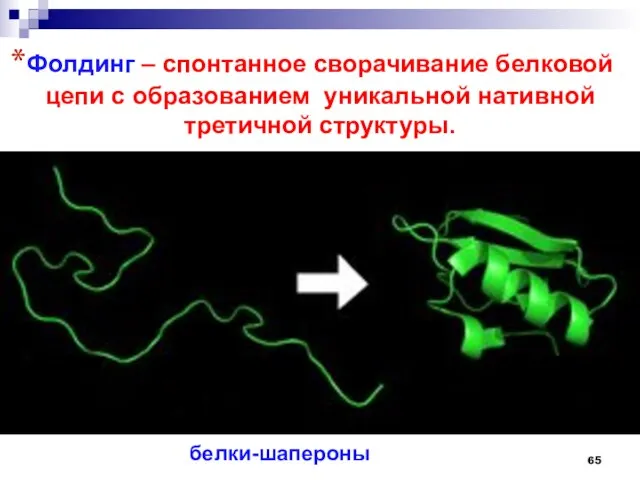
- 65. Фолдинг – спонтанное сворачивание белковой цепи с образованием уникальной нативной третичной структуры. белки-шапероны
- 66. Под четвертичной структурой подразумевают способ укладки в пространстве отдельных полипептидных цепей (одинаковых или разных) с третичной
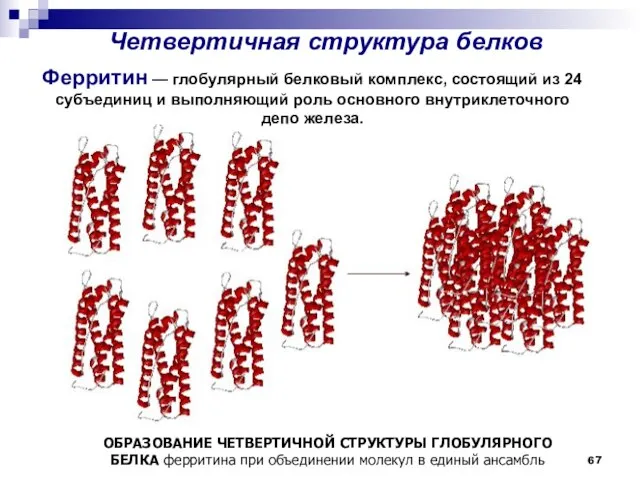
- 67. Четвертичная структура белков ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ ГЛОБУЛЯРНОГО БЕЛКА ферритина при объединении молекул в единый ансамбль Ферритин
- 68. Пример четвертичной структуры - вирус табачной мозаики: 2130 одинаковых молекул белка расположены вокруг РНК вируса Капсид
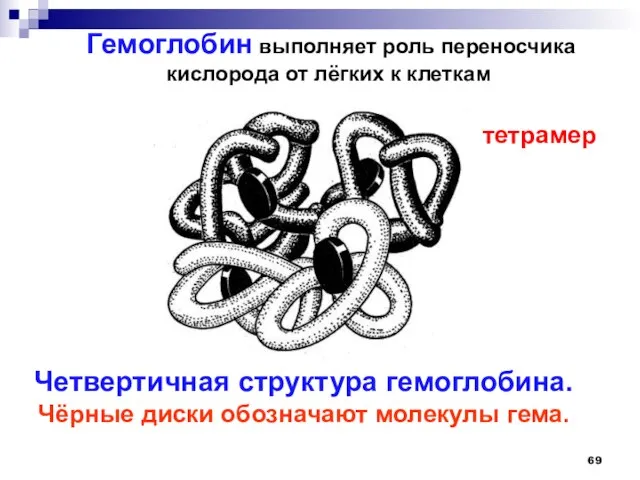
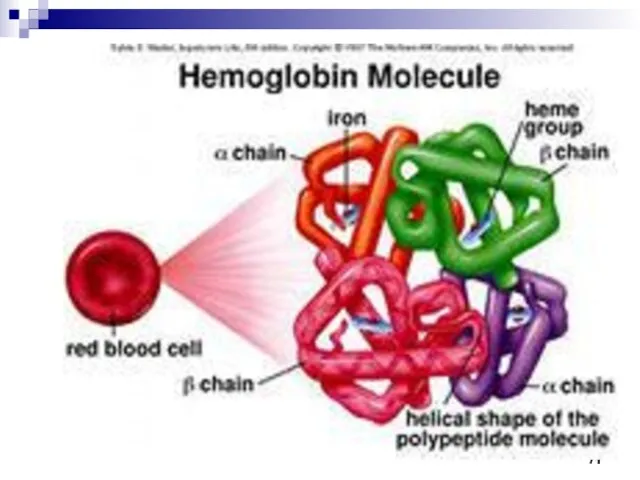
- 69. Гемоглобин выполняет роль переносчика кислорода от лёгких к клеткам Четвертичная структура гемоглобина. Чёрные диски обозначают молекулы
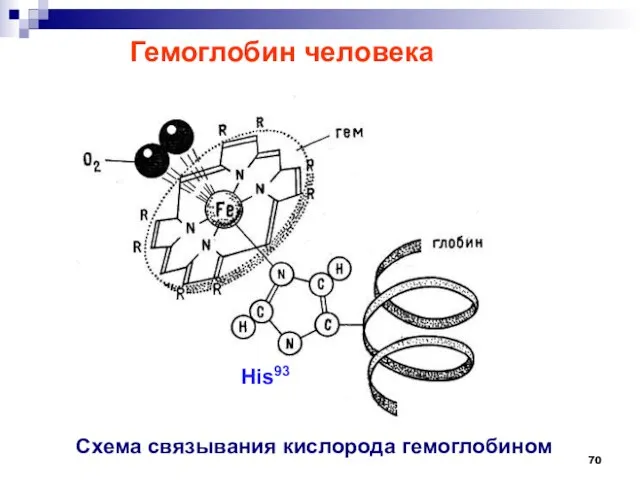
- 70. Гемоглобин человека Схема связывания кислорода гемоглобином His93
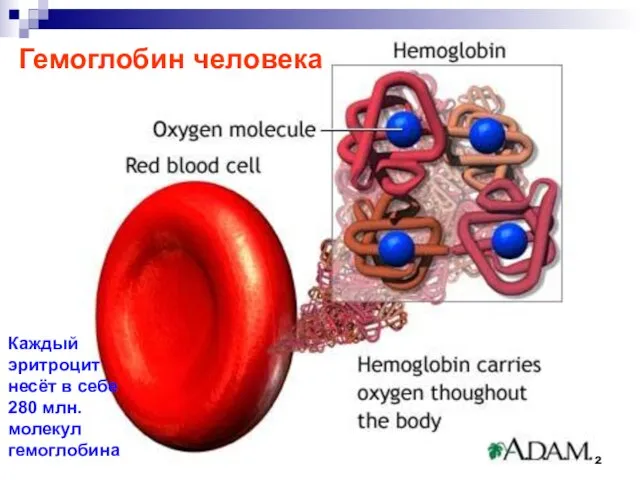
- 72. Гемоглобин человека Каждый эритроцит несёт в себе 280 млн. молекул гемоглобина
- 73. Строение белковой молекулы
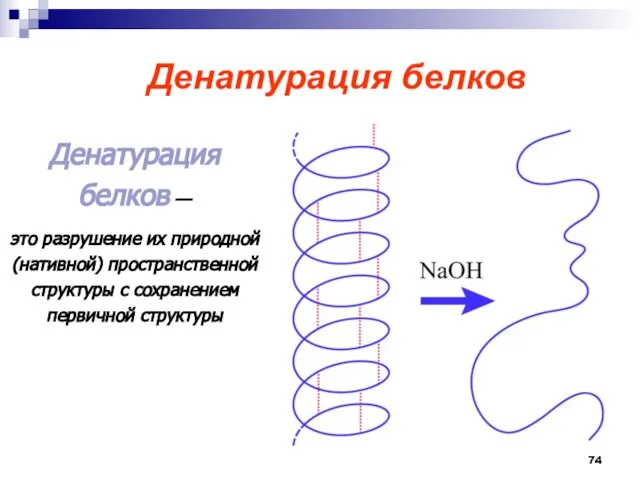
- 74. Денатурация белков Денатурация белков — это разрушение их природной (нативной) пространственной структуры с сохранением первичной структуры
- 75. Денатурированный белок теряет свои биологические свойства.
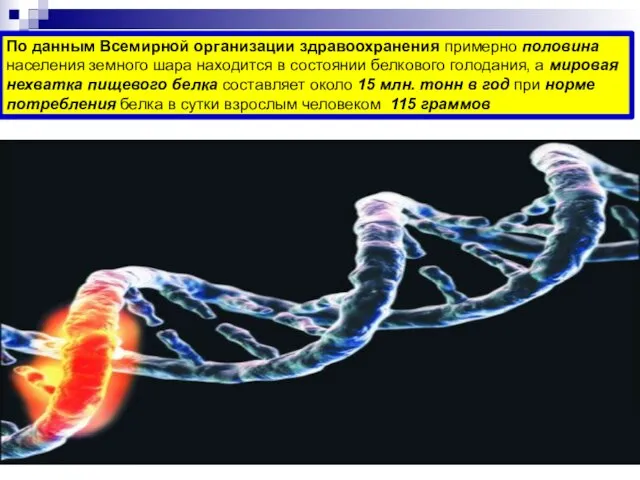
- 76. По данным Всемирной организации здравоохранения примерно половина населения земного шара находится в состоянии белкового голодания, а
- 77. Цветные реакции на белки 1. Ксантопротеиновая – взаимодействие с концентрированной азотной кислотой, которое сопровождается появлением желтой
- 79. Скачать презентацию





























 Немецкий киноэкспрессионизм
Немецкий киноэкспрессионизм Переход в МегаФон с сохранением номеров. Вещательный союз
Переход в МегаФон с сохранением номеров. Вещательный союз Топиарий. Основы создания топиария
Топиарий. Основы создания топиария Исполнители вокруг нас
Исполнители вокруг нас Использование арт-терапии в работе психолога с детьми с РАС
Использование арт-терапии в работе психолога с детьми с РАС конструкційні матеріали - 5 клас
конструкційні матеріали - 5 клас БЭСТ-ОФИС 2.0 Управленческая и бухгалтерская система
БЭСТ-ОФИС 2.0 Управленческая и бухгалтерская система Товары и услуги
Товары и услуги Решение дробных рациональных уравнений
Решение дробных рациональных уравнений МДОТ-202
МДОТ-202 Євроінтеграція України як чинник соціально-економічного розвитку держави. Роль освіти в розвитку партнерства України з іншими де
Євроінтеграція України як чинник соціально-економічного розвитку держави. Роль освіти в розвитку партнерства України з іншими де Пугачёвское восстание
Пугачёвское восстание Повторение изученного
Повторение изученного Здравствуй, Новый год!
Здравствуй, Новый год! Тема: «Пейзаж в творчестве мастеров слова и кисти».
Тема: «Пейзаж в творчестве мастеров слова и кисти». Принцип масштабирования в контекстной рекламе
Принцип масштабирования в контекстной рекламе ВКР: Электрификация участка железной дороги
ВКР: Электрификация участка железной дороги Готический стиль в архитектуре Средневековья. Соборы
Готический стиль в архитектуре Средневековья. Соборы Викторина по произведениям А.П Чехова («Каштанка», «Мальчики», «Ванька»)
Викторина по произведениям А.П Чехова («Каштанка», «Мальчики», «Ванька») Косилка КС-2.1
Косилка КС-2.1 Advertisement 8th Form (1)
Advertisement 8th Form (1) Notiglik Sirlari
Notiglik Sirlari Презентация на тему Свободолюбивая лирика Пушкина
Презентация на тему Свободолюбивая лирика Пушкина Название достопримечательности А здесь можно написать небольшой рассказ об этой достопримечательности!
Название достопримечательности А здесь можно написать небольшой рассказ об этой достопримечательности! I know a lot about rare languages
I know a lot about rare languages Путешествие в космос (2 класс)
Путешествие в космос (2 класс) Наименование дисциплины - Экономическая теорияЛектор - Марика Ивановна Ковальская, доцент кафедры «Менеджмент» ИТТОП, ауд. 2312А
Наименование дисциплины - Экономическая теорияЛектор - Марика Ивановна Ковальская, доцент кафедры «Менеджмент» ИТТОП, ауд. 2312А Виды ответственности за нарушение авторских прав
Виды ответственности за нарушение авторских прав