Содержание
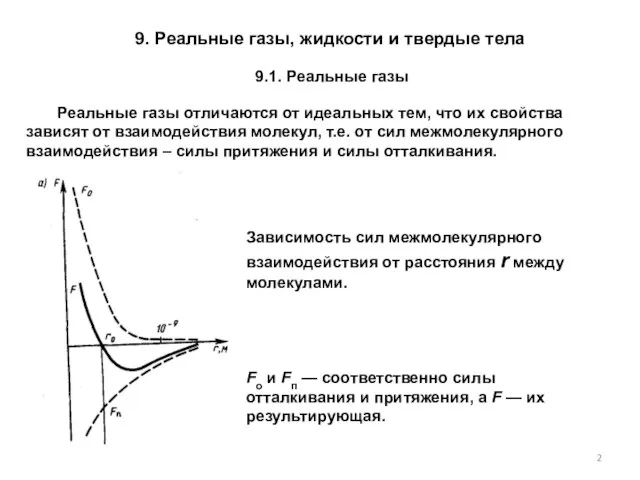
- 2. Реальные газы отличаются от идеальных тем, что их свойства зависят от взаимодействия молекул, т.е. от сил
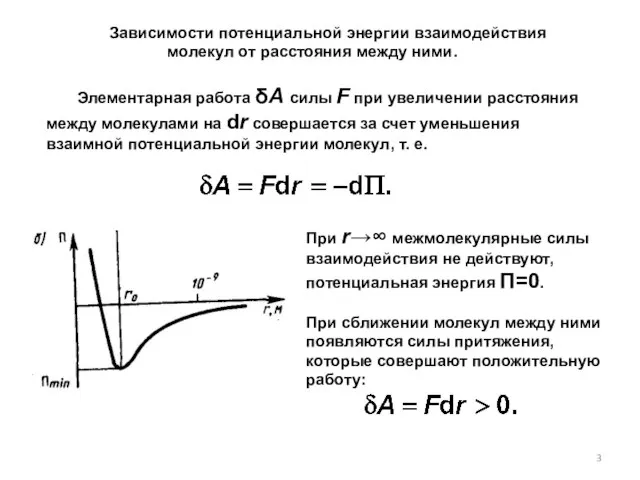
- 3. При r→∞ межмолекулярные силы взаимодействия не действуют, потенциальная энергия П=0. При сближении молекул между ними появляются
- 4. Соотношение между величинами Пmin и kT является критерием различных агрегатных состояний вещества: Если Пmin Если Пmin>>kT,
- 5. 9.2. Уравнение Ван-дер-Ваальса Ван-дер-Ваальс ввел две поправки в уравнение Клапейрона — Менделеева: Учет собственного объема молекул.
- 6. С учетом поправок уравнение Ван-дер-Ваальса или уравнение состояния реальных газов для моля газа будет иметь вид:
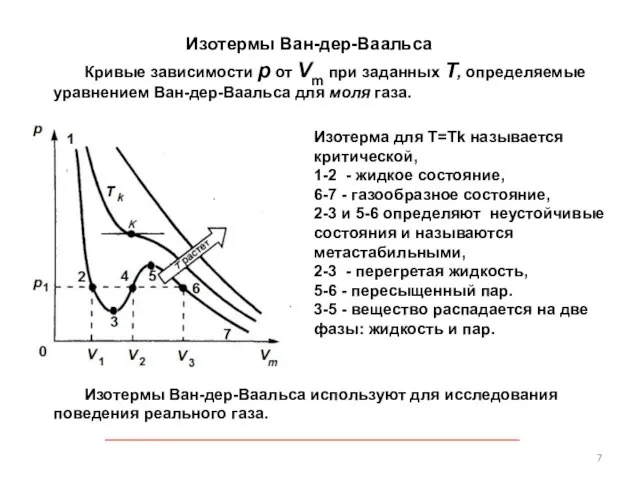
- 7. Изотермы Ван-дер-Ваальса Изотермы Ван-дер-Ваальса используют для исследования поведения реального газа. Кривые зависимости р от Vm при
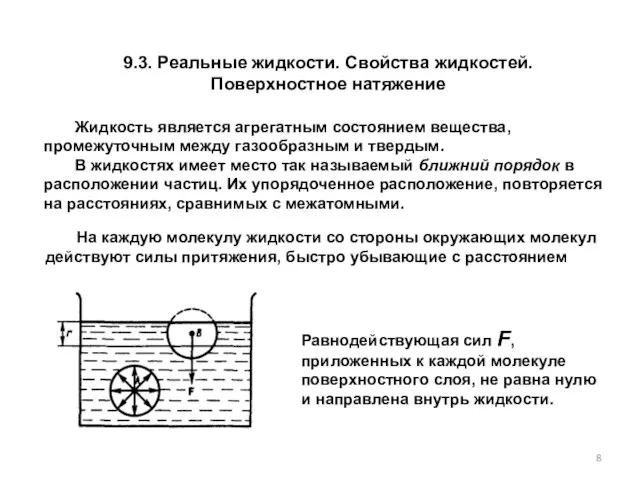
- 8. 9.3. Реальные жидкости. Свойства жидкостей. Поверхностное натяжение Жидкость является агрегатным состоянием вещества, промежуточным между газообразным и
- 9. Молекулы поверхностного слоя жидкости обладают большей потенциальной энергией, называемой поверхностной энергией, которая пропорциональна площади слоя ΔS:
- 10. Рассмотрим поверхность жидкости, ограниченную замкнутым контуром. Под действием сил поверхностного натяжения поверхность жидкости сократилась и рассматриваемый
- 11. Из сравнения выражений (1) и (2) получим: Работа совершается за счет уменьшения поверхностной энергии, т. е.
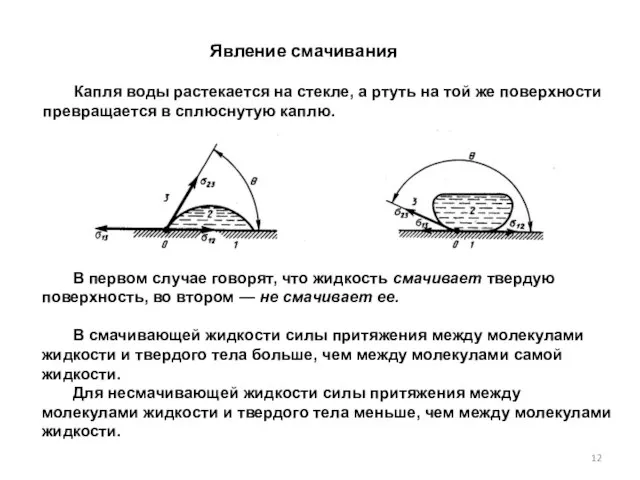
- 12. Капля воды растекается на стекле, а ртуть на той же поверхности превращается в сплюснутую каплю. Явление
- 13. Давление под искривленной поверхностью жидкости Сферическая выпуклая поверхность производит на жидкость дополнительное давление, определяемое силами натяжения:
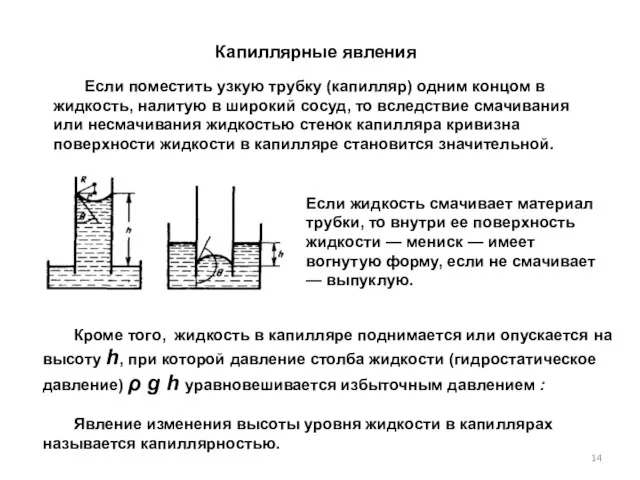
- 14. Капиллярные явления Если поместить узкую трубку (капилляр) одним концом в жидкость, налитую в широкий сосуд, то
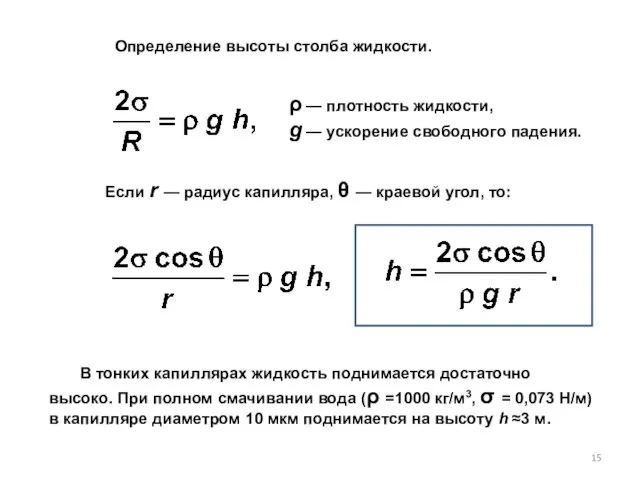
- 15. Если r — радиус капилляра, θ — краевой угол, то: В тонких капиллярах жидкость поднимается достаточно
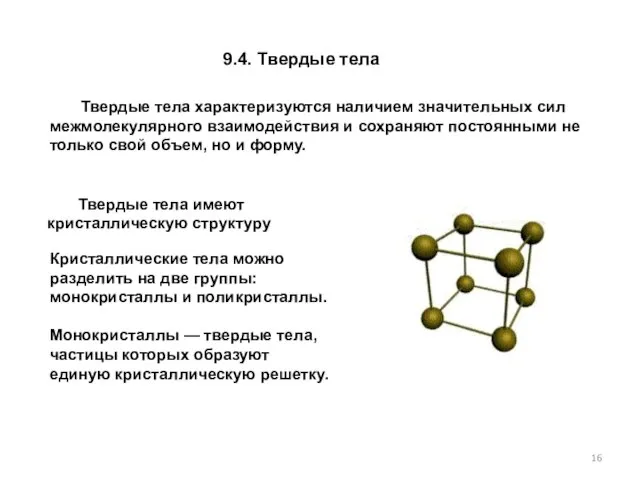
- 16. 9.4. Твердые тела Твердые тела характеризуются наличием значительных сил межмолекулярного взаимодействия и сохраняют постоянными не только
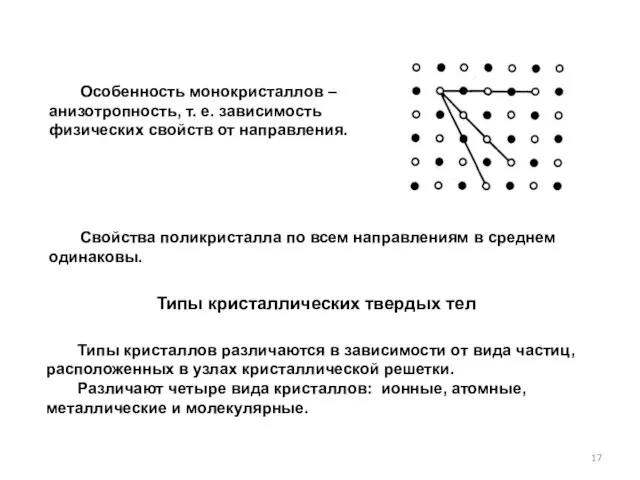
- 17. Особенность монокристаллов – анизотропность, т. е. зависимость физических свойств от направления. Свойства поликристалла по всем направлениям
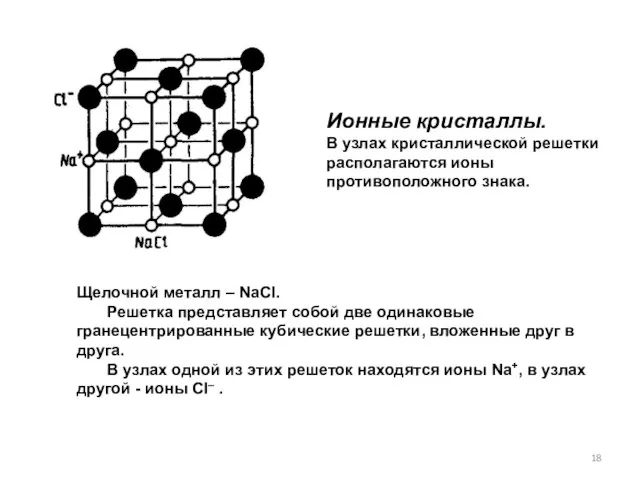
- 18. Ионные кристаллы. В узлах кристаллической решетки располагаются ионы противоположного знака. Щелочной металл – NaCl. Решетка представляет
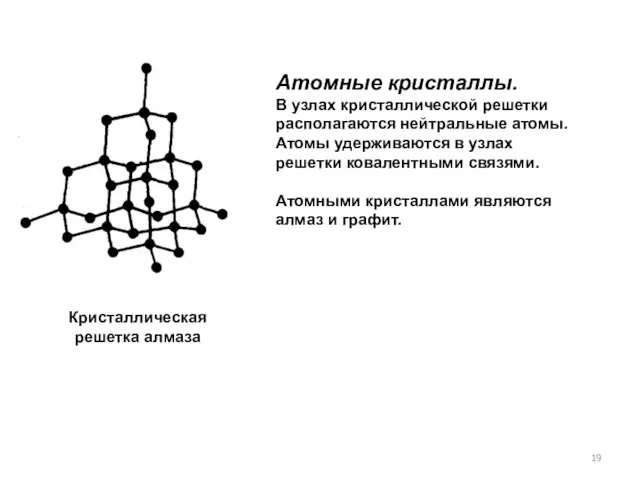
- 19. Атомные кристаллы. В узлах кристаллической решетки располагаются нейтральные атомы. Атомы удерживаются в узлах решетки ковалентными связями.
- 20. Металлические кристаллы. В узлах кристаллической решетки располагаются положительные ионы металла. Между положительными ионами хаотически движутся «свободные»
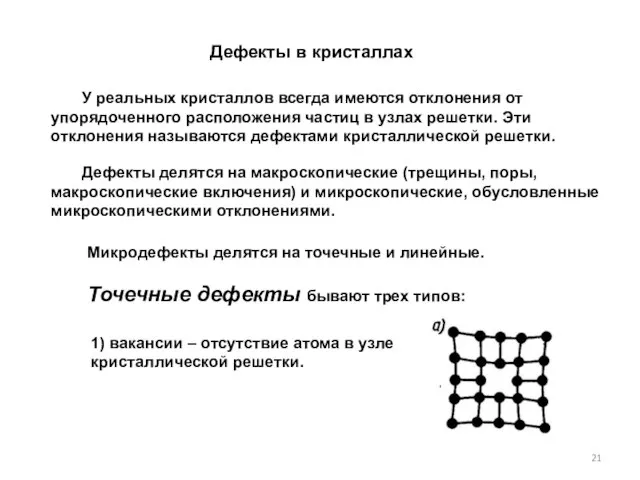
- 21. Дефекты в кристаллах У реальных кристаллов всегда имеются отклонения от упорядоченного расположения частиц в узлах решетки.
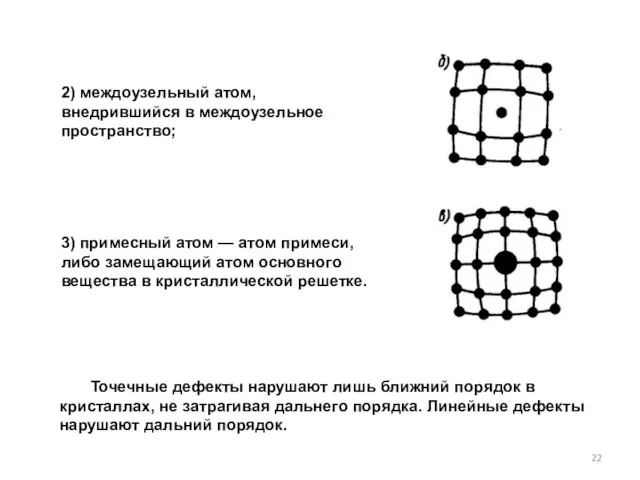
- 22. 2) междоузельный атом, внедрившийся в междоузельное пространство; 3) примесный атом — атом примеси, либо замещающий атом
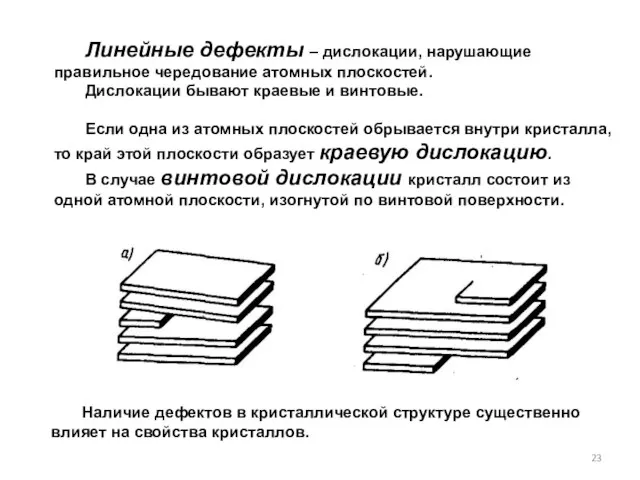
- 23. Линейные дефекты – дислокации, нарушающие правильное чередование атомных плоскостей. Дислокации бывают краевые и винтовые. Если одна
- 24. Теплоемкость твердых тел В узлах кристаллической решетки частицы колеблются около своих положений равновесия в трех взаимно
- 25. т. е. молярная (атомная) теплоемкость химически простых тел в кристаллическом состоянии одинакова и не зависит от
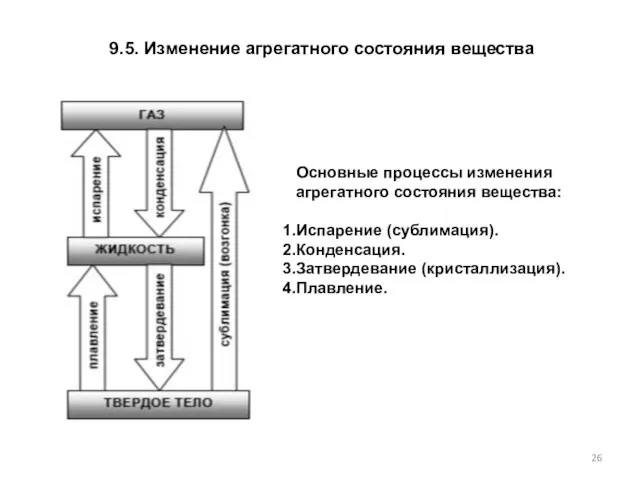
- 26. 9.5. Изменение агрегатного состояния вещества Основные процессы изменения агрегатного состояния вещества: Испарение (сублимация). Конденсация. Затвердевание (кристаллизация).
- 27. Испарение (парообразование) – отрыв молекул от поверхности жидкости и переход в окружающее пространство. Для твердых тел
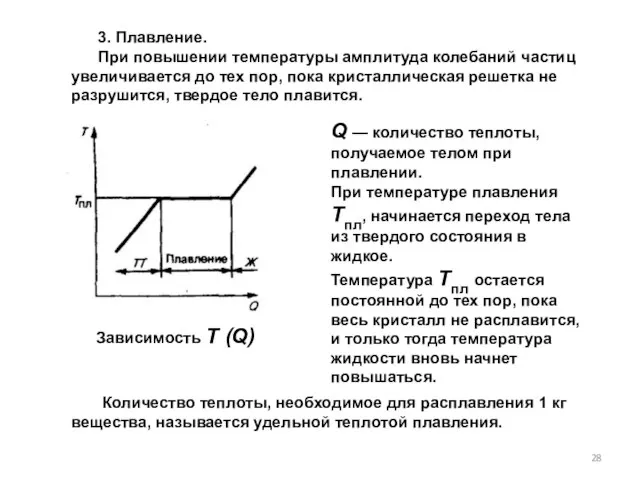
- 28. Q — количество теплоты, получаемое телом при плавлении. При температуре плавления Tпл, начинается переход тела из
- 29. Q' — количество теплоты, отдаваемое телом при кристаллизации. При постоянной температуре, равной Tпл, начинается кристаллизация. Для
- 30. Ряд веществ из-за большой вязкости в сильно переохлажденном состоянии теряют текучесть, сохраняя, как в твердые тела,
- 31. Фазовые переходы Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных
- 32. Фазовые переходы II рода не связанны с поглощением или выделением теплоты и изменением объема. Эти переходы
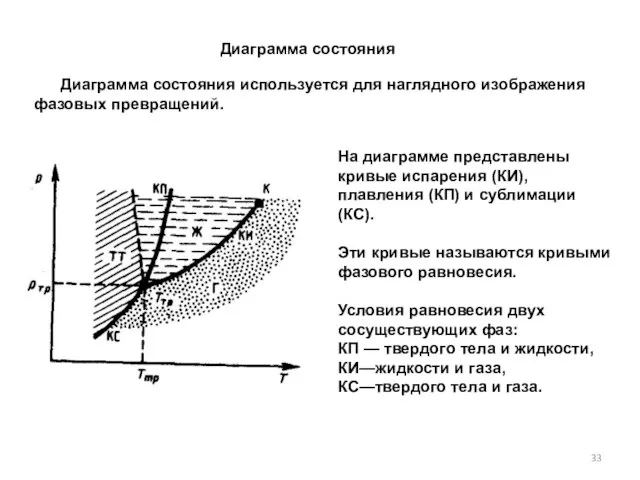
- 33. Диаграмма состояния используется для наглядного изображения фазовых превращений. Диаграмма состояния На диаграмме представлены кривые испарения (КИ),
- 34. Точка пересечения кривых называется тройной точкой. Каждое вещество имеет только одну тройную точку. Тройная точка воды
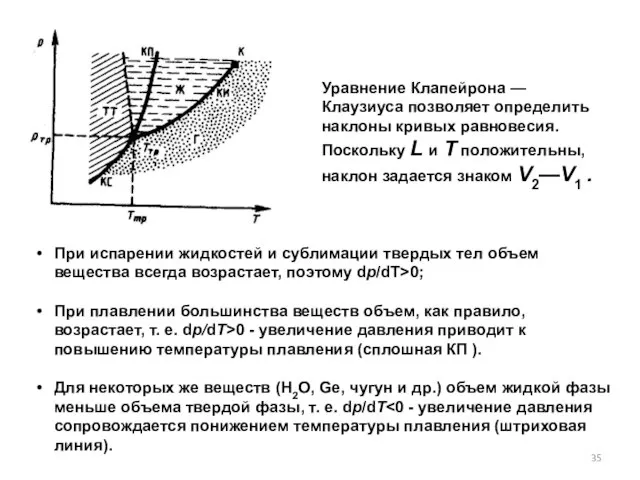
- 35. Уравнение Клапейрона — Клаузиуса позволяет определить наклоны кривых равновесия. Поскольку L и Т положительны, наклон задается
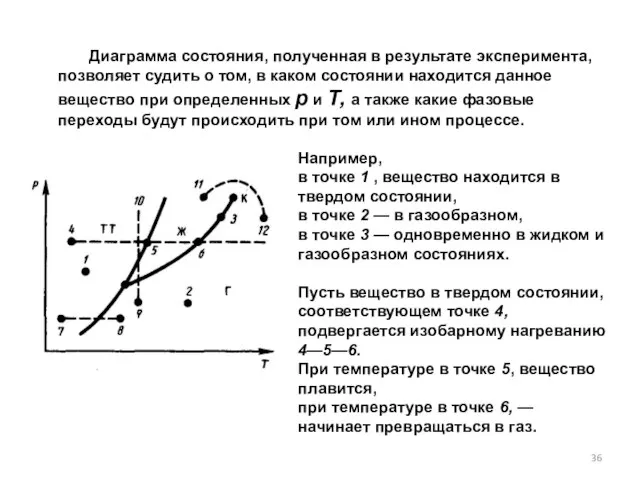
- 36. Диаграмма состояния, полученная в результате эксперимента, позволяет судить о том, в каком состоянии находится данное вещество
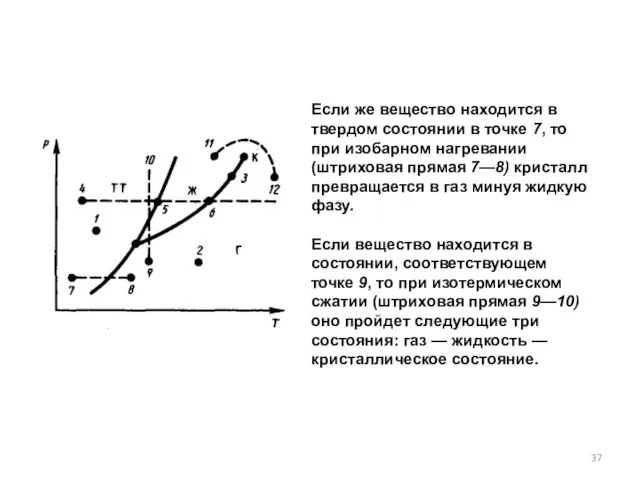
- 37. Если же вещество находится в твердом состоянии в точке 7, то при изобарном нагревании (штриховая прямая
- 39. Скачать презентацию
















 Развитие сети профессиональных юридических услуг в России и СНГ Альберт Еганян, к.ю.н., MCIArb, Управляющий партнер
Развитие сети профессиональных юридических услуг в России и СНГ Альберт Еганян, к.ю.н., MCIArb, Управляющий партнер Kochen deutscher Kartoffelsalat
Kochen deutscher Kartoffelsalat Схемотехника. Практика 1
Схемотехника. Практика 1 Выдающиеся писатели России
Выдающиеся писатели России Китай: сопротивление реформам
Китай: сопротивление реформам Безопасность жизнедеятельности
Безопасность жизнедеятельности Одеяло Земли
Одеяло Земли Выполнила студентка 4 курса филологического факультета КГПИ Дуркина Юлия 2010
Выполнила студентка 4 курса филологического факультета КГПИ Дуркина Юлия 2010 Презентация на тему Скандинавская мифология
Презентация на тему Скандинавская мифология  Методы решения
Методы решения CX 8000 Operator Training
CX 8000 Operator Training Сервер Flash-вещаний (RTMP) на Python или создание высоконагруженных сетевых серверов с использованием Twisted
Сервер Flash-вещаний (RTMP) на Python или создание высоконагруженных сетевых серверов с использованием Twisted Ионная химическая связь
Ионная химическая связь ВАНЯ ДР-2022
ВАНЯ ДР-2022 Stili_rechi_ISP9-21_Sidorov
Stili_rechi_ISP9-21_Sidorov Общие правила выполнения зарядки в домашних условиях
Общие правила выполнения зарядки в домашних условиях Презентация на тему Королева Елизавета II
Презентация на тему Королева Елизавета II  Фигуры вращения
Фигуры вращения Общественное движение при Александре 2
Общественное движение при Александре 2 Гражданское право РФ. Право собственности и иные вещные права
Гражданское право РФ. Право собственности и иные вещные права Золотая теорема геометрии
Золотая теорема геометрии Глобус Гурмэ. Ежегодный каталог
Глобус Гурмэ. Ежегодный каталог Результативность образовательного процесса в системе дополнительного образования детей
Результативность образовательного процесса в системе дополнительного образования детей Презентация на тему Презентация - Победа. Итоги Великой Отечественной и второй Мировой войны
Презентация на тему Презентация - Победа. Итоги Великой Отечественной и второй Мировой войны Предметы народных промыслов в повседневной жизни
Предметы народных промыслов в повседневной жизни ДРЕВНИЕ
ДРЕВНИЕ Dollar
Dollar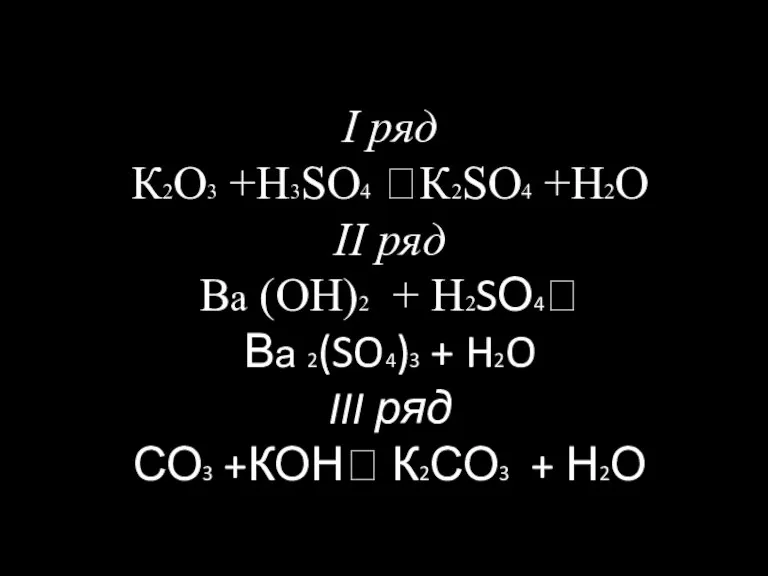 Генетические связи между важнейшими классами неорганических соединений
Генетические связи между важнейшими классами неорганических соединений