Содержание
- 2. Задача. Идеальный газ, масса которого m и молярная масса μ, расширяется изобарно при некотором давлении. Начальная
- 3. Задача. Гелий (Не) нагревается при постоянном давлении. При этом ему сообщено Q = 20 кДж теплоты.
- 4. Следовательно: Ответ:
- 5. Задача. Определите давление воздуха в камере сгорания дизельного двигателя при температуре 512 °C, если плотность воздуха
- 6. Задача. Как изменится абсолютная температура идеального газа при уменьшении его объема в 2 раза и увеличении
- 7. Реальные газы Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
- 8. Далее предположим, что частицы данного газа являются упругими сферами одинакового радиуса r. Так как газ находится
- 9. С учетом этих допущений можно считать, что давление на стенки сосуда меньше на некоторую величину, обратно
- 10. Ян Дидерик Ван-дер-Ваа́льс (1837 - 1923) — голландский физик, лауреат Нобелевской премии по физике в 1910
- 11. Медленно будем сжимать газ в сосуде с поршнем, например углекислый газ (СO2). Сжимая его, мы выполняем
- 12. В конце концов, начиная с какого-то значения, давление не будет изменяться, несмотря на уменьшение объёма. На
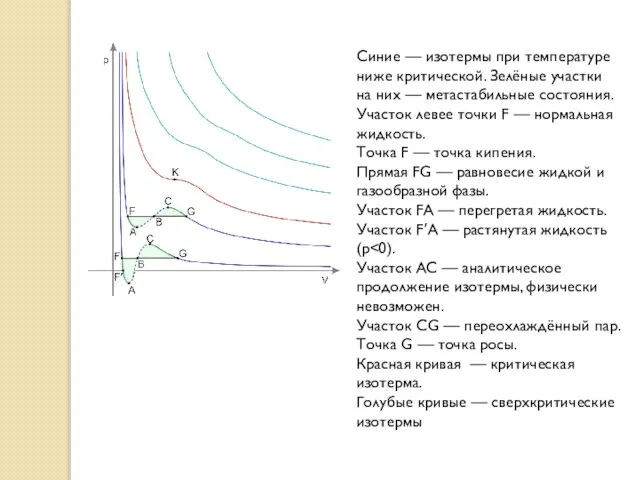
- 13. Синие — изотермы при температуре ниже критической. Зелёные участки на них — метастабильные состояния. Участок левее
- 14. Опыты показывают, что такой вид имеют изотермы и всех других газов, если их температура не очень
- 15. Пар Пар — газообразное состояние вещества в условиях, когда газовая фаза может находиться в равновесии с
- 16. У разных жидкостей насыщение пара - динамическое равновесие с паром - наступает при различной плотности и
- 17. Свойства жидкостей Поверхностное натяжение Молекулы вещества в жидком состоянии расположены почти вплотную друг к другу. В
- 18. Такие перескоки в жидкостях происходят довольно часто; поэтому молекулы не привязаны к определенным центрам, как в
- 19. Вследствие плотной упаковки молекул сжимаемость жидкостей, т. е. изменение объема при изменении давления, очень мала; она
- 20. Тепловое расширение воды имеет интересную и важную для жизни на Земле аномалию. При температуре ниже 4
- 21. Наиболее интересной особенностью жидкостей является наличие свободной поверхности. Жидкость, в отличие от газов, не заполняет весь
- 22. Поверхностные молекулы силами межмолекулярного притяжения втягиваются внутрь жидкости. Но все молекулы, в том числе и молекулы
- 23. Следовательно, молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами внутри жидкости потенциальной энергией. Потенциальная
- 24. Некоторые жидкости, как, например, мыльная вода, обладают способностью образовывать тонкие пленки. Всем хорошо известные мыльные пузыри
- 25. Отсюда получаем Таким образом, коэффициент поверхностного натяжения σ может быть определен как модуль силы поверхностного натяжения,
- 26. Вблизи границы между жидкостью, твердым телом и газом форма свободной поверхности жидкости зависит от сил взаимодействия
- 27. Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются
- 28. При полном смачивании θ = 0, cos θ = 1. В этом случае При полном несмачивании
- 29. В 1643 г. по предложению итальянского физика Эванджелисты Торричелли (1608—1647) был произведен следующий опыт. Стеклянную трубку
- 30. Поэтому взятая в миллиметрах высота столба над свободной поверхностью ртути прямо измеряет давление атмосферы в миллиметрах
- 31. Закон Паскаля Закон Паскаля формулируется так: Возмущение давления, производимое на покоящуюся несжимаемую жидкость, передается в любую
- 32. По указанию Паскаля, крепкую дубовую бочку до краев наполнили водой и наглухо закрыли крышкой. В небольшое
- 33. Блез Паска́ль (1623 —1662) — французский математик, механик, физик, литератор и философ. Классик французской литературы, один
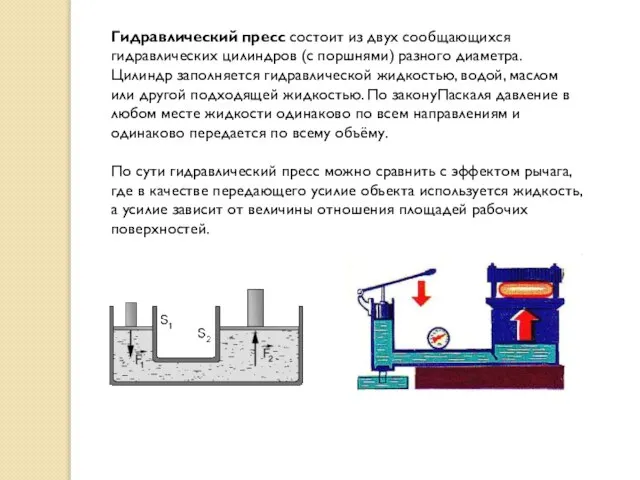
- 34. Гидравлический пресс состоит из двух сообщающихся гидравлических цилиндров (с поршнями) разного диаметра. Цилиндр заполняется гидравлической жидкостью,
- 35. Жидкости и газы могут двигаться совершенно фантастическим образом, и для описания их поведения используются неподъемные системы
- 36. Струя жидкости, ударяющаяся о движущуюся поверхность из той же жидкости, прыгает на ней, формируя такую "змейку".
- 37. Так потоки воздуха распределяются вокруг пули, летящей с очень высокой скоростью.
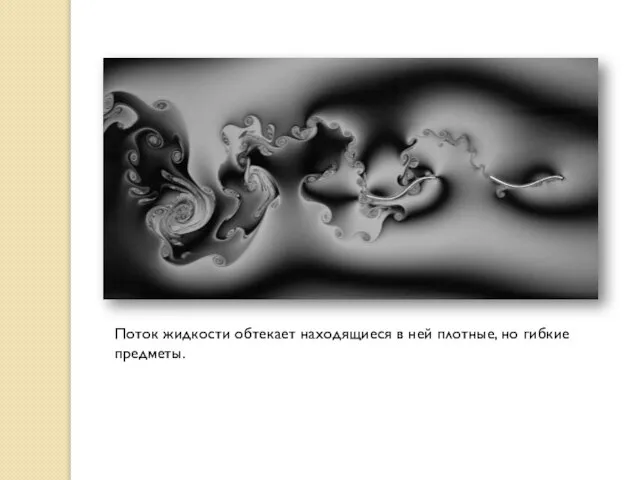
- 38. Поток жидкости обтекает находящиеся в ней плотные, но гибкие предметы.
- 39. Xолодная и плотная вода от кубика льда опускается вниз в более теплую воду.
- 40. Подобные волнообразные структуры возникают на границах потоков, движущихся с различной скоростью, и называются неустойчивостями Кельвина-Гельмгольца
- 41. Такие структуры возникают, когда жидкость небольшой вязкости (например, вода), попадает в жидкость с большей вязкостью (например,
- 43. Скачать презентацию





































 Чистое искусство
Чистое искусство Виды графики
Виды графики Анализ спектра сигма-дельта модулятора первого и второго порядка
Анализ спектра сигма-дельта модулятора первого и второго порядка Примеры методических приемов технологии развития критического мышления МОУ Молькинская СОШ Учитель Пригожаева Н.А.
Примеры методических приемов технологии развития критического мышления МОУ Молькинская СОШ Учитель Пригожаева Н.А. «Сертификация – важный инструмент повышения качества в жилищно-коммунальной сфере»
«Сертификация – важный инструмент повышения качества в жилищно-коммунальной сфере» Рисуем лису
Рисуем лису Презентация на тему Наше здоровье
Презентация на тему Наше здоровье Нестандартные задачи для шестиклассников
Нестандартные задачи для шестиклассников smena (1)
smena (1) Презентация неделя языков
Презентация неделя языков Тестирование программных средств
Тестирование программных средств Сосновый лес
Сосновый лес Multimedia
Multimedia Биржа идей. Форматы и условия участия. Бизнес-задачи КАМАЗа
Биржа идей. Форматы и условия участия. Бизнес-задачи КАМАЗа Особенности функционирования кофеен в условиях пандемии
Особенности функционирования кофеен в условиях пандемии О порядке проведения конкурсного отбора мероприятий административной реформы в 2008 году
О порядке проведения конкурсного отбора мероприятий административной реформы в 2008 году Основные идеи и принципы методики преподавания РКИ
Основные идеи и принципы методики преподавания РКИ Система компьютерной ЭЭГ.
Система компьютерной ЭЭГ. Строим пирамиду
Строим пирамиду От Хаоса к Космосу: Консолидация внутренних веб-ресурсов SPM Conference 2011
От Хаоса к Космосу: Консолидация внутренних веб-ресурсов SPM Conference 2011 КУДА ПОЙТИ УЧИТЬСЯ?
КУДА ПОЙТИ УЧИТЬСЯ? ЖЕЛАЕМ УСПЕХА
ЖЕЛАЕМ УСПЕХА Презентация на тему Самоорганизация материи
Презентация на тему Самоорганизация материи  Социальная психология
Социальная психология Мифы и легенды
Мифы и легенды Финансовый анализ и показатели хозяйственной деятельности
Финансовый анализ и показатели хозяйственной деятельности Строевая подготовка
Строевая подготовка Итоги работы по аттестации педагогических и руководящих работников муниципальных образовательных учреждений Старооскольског
Итоги работы по аттестации педагогических и руководящих работников муниципальных образовательных учреждений Старооскольског