Содержание
- 2. «Мыслящий ум не чувствует себя счастливым, пока не удастся связать воедино разрозненные факты, им наблюдаемые» Д.
- 3. Поведение соединений хрома в различных средах Проверка теоретических знаний
- 4. Зависимость свойств соединений хрома от степени окисления. Заполните таблицу.
- 5. Зависимость свойств соединений хрома от степени окисления.
- 6. Дихромат и хромат - окислители K2Cr2O7 (кислая и нейтральная среда), K2Cr O 4 (щелочная среда) +
- 7. K2Cr2O7 (кислая и нейтральная среда), K2Cr O 4 (щелочная среда) + восстановители всегда получается Cr+3 кислая
- 8. Изменение степени окисления Cr+3 . Cr+3 + очень сильные окислители ( всегда независимо от среды!) образуются
- 9. Cr+3 + очень сильные окислители Cr+6 ( всегда независимо от среды!) + очень сильные окислители: KNO3.
- 10. Дихроматы получаются при действии на хроматы ….? Na2CrO4 + ?= Na2Cr2O7 + ?+ ? Возможен и
- 11. Превращение солей хрома Дихроматы получаются при действии на хроматы кислот 2 Na2CrO4 + H2SO4 = Na2Cr2O7
- 12. Поведение солей хрома в различных средах Работа с заданиями уровня С
- 13. Сr2(SO4)3 + KMnO4 + … = K2CrO4 + … K2SO4 + H2O К2Сr2О7 +Н2S + …
- 14. Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях: Na3 [Сг(OH)6]
- 15. Работа экспертов : Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих
- 16. не может получиться такое вещество, которое вступает во взаимодействие со средой! а) в …среде не может
- 17. не может получиться такое вещество, которое вступает во взаимодействие со средой! а) в кислой среде не
- 18. Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом
- 20. Скачать презентацию

















 Стандарт cXML в корпоративных приложениях электронной коммерции
Стандарт cXML в корпоративных приложениях электронной коммерции Натюрморт в фотографии
Натюрморт в фотографии Золотой век русской культуры. Литература. Живопись
Золотой век русской культуры. Литература. Живопись титул констатирующего
титул констатирующего Повесть о настоящем человеке
Повесть о настоящем человеке Выпускающая кафедра«Механика механизмов и машин» Заведующий кафедрой Шевченко Игорь Владимирович
Выпускающая кафедра«Механика механизмов и машин» Заведующий кафедрой Шевченко Игорь Владимирович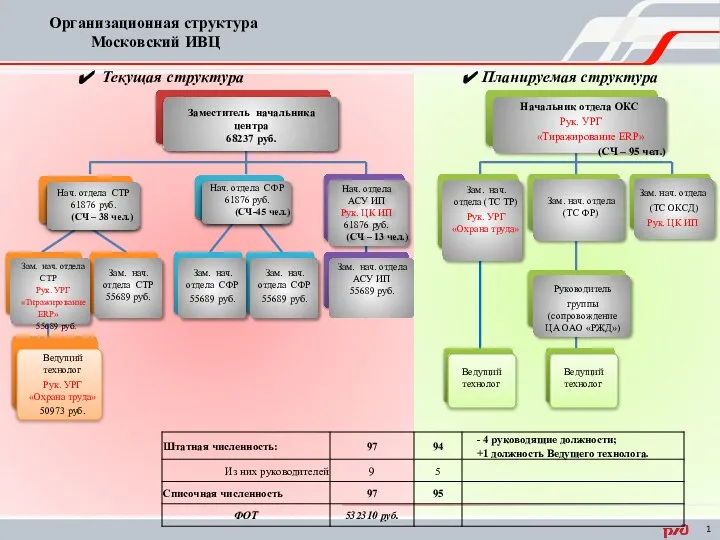 Организационная структура Московский ИВЦ
Организационная структура Московский ИВЦ День рождения Деда Мороза
День рождения Деда Мороза Поздравление с Новым годом
Поздравление с Новым годом Радиотехнические системы (РТС)
Радиотехнические системы (РТС) Презентация Microsoft PowerPoint [Автосохраненный]
Презентация Microsoft PowerPoint [Автосохраненный] Плюсы группы Т Плюс
Плюсы группы Т Плюс КВН – игра «В стране географов и географинь»
КВН – игра «В стране географов и географинь» Компьютерный кружок
Компьютерный кружок Изучение работы сварного соединения
Изучение работы сварного соединения  Осень… На улице холодно и сыро
Осень… На улице холодно и сыро Презентация на тему Познавательные способности
Презентация на тему Познавательные способности Башкирский государственный университет. Магистратура по социологии
Башкирский государственный университет. Магистратура по социологии Слово и время
Слово и время ИСПОЛЬЗОВАНИЕ МОБИЛЬНОГО КОМПЬЮТЕРНОГО КЛАССАВ УЧЕБНО-ВОСПИТАТЕЛЬНОМ ПРОЦЕССЕ МОУ СОШ 30
ИСПОЛЬЗОВАНИЕ МОБИЛЬНОГО КОМПЬЮТЕРНОГО КЛАССАВ УЧЕБНО-ВОСПИТАТЕЛЬНОМ ПРОЦЕССЕ МОУ СОШ 30 Презентация на тему Презентация "Буквы Уу Ээ"
Презентация на тему Презентация "Буквы Уу Ээ" Nature’s Sunshine Products
Nature’s Sunshine Products Православная молитва
Православная молитва ПСИХОЛОГИЧЕСКИЙ ВЕСТНИК
ПСИХОЛОГИЧЕСКИЙ ВЕСТНИК ИТОГИ РАБОТЫ ЗА 2011 ГОД
ИТОГИ РАБОТЫ ЗА 2011 ГОД Об утверждении положения о порядке реализации правотворческой инициативы граждан в муниципальном образовании Северодвинск
Об утверждении положения о порядке реализации правотворческой инициативы граждан в муниципальном образовании Северодвинск Орнамент
Орнамент Презентация на тему А нужен ли Калгон?
Презентация на тему А нужен ли Калгон?