Содержание
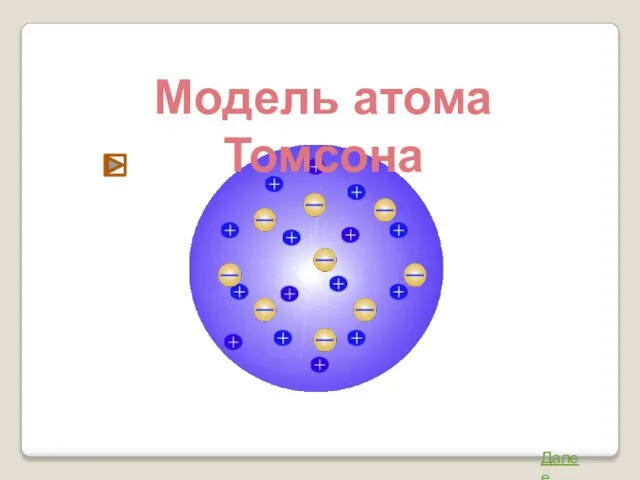
- 2. Модель атома Томсона Джозеф Джон Томсон (1856 – 1940) Атом представляет собой непрерывно заряженный положительным зарядом
- 3. Модель атома Томсона Далее
- 4. Модель атома Резерфорда Эрнест Резерфорд (1871 – 1937) Экспериментально исследовал распределение положительного заряда. В 1906 г.
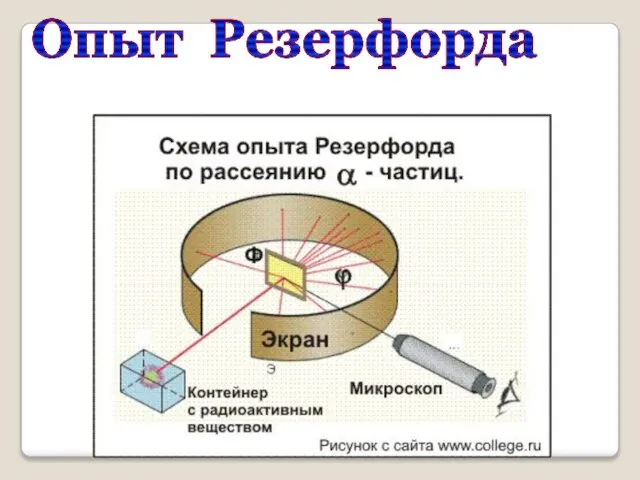
- 5. Опыт Резерфорда
- 6. ? Схема опыта Резерфорда Фольга Радиоактивное вещество Скорость a- частиц - 1/30 скорости света в вакууме
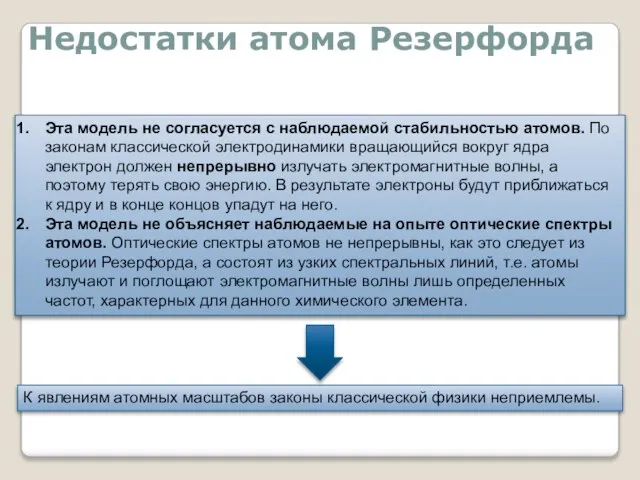
- 7. Недостатки атома Резерфорда Эта модель не согласуется с наблюдаемой стабильностью атомов. По законам классической электродинамики вращающийся
- 8. Планетарная модель атома
- 9. Квантовые постулаты Бора
- 10. Трудности теории Бора КВАНТОВАЯ МЕХАНИКА - наука, позволяющая предсказать поведение огромного числа физических систем – от
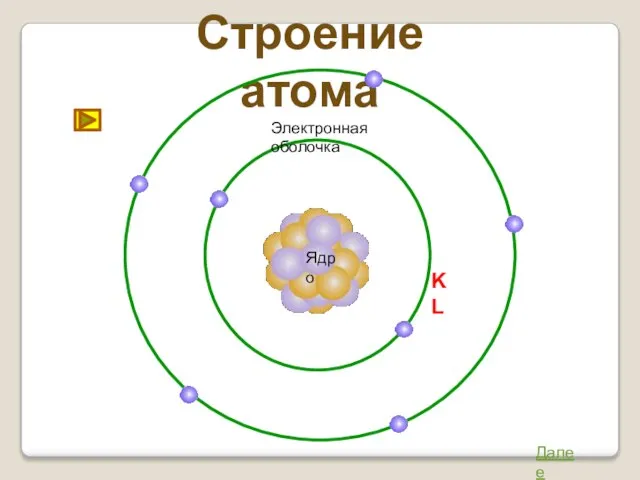
- 11. Строение атома Ядро Далее Электронная оболочка K L
- 12. Энергия связи атомных ядер – та энергия, которая необходима для полного расщепления ядра на отдельные частицы.
- 13. Уменьшение массы при образовании ядра из частиц уменьшается энергия этой системы частиц на значение энергии связи
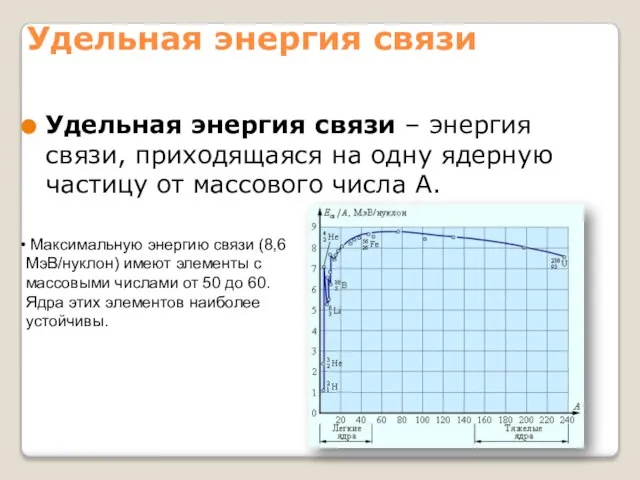
- 14. Удельная энергия связи Удельная энергия связи – энергия связи, приходящаяся на одну ядерную частицу от массового
- 15. Ядерные силы являются короткодействующими. Нуклоны, находящиеся на поверхности ядра, взаимодействуют с меньшим числом соседей, чем нуклоны
- 16. Ядерные силы ( сильное взаимодействие)-силы, действующие между нуклонами в ядре и обеспечивающие существование устойчивых ядер Являются
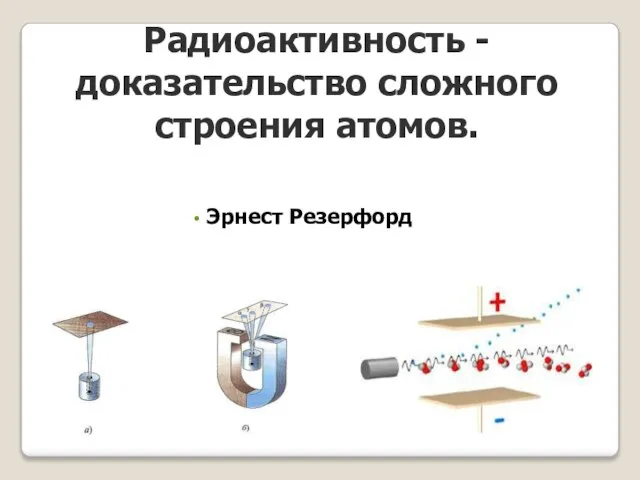
- 17. Радиоактивность - доказательство сложного строения атомов. Эрнест Резерфорд
- 19. Скачать презентацию










 Особенностипродвиженияженских товаровв Интернете
Особенностипродвиженияженских товаровв Интернете Рецепт пиццы Домашняя
Рецепт пиццы Домашняя Жоғары дәлдікті теодолиттер
Жоғары дәлдікті теодолиттер Металлургический комплекс
Металлургический комплекс Армянская Ассоциация врачей стоматологов 21-Века
Армянская Ассоциация врачей стоматологов 21-Века Summer Shop
Summer Shop КОМПЬЮТЕРНОЕ ВИЗУАЛИЗИРОВАННОЕ ТЕСТИРОВАНИЕ
КОМПЬЮТЕРНОЕ ВИЗУАЛИЗИРОВАННОЕ ТЕСТИРОВАНИЕ Профессиональная компетентность и компетенции современного учителя
Профессиональная компетентность и компетенции современного учителя Правописание НЕ с существительными
Правописание НЕ с существительными Деловая игра для учащихся Притобольной средней школы
Деловая игра для учащихся Притобольной средней школы Учимся работать по новым стандартам!
Учимся работать по новым стандартам! The Government Economic Policy
The Government Economic Policy  Презентация на тему Искусство XX-XXI в. Массовая культура (9 класс)
Презентация на тему Искусство XX-XXI в. Массовая культура (9 класс) Маркетинговые концепции качества
Маркетинговые концепции качества Создание цветочного салона
Создание цветочного салона Границы моего языка означают границы моего мира. (Людвиг Витгенштейн (1889-1951), австрийский философ и логик)
Границы моего языка означают границы моего мира. (Людвиг Витгенштейн (1889-1951), австрийский философ и логик) Городское и сельское население 10 класс
Городское и сельское население 10 класс Лидия Ильинична Божович (11 января 1908 - 21 июля 1981)
Лидия Ильинична Божович (11 января 1908 - 21 июля 1981) Показатели качества и методы их оценки. Метрология, стандартизация и сертификация. Тема 3.1.1
Показатели качества и методы их оценки. Метрология, стандартизация и сертификация. Тема 3.1.1 Openstat – универсальная метка
Openstat – универсальная метка Муниципальное автономное дошкольное образовательное учреждение Детский сад №95 Планета детства
Муниципальное автономное дошкольное образовательное учреждение Детский сад №95 Планета детства Typemaster Presentation
Typemaster Presentation 1 класс
1 класс Презентация на тему Кодирование информации
Презентация на тему Кодирование информации  Инфраструктура в борьбе за внедрение ЭДОИЛИ «Кому нужны системы ЭДО»
Инфраструктура в борьбе за внедрение ЭДОИЛИ «Кому нужны системы ЭДО» Виды и типы сетевых продовольственных магазинов
Виды и типы сетевых продовольственных магазинов Физическая культура. Нормативно-правовая база
Физическая культура. Нормативно-правовая база Отряд Приматы
Отряд Приматы