Презентация на тему Теоретические основы аналитической химии Химическое равновесие в гомогенной системе
Содержание
- 2. Скорость химической реакции и химическое равновесие Скоростью химической реакции называется изменение концентрации веществ в ходе реакции
- 3. Основные положения теории растворов электролитов. Процесс электролитической диссоциации изображают химическими уравнениями, например: Степень электролитической диссоциации По
- 4. Константа диссоциации слабого электролита Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации
- 5. Закон разбавления Оствальда При разбавлении степень диссоциации увеличивается – активность данного иона – коэффициент активности иона
- 6. Кислотно-основные равновесия в водных растворах В соответствие с протолитической теорией Бренстеда и Лоури все частицы, способные
- 7. Кислотно-основные равновесия в водных растворах Согласно современным представлениям в воде осуществляется протолитическое равновесие – автопротолиз воды:
- 8. Кислотно-основные равновесия в водных растворах pH = 7, нейтральная среда pH pH > 7, щелочная среда
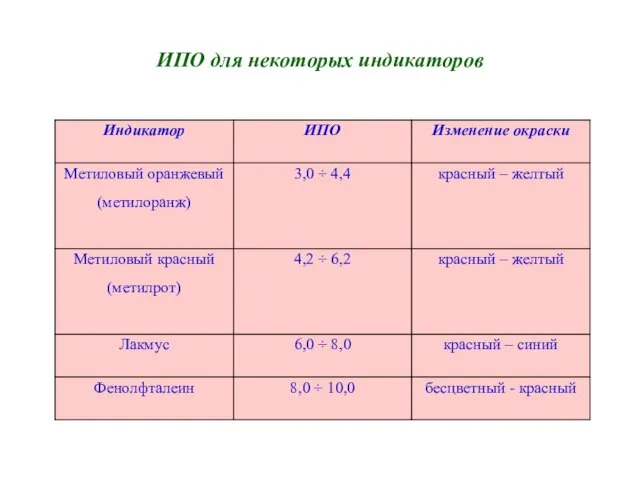
- 9. ИПО для некоторых индикаторов
- 10. Действие одноименнных ионов Степень диссоциации слабого электролита понижается при введении в раствор какого-либо сильного электролита, содержащего
- 11. Буферные растворы Количественной характеристикой способности буферного раствора поддерживать заданную величину pH является буферная емкость, под которой
- 12. Гидролиз солей Количественно гидролиз характеризуется степенью гидролиза h, которая равна отношению числа прогидролизровавшихся частиц nгидр к
- 13. Гидролиз солей При этом, чем слабее образующаяся в результате гидролиза кислота (меньше Ka), тем более сильным
- 14. Гидролиз солей 3. Гидролиз солей, содержащих катион слабого однокислотного основания и анион слабой одноосновной кислоты (ВА).
- 15. Гидролиз солей Так как Kа1 > Ka2, то Kh1 > Kh2 Na2S, K2CO3, Na2SO3, Na2C2O4 K3PO4,
- 16. Произведение растворимости Гетерогенная (неоднородная) система – это система, состоящая из нескольких гомогенных фаз, разделенных между собой
- 17. Произведение растворимости Правило произведения растворимости: произведение активностей ионов в степенях, равных стехиометрическим коэффициентам, в насыщенном растворе
- 18. Произведение растворимости Растворимость зависит 1. от природы малорастворимого соединения, 2. природы растворителя, 3. температуры, 4. давления,
- 20. Скачать презентацию
















 Реактивная тяга
Реактивная тяга Система подземного водозабора для малых населенных пунктов
Система подземного водозабора для малых населенных пунктов Презентация_21
Презентация_21 21 вересня – Міжнародний день миру
21 вересня – Міжнародний день миру История ислама
История ислама VellDoris. Наброски слоганов
VellDoris. Наброски слоганов Анализ деятельности Владимирской таможни за 2015 год
Анализ деятельности Владимирской таможни за 2015 год Развитие сотрудников. Влияние на результат
Развитие сотрудников. Влияние на результат Виды письменных источников
Виды письменных источников Считаем пароходы
Считаем пароходы Ольга Фокина
Ольга Фокина Кухня народов Крыма
Кухня народов Крыма Диагностическая программа в системе предшкольного образования
Диагностическая программа в системе предшкольного образования Основные свойства пылей
Основные свойства пылей Параолимпийские игры
Параолимпийские игры Очки Pegasi. Улучшение качества сна
Очки Pegasi. Улучшение качества сна Графика и анимация
Графика и анимация KTO Я?
KTO Я? Интеллектуальные сенсоры цифровой подстанции электроснабжения промышленного предприятия
Интеллектуальные сенсоры цифровой подстанции электроснабжения промышленного предприятия Иванова Л.В. МБОУ-гимназия № 19 г. Орёл 2014
Иванова Л.В. МБОУ-гимназия № 19 г. Орёл 2014 АИС Осадки. Предпосылки и цели создания
АИС Осадки. Предпосылки и цели создания Живопись Древней Руси
Живопись Древней Руси Классы Моллюсков
Классы Моллюсков Комплекс мер по модернизации системы общего образования
Комплекс мер по модернизации системы общего образования Продукт нашего бренда ( наклейки на стену)
Продукт нашего бренда ( наклейки на стену) Положение О лицензировании риэлтерской деятельности
Положение О лицензировании риэлтерской деятельности Архитектура ЭВМ
Архитектура ЭВМ Vocabulary Sports
Vocabulary Sports