Содержание
- 2. Краткая характеристика элемента H 1 1,00794 1s1 Водород Водоро́д — первый элемент периодической системы элементов. Широко
- 3. Происхождение названия Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — «вода» и γενναω — «рождаю»)
- 4. Распространенность Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех
- 5. Химические свойства Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию,
- 6. Записанное уравнение отражает восстановительные свойства водорода. N2 + 3H2 → 2NH3 С галогенами образует галогеноводороды: F2
- 7. Взаимодействие со щелочными и щёлочноземельными металлами При взаимодействии с активными металлами водород образует гидриды: 2Na +
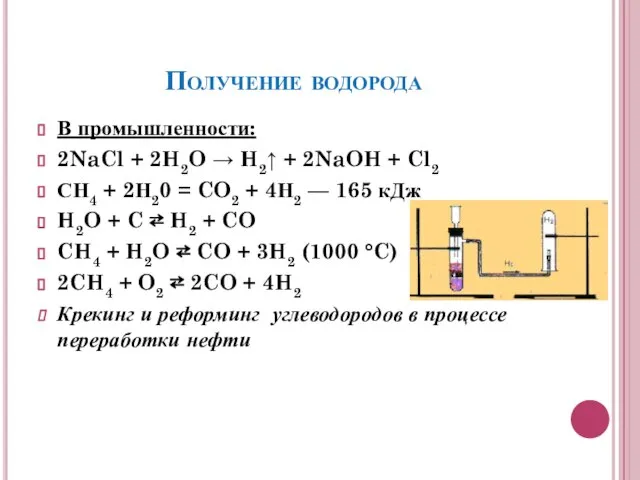
- 8. Получение водорода В промышленности: 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2 СН4 + 2Н20
- 9. В лаборатории: Zn + 2HCl → ZnCl2 + H2↑ Ca + 2H2O → Ca(OH)2 + H2↑
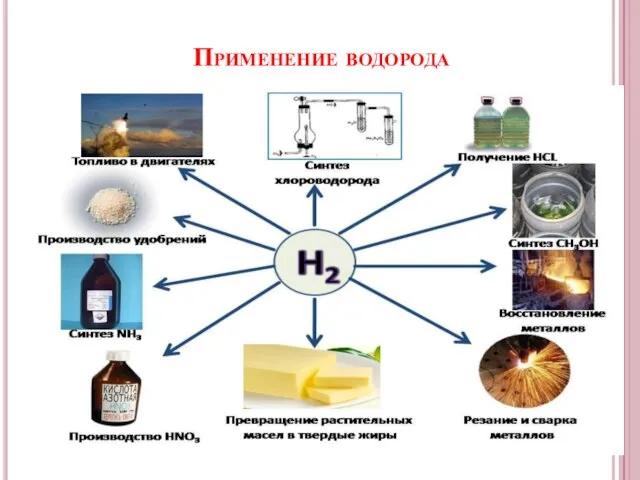
- 10. Применение водорода
- 12. Скачать презентацию







 Презентация на тему Герои-космонавты
Презентация на тему Герои-космонавты Презентация без названия
Презентация без названия Храм в честь Всех Святых
Храм в честь Всех Святых Деньги. Игра Верю – не верю
Деньги. Игра Верю – не верю Российский экономический менталитет.
Российский экономический менталитет. Стрелочные переводы
Стрелочные переводы Работа электрического тока 8 класс
Работа электрического тока 8 класс Виды и формы корпоративной литературы
Виды и формы корпоративной литературы Город, где живут морфемы
Город, где живут морфемы Бизнес-планирование и эффективная презентация
Бизнес-планирование и эффективная презентация Летучка по теме : Меры уголовно-процессуального принуждения Подготовила: Калужина Ю.К.
Летучка по теме : Меры уголовно-процессуального принуждения Подготовила: Калужина Ю.К. The difference between dc and ac generators
The difference between dc and ac generators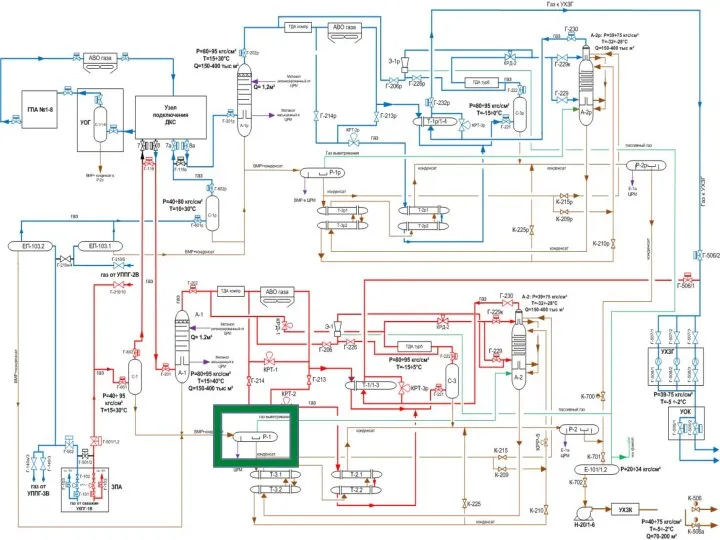 УК Проммаштехнология
УК Проммаштехнология Расчет тепловых процессов топки котла
Расчет тепловых процессов топки котла Правовые основы использования долин малых рек
Правовые основы использования долин малых рек ФСБУ 25 Применение. На что обратить внимание
ФСБУ 25 Применение. На что обратить внимание Убеждающая коммуникация
Убеждающая коммуникация Публичный доклад администрацииМуниципального бюджетного общеобразовательного учреждения«Средней общеобразовательной школы
Публичный доклад администрацииМуниципального бюджетного общеобразовательного учреждения«Средней общеобразовательной школы DexSys IT компания г. Ижевска
DexSys IT компания г. Ижевска Содержание предмета "Технология" с точки зрения нового образовательного стандарта
Содержание предмета "Технология" с точки зрения нового образовательного стандарта People
People Вечер памяти Александра Вампилова
Вечер памяти Александра Вампилова Путешествия. Карелия. Май 2017
Путешествия. Карелия. Май 2017 Системы автоматизации и телеметрии газорегуляторных пунктов. Внедрение типовых технических решений в ГРС
Системы автоматизации и телеметрии газорегуляторных пунктов. Внедрение типовых технических решений в ГРС Импульс. Завод нефтегазового оборудования
Импульс. Завод нефтегазового оборудования Нефть США
Нефть США Война в изображении Л. Н. Толстого
Война в изображении Л. Н. Толстого Реконкиста. Образование централизованных государств на Пиренеях
Реконкиста. Образование централизованных государств на Пиренеях